Command Palette
Search for a command to run...
استنادًا إلى 14000 مجموعة بيانات من العالم الحقيقي، اقترحت جامعة واشنطن/مايكروسوفت وآخرون مشروع GigaTIME لإنشاء أطلس بانورامي للبيئة المناعية الدقيقة للورم.
في المشهد التطوري للسرطان، لا تهيمن البيئة المناعية الدقيقة للورم على نمو الخلايا السرطانية وغزوها وانتشارها فحسب، بل تؤثر أيضًا بشكل كبير على استجابة العلاج والتشخيص النهائي للمريض. لا يُعد هذا "أداءً منفردًا" للخلايا السرطانية، بل هو نظام بيئي ديناميكي للغاية، حيث تتشابك وتتفاعل الخلايا المناعية والخلايا الليفية والخلايا البطانية وغيرها من الخلايا، وتندمج معًا في المصفوفة خارج الخلوية، التي أُعيد تشكيل بنيتها ووظيفتها، لتشكل شبكة مرضية دقيقة ومعقدة.
يكمن مفتاح فك شفرة هذه الشبكة في فهم الحالات الوظيفية والتفاعلات بين الخلايا، وتُعد مستويات تنشيط بروتينات معينة بمثابة "شفرات جزيئية" بالغة الأهمية. تقليديًا،أصبحت تقنية الكيمياء المناعية النسيجية (IHC) أداة كلاسيكية لفك الشفرات نظرًا لقدرتها على تصوير موضع البروتين بصريًا.على سبيل المثال، يُستخدم تلوين PD-L1 على نطاق واسع لتحديد حالة نقاط التفتيش المناعية للتنبؤ بفعالية العلاج المناعي. مع ذلك، لا تستطيع تقنية التلوين المناعي النسيجي (IHC) التقاط معلومات عن بروتين واحد في كل مرة، مما يُصعّب إعادة بناء البيئة الحقيقية لتعايش البروتينات المتعددة، وهو ما يُشكّل عائقًا رئيسيًا أمام فهم أعمق لآلية الحوار بين الخلايا المناعية والورم.
للتغلب على هذا القيد، تم تطوير تقنية التألق المناعي المتعدد (mIF). فهي قادرة على عرض التوزيع المكاني لبروتينات متعددة في مقطع نسيجي واحد في آن واحد، مع الحفاظ التام على المعلومات السياقية لبنية النسيج.ومع ذلك، فإن هذه التقنية مكلفة ولها عملية معقدة، حيث أن التلوين والتصوير والتحليل كلها تستغرق وقتاً طويلاً للغاية.وهذا يجعل من الصعب تجميع البيانات على نطاق واسع ويعيق الترجمة السريرية.
على النقيض تمامًا، تُعدّ المقاطع المصبوغة بصبغة الهيماتوكسيلين والإيوسين متوفرة بكثرة وغير مكلفة في البيئات السريرية. ورغم أنها لا تكشف بشكل مباشر عن نشاط البروتين، إلا أنها تحافظ تمامًا على البنية العامة للنسيج وتفاصيل مورفولوجيا الخلايا. قد تعكس السمات الخفية داخلها الحالة الوظيفية للخلايا بشكل غير مباشر، لكن هذه الأنماط الدقيقة والمعقدة غالبًا ما تتجاوز حدود الإدراك البصري البشري.
في السنوات الأخيرة، أتاحت التطورات في تقنيات الذكاء الاصطناعي فرصًا جديدة. فمن خلال التدريب المسبق على كميات هائلة من الصور المرضية، أظهر الذكاء الاصطناعي قدرات تحليلية بصرية فائقة واستخراجًا دقيقًا للميزات. وهذا يقودنا إلى سؤال جوهري: هل يمكن استخدام الذكاء الاصطناعي "لفك تشفير" معلومات تنشيط البروتين من صور H&E المتوفرة بسهولة، وهي معلومات كانت تتطلب سابقًا تقنية mIF باهظة الثمن لالتقاطها؟
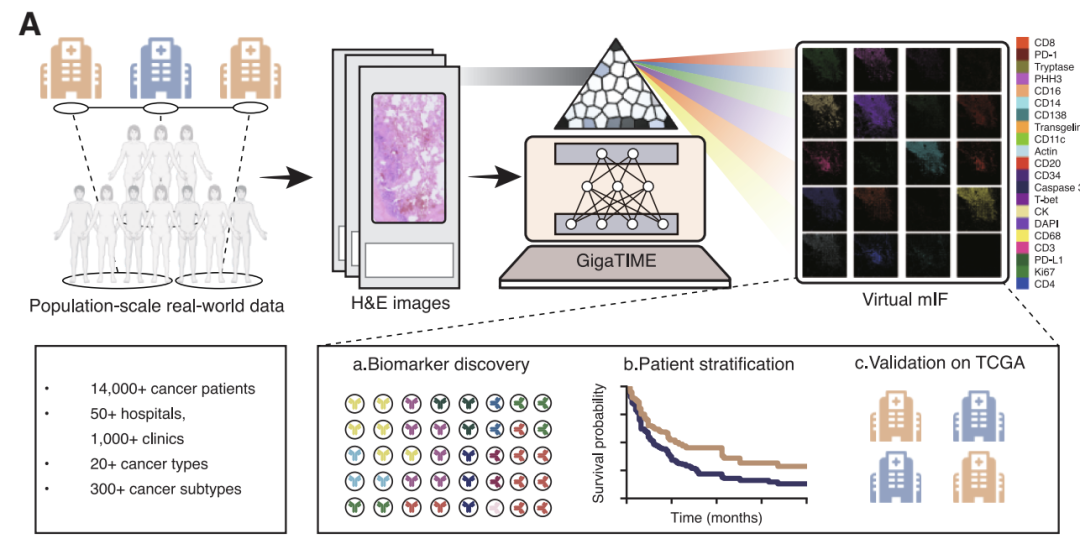
بناءً على هذا المنطق،اقترح فريق بحثي مؤلف من مايكروسوفت ريسيرش وجامعة واشنطن وبروفيدنس جينوميكس GigaTIME، وهو إطار عمل متعدد الوسائط للذكاء الاصطناعي.باستخدام تقنية التعلم متعدد الوسائط المتقدمة، يمكن توليد خرائط mIF افتراضية من شرائح الأنسجة المصبوغة بصبغة الهيماتوكسيلين والإيوسين التقليدية. وقد طبق فريق البحث هذه التقنية على مجموعة تضم أكثر من 14000 مريض سرطان في مركز بروفيدنس الطبي بالولايات المتحدة، شملت 24 نوعًا من السرطان و306 أنواع فرعية، مما أدى في النهاية إلى توليد ما يقرب من 300000 صورة mIF افتراضية، محققًا بذلك نمذجة منهجية للبيئة المناعية الدقيقة للورم في شريحة سكانية كبيرة ومتنوعة.
وقد نُشرت نتائج البحث ذات الصلة، بعنوان "الذكاء الاصطناعي متعدد الوسائط يولد سكانًا افتراضيين لنمذجة البيئة الدقيقة للورم"، في مجلة Cell.
أبرز الأبحاث:
* يستخدم GigaTIME الذكاء الاصطناعي متعدد الوسائط لتحويل شرائح علم الأمراض H&E إلى بيانات البروتينات المكانية، مما يؤدي إلى إنشاء مجموعات افتراضية تحتوي على حالات خلوية من شرائح H&E الروتينية.
* يدعم الاكتشاف السريري واسع النطاق وتصنيف المرضى، ويكشف عن أنماط تنشيط البروتين المكانية والتوافقية الجديدة.

عنوان الورقة:https://www.cell.com/cell/fulltext/S0092-8674(25)01312-1
تابع حسابنا الرسمي على WeChat وأجب بكلمة "التطعيمات المتعددة" في الخلفية للحصول على ملف PDF الكامل.
مزيد من أوراق البحث الرائدة في مجال الذكاء الاصطناعي:
https://hyper.ai/papers
مجموعات البيانات: بناء حلقة مغلقة كاملة من التدريب إلى التطبيق
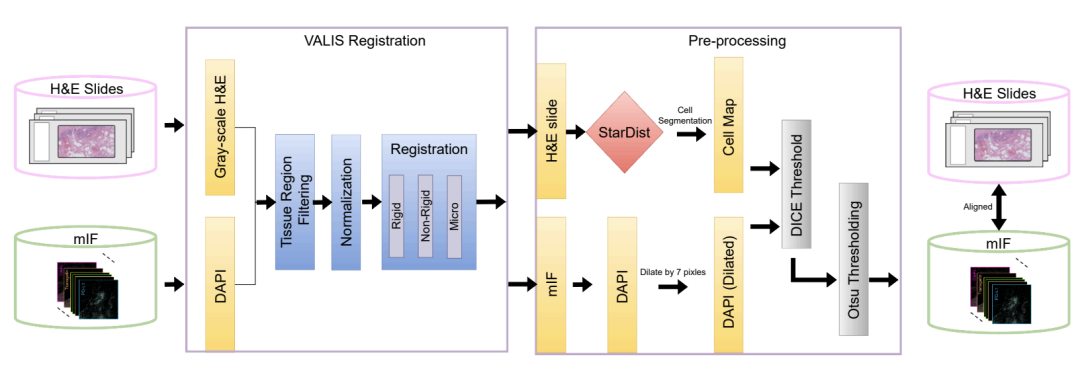
يتطلب تدريب النموذج أولاً معالجة تناقض جوهري: فصبغة الهيماتوكسيلين والإيوسين، المتوفرة على نطاق واسع ومنخفضة التكلفة في الممارسة السريرية، لا يمكنها الكشف مباشرة عن نشاط البروتين، بينما تقنية التألق المناعي المتعدد، التي يمكنها الكشف عن العلاقات المكانية بين بروتينات متعددة، مكلفة ومعقدة، مما يجعل تطبيقها على نطاق واسع أمراً صعباً. ولإنشاء نموذج ذكاء اصطناعي يربط بين تقنيتي التصوير هاتين،استخدم فريق البحث منصة COMET لجمع 441 صورة mIF من 21 مقطعًا مصبوغًا بصبغة H&E.كما هو موضح في الشكل أدناه، تغطي هذه الصور ما مجموعه 21 مؤشراً حيوياً رئيسياً، تتراوح من البروتينات النووية مثل DAPI وPHH3، والبروتينات السطحية مثل CD4 وCD11c، إلى البروتينات السيتوبلازمية مثل CD68. وهي توفر أدلة مهمة لتحليل تكوين الخلايا المناعية وحالتها الوظيفية ونشاطها في البيئة الدقيقة للورم.

بعد الحصول على الصور المزدوجة، يكمن التحدي الأكبر في استخلاص بيانات تدريب عالية الجودة منها. ولتحقيق هذه الغاية، وكما هو موضح في الشكل أدناه، صمم الفريق آلية معالجة دقيقة: أولًا، تُستخدم أداة VALIS لمحاذاة صورة H&E وصورة mIF بدقة على مستوى البكسل؛ ثم تُستخدم خوارزمية StarDist لتحديد كل خلية في الصورة وتقسيمها؛ وأخيرًا، يتم اختيار منطقة الصورة ذات أعلى جودة تسجيل بناءً على معامل دايس.
من خلال طبقات مراقبة الجودةقام الفريق باختيار 10 ملايين خلية عالية الجودة من البيانات الأولية التي تحتوي على 40 مليون خلية وقسمها إلى مجموعة تدريب ومجموعة تحقق ومجموعة اختبار مستقلة.بالإضافة إلى ذلك، قدمت الدراسة عينات من سرطان الثدي وسرطان الدماغ من مصفوفات الأنسجة الدقيقة كمجموعة تحقق خارجية. اختلفت هذه العينات اختلافًا كبيرًا عن بيانات التدريب في بنية الأنسجة وشكلها؛ إذ ظهرت على شكل كتل نسيجية أسطوانية صغيرة تفصلها مناطق فارغة، بدلًا من شرائح الأنسجة الكبيرة والمتصلة في بيانات التدريب، مما اختبر بفعالية قدرة النموذج على التعميم عند مواجهة أنواع جديدة من العينات وأنواع سرطان غير مألوفة.
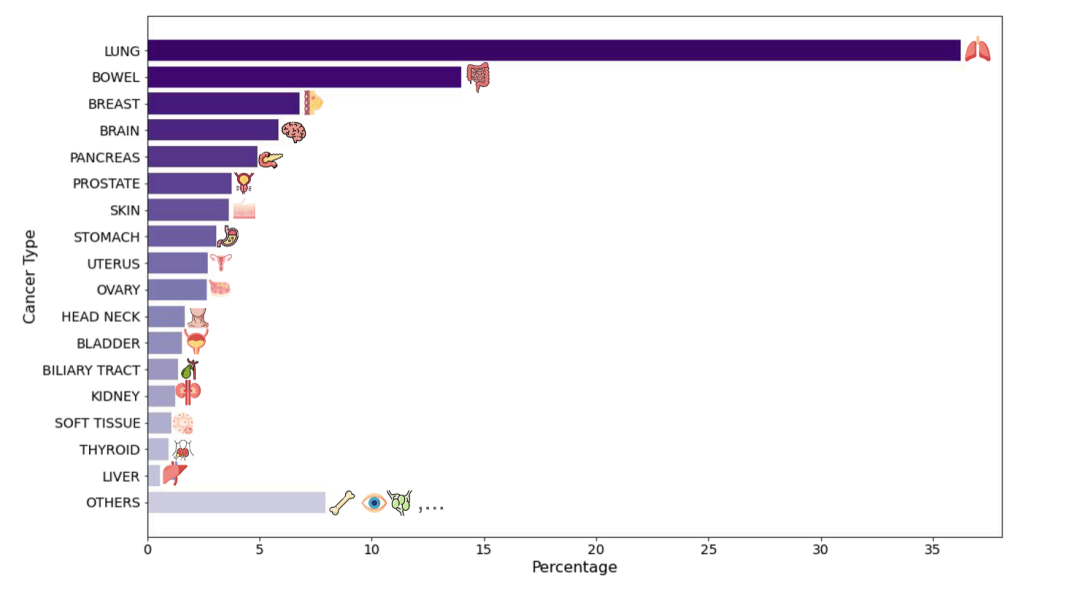
على مستوى تطبيق النموذج، قامت الدراسة بإنشاء مجموعتين سكانيتين افتراضيتين واسعتي النطاق ومتكاملتين.تأتي المجموعة الأولى من البيانات من الشبكة السريرية لمؤسسة بروفيدنس هيلث، وهي مجموعة رعاية صحية مقرها الولايات المتحدة، وتضم شرائح نسيجية مصبوغة بصبغة الهيماتوكسيلين والإيوسين (H&E) من 14256 مريضًا بالسرطان في 51 مستشفى وأكثر من 1000 عيادة. وتغطي هذه المجموعة 24 نوعًا رئيسيًا من السرطان و306 أنواع فرعية، وتدمج معلومات سريرية غنية مثل المؤشرات الحيوية الجينية، والتصنيف المرضي، ومتابعة معدلات البقاء على قيد الحياة. تكمن القيمة الفريدة لهذه البيانات في خصائصها الواقعية: فهي تمثل شريحة واسعة ومتنوعة من المرضى تغطي طيفًا كاملًا من مراحل المرض، من المراحل المبكرة إلى المتأخرة، مما يعكس بدقة تعقيدات الممارسة السريرية.
تم أخذ المجموعة الثانية من قاعدة البيانات العامة لأطلس جينوم السرطان (TCGA).شملت الدراسة 10200 شريحة مصبوغة بصبغة الهيماتوكسيلين والإيوسين، معظمها من حالات جراحية في مراحل مبكرة لم تخضع للعلاج. وقد أظهرت هاتان المجموعتان تباينًا واضحًا في أصل المرضى ومرحلة المرض والسياق السريري. وقد وفر هذا التصميم المتباين ظروفًا مثالية للتحقق من موثوقية النموذج وقابليته للتعميم: إذ تشير الاستنتاجات البيولوجية المتسقة والقوية عبر مجموعات البيانات المتنوعة هذه بقوة إلى إمكاناته السريرية الواسعة.
جيجا تايم: بناء جسور ذكية بين الشكل والوظيفة
يعالج نموذج GigaTIME بشكل مباشر إحدى العقبات الرئيسية في أبحاث البيئة المناعية الدقيقة للأورام: صعوبة تعميم تقنية mIF عالية التكلفة ومنخفضة الإنتاجية، في حين أن صور التلوين الروتيني باستخدام صبغة الهيماتوكسيلين والإيوسين (H&E) لا تعكس بشكل مباشر النشاط الوظيفي للبروتين. يستخدم هذا النموذج الذكاء الاصطناعي لتعلم وإنشاء صور mIF افتراضية من صور H&E، مما يوفر مسارًا عمليًا لتحليل منهجي ومنخفض التكلفة للبيئة المناعية الدقيقة للأورام على مستوى السكان.
يستخدم النموذج إطار عمل مشفر-مفكك مصمم بعناية، والذي تم بناء جوهره على شبكة متداخلة على شكل حرف U.تكمن ميزة هذه البنية في قدرتها على استخلاص كلٍّ من السمات المحلية الدقيقة والبنية التنظيمية العامة للصورة في آنٍ واحد. تحديدًا، يستخلص جزء التشفير في الشبكة تمثيلات متعددة المستويات للسمات من رقعة صورة H&E المدخلة بحجم 256×256 بكسل من خلال عمليات الالتفاف وتقليل الدقة؛ ثم يعيد جزء فك التشفير بناء هذه السمات المجردة إلى صورة mIF افتراضية بدقة مكانية من خلال زيادة الدقة ودمج السمات. يتيح هذا التصميم للنموذج التركيز على كلٍّ من الشكل الدقيق للخلايا الفردية والأنماط التنظيمية لمجموعات الخلايا.
على مستوى المخرجات، يعكس تصميم النموذج دراسة متعمقة للقضايا البيولوجية.بالنسبة لكل قناة من قنوات البروتين الـ 21 المحددة مسبقًا، يقوم برنامج GigaTIME بإجراء تنبؤ تصنيف ثنائي لكل بكسل في الصورة المدخلة.يحدد النظام ما إذا كان بروتين معين مُنشطًا في موقع محدد، مما يُنتج في النهاية خريطة لنشاط البروتين على مستوى البكسل. ويمكن دمج هذه التنبؤات المحلية بسلاسة لإعادة بناء صورة mIF افتراضية لشريحة النسيج بأكملها. يدعم هذا حساب مؤشرات كمية متنوعة، مثل كثافة التنشيط ونمط التوزيع المكاني لبروتينات معينة في منطقة الورم، مما يوفر أساسًا متينًا للبيانات لإجراء تحليلات عالية الإنتاجية ودراسات الارتباط السريري اللاحقة.
ولضمان تعلم النموذج بشكل فعال، تم تحسين استراتيجية التدريب بشكل منهجي.تجمع دالة الخسارة بذكاء بين خسارة دايس وخسارة الإنتروبيا التقاطعية الثنائية: تركز الأولى على ضمان التناسق العام بين المنطقة النشطة المتوقعة والمنطقة الحقيقية من حيث المحيط المكاني، بينما تركز الثانية على تحسين دقة تصنيف كل بكسل. يضمن التآزر بينهما إعادة بناء دقيقة للنمط المكاني العام وموثوقية عالية على مستوى التفاصيل. تم تدريب النموذج لمدة 250 دورة على 8 وحدات معالجة رسومية NVIDIA A100 بحجم دفعة 16 ومعدل تعلم 0.0001. تم تحديد جميع المعلمات الفائقة الرئيسية من خلال تصحيح أخطاء النظام بناءً على نتائج مجموعة التحقق.
من المهم بشكل خاص التأكيد على أن نجاح النموذج يعتمد بشكل كبير على بيانات التدريب عالية الجودة.استخدم فريق البحث إجراءات صارمة لتسجيل الصور وتقسيم الخلايا ومراقبة الجودة.تم اختيار 10 ملايين خلية عالية الجودة من البيانات الأولية الضخمة للتدريب، مما يضمن أن النموذج يتعلم عمليات ربط قوية وموثوقة وذات مغزى بيولوجيًا بين الوسائط، بدلاً من الانتظامات الإحصائية السطحية أو الأنماط الصاخبة.
نتائج واسعة النطاق تستند إلى ما يقرب من 300 ألف صورة افتراضية: يكشف مشروع GigaTIME عن 1234 ارتباطًا سريريًا
لتقييم أداء وقيمة GigaTIME بشكل شامل، قام فريق البحث بتصميم مخطط تقييم منهجي من بعدين: التحقق من صحة التكنولوجيا والنتائج السريرية.
فيما يتعلق بالتحقق الفني،قامت الدراسة بتقييم قدرات النموذج على تحويل الصور على ثلاثة مستويات: البكسل، والخلية، والشريحة.على مستوى البكسل، يتفوق GigaTIME بشكل ملحوظ على نموذج CycleGAN الأساسي في 15 قناة بروتينية من أصل 21. فعلى سبيل المثال، في قناة DAPI، يحقق GigaTIME معامل دايس قدره 0.72، متجاوزًا بكثير معامل 0.12 للنموذج الإحصائي الأساسي البسيط.
على المستوى الخلوي،حقق GigaTIME ارتباطًا قدره 0.59 على قناة DAPI، بينما وصل CycleGAN إلى 0.03 فقط، مقتربًا من مستوى عشوائي.
على مستوى الشريحةيبلغ معامل ارتباط قناة DAPI في GigaTIME 0.98، بمتوسط 0.56 عبر جميع القنوات، بينما يقترب معامل ارتباط CycleGAN من الصفر. تُظهر هذه النتائج أن التدريب الخاضع للإشراف القائم على بيانات مزدوجة عالية الجودة أمر بالغ الأهمية للتحويل الدقيق بين الوسائط.

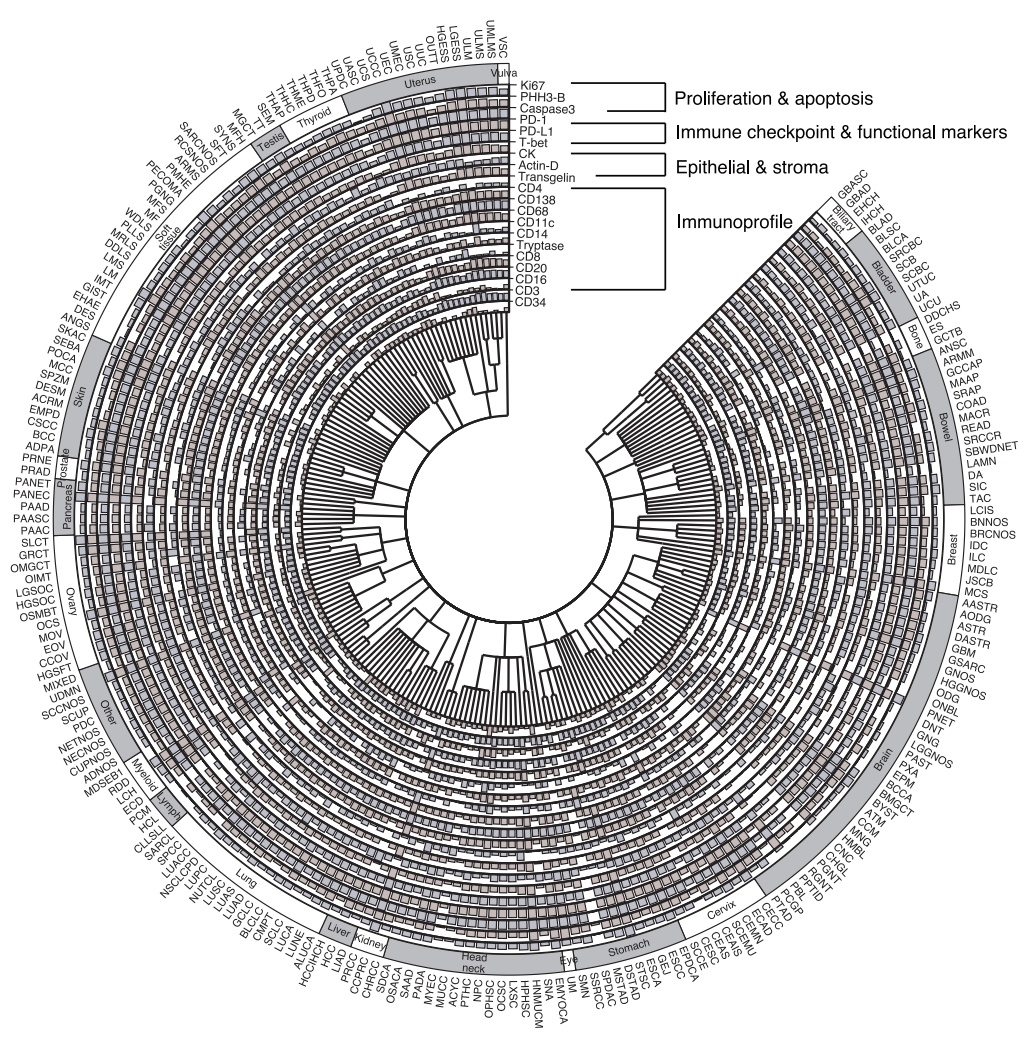
من حيث النتائج السريرية، استخدمت الدراسة ما يقرب من 300000 صورة افتراضية بتقنية mIF من 14256 مريضًا.تم تحليل العلاقة بين التعبير البروتيني الافتراضي و20 مؤشرًا حيويًا سريريًا بشكل منهجي.بعد إجراء اختبارات إحصائية صارمة وتصحيحات متعددة، تم تحديد ما مجموعه 1234 ارتباطًا مهمًا، موزعة على ثلاثة مستويات: السرطان الشامل، ونوع السرطان، والنوع الفرعي للسرطان.
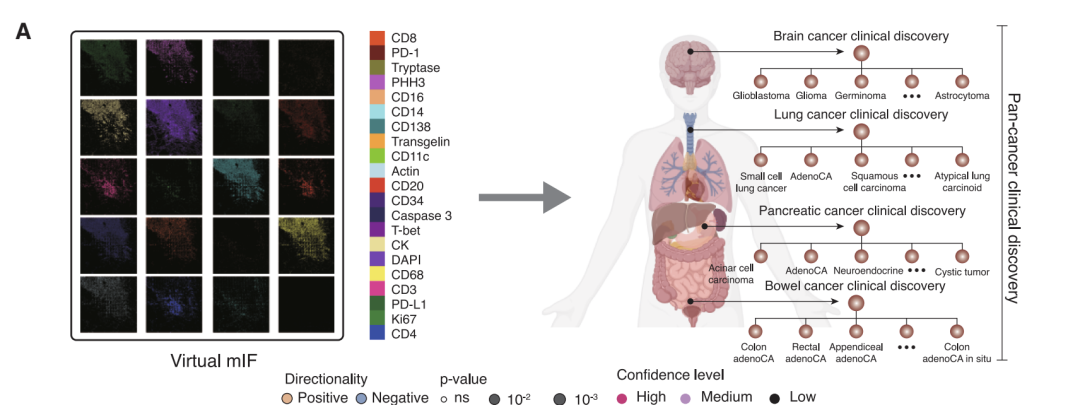
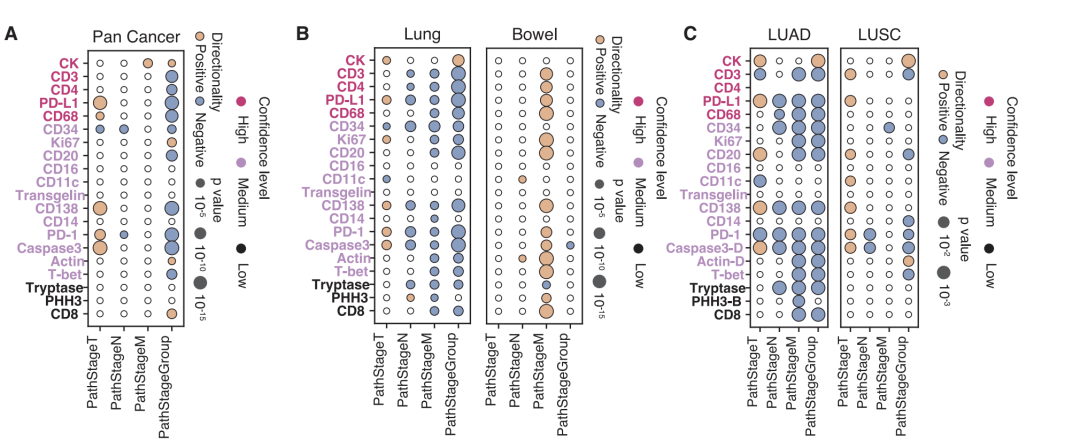
من بين 175 ارتباطًا تم تحديدها في تحليل السرطان الشامل، ارتبط ارتفاع معدل الطفرات الورمية وعدم استقرار الميكروساتلايت بشكلٍ كبير بزيادة تنشيط العديد من مؤشرات التسلل المناعي (CD138، CD20، CD68، وCD4)، بما يتوافق مع آلية تنشيط مناعي مدفوعة بالمستضد. كما تم اكتشاف أدلة جديدة: أظهرت طفرات KMT2D ارتباطًا إيجابيًا قويًا مع المؤشرات المناعية، مما يشير إلى احتمال تعزيز التسلل المناعي؛ بينما أظهرت طفرات KRAS ارتباطًا سلبيًا، مما يعكس نمطًا ظاهريًا للرفض المناعي. في أنواع وأنواع فرعية محددة من السرطان، كشف النموذج عن العديد من الارتباطات المحددة. على سبيل المثال، لم يتم الكشف عن الارتباط القوي بين طفرات T-bet وTP53 في سرطان الدماغ على مستوى السرطان الشامل، ربما بسبب البيئة المناعية الدقيقة الفريدة للجهاز العصبي المركزي. أظهر تحليل الأنواع الفرعية لسرطان الرئة أن طفرات PRKDC في سرطان الرئة الغدي كانت مرتبطة بشكل أقوى بعلامات الاستجابة المناعية مقارنة بسرطان الخلايا الحرشفية، مما يؤكد أهمية تفسير البيانات بالاقتران مع السياق النسيجي.
كما أكدت الدراسة قيمة البيانات الافتراضية في النتائج السريرية.كشف التحليل عن وجود ارتباط إيجابي بين حجم الورم الأولي (مرحلة T) ونقاط التفتيش المناعية وعلامات الغزو، إلا أن هذا الارتباط انعكس في المراحل المتقدمة، مما يشير إلى أن الأورام المتقدمة قد تكون مدفوعة بشكل أساسي بآليات أخرى للتهرب المناعي. وفي تحليل البقاء على قيد الحياة، تفوقت السمات المركبة التي تدمج جميع المسارات الـ 21 على تحليلات البروتين الواحد في تصنيف المرضى، مما يُظهر بوضوح قيمة التحليل المُدمج متعدد المعايير.
لضمان الموثوقية، تم التحقق من صحة جميع النتائج الرئيسية في مجموعات مستقلة من مشروع TCGA. وعلى الرغم من وجود اختلافات كبيرة في الأصل والخصائص السريرية بين المجموعتين، إلا أن النتائج الأساسية ظلت متسقة للغاية (معامل ارتباط سبيرمان 0.88 على مستوى النوع الفرعي للسرطان).أظهرت الارتباطات المهمة التي تم تحديدها بشكل شائع والبالغ عددها 80 ارتباطًا إثراءً إحصائيًا عاليًا للغاية (p<2×10⁻⁹).في الوقت نفسه، أظهرت المجموعة السكانية الافتراضية لمؤسسة بروفيدنس هيلث 331 ارتباطًا أكثر أهمية على مستوى السرطان الشامل مقارنة بمشروع TCGA، مما يسلط الضوء على القيمة الفريدة للبيانات الواقعية واسعة النطاق.
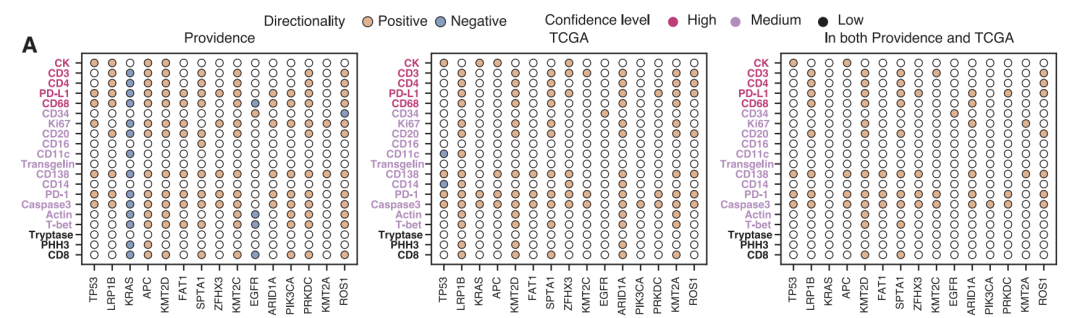
كشف التحليل الاستكشافي أيضًا عن أهمية الأنماط المكانية المعقدة. فقد تفوقت مؤشرات مثل الإنتروبيا، ونسبة الإشارة إلى الضوضاء، والحدة على كثافة التنشيط البسيطة في 89 و63 و79 زوجًا من البروتينات والعلامات الحيوية، على التوالي. كما كشفت الدراسة عن تأثيرات تآزرية بين البروتينات.لقد تفوقت تركيبة CD138 وCD68 على البروتينات الفردية في التنبؤ بـ 20 مؤشرًا حيويًا.كانت ثلاثة عشر من هذه الاختلافات ذات دلالة إحصائية، مما يشير إلى أن الخلايا البلازمية والخلايا البلعمية قد تعمل معًا لمحاربة الأورام من خلال آلية تعتمد على الأجسام المضادة.
مدعوم بالذكاء الاصطناعي: من خرائط البروتين الافتراضية إلى آفاق جديدة في أبحاث السرطان
يُعدّ توليد صور البروتينات الافتراضية من شرائح علم الأمراض الروتينية باستخدام الذكاء الاصطناعي جوهر الابتكار في علم الأمراض الرقمي وعلم الأحياء الحاسوبي. وقد استقطب هذا التوجه اهتمام كبرى المؤسسات الأكاديمية في جميع أنحاء العالم، كما حفّز الممارسات التجارية لشركات التكنولوجيا الحيوية.
في الأوساط الأكاديمية،نموذج HEX الذي نشرته جامعة ستانفورد في مجلة Nature Medicineبعد تدريبه على 819,000 مجموعة صور مزدوجة، يستطيع النظام التنبؤ بالتعبير المكاني لـ 40 مؤشرًا حيويًا، مما يُظهر تغطية بروتينية أوسع من نظام GigaTIME. وقد حقق نظام DeepHeme، الذي نشرته جامعة كاليفورنيا في سان فرانسيسكو في مجلة Science Translational Medicine، استنادًا إلى ما يقرب من 50,000 مجموعة بيانات عالية الجودة من مراكز متعددة، تصنيفًا دقيقًا لـ 23 نوعًا من خلايا نخاع العظم، مما يوفر نموذجًا لأتمتة تشخيص أمراض الدم.
في هذا المجال، تحظى شركة Reveal Biosciences بدعم مؤسسة بيل وميليندا غيتس.قم بتطوير منصة لاستخراج "المؤشرات الحيوية الرقمية" من الصور المرضية.تسريع أبحاث الصحة العالمية. يتمثل أحد الأساليب الأخرى في خفض التكاليف من خلال ابتكار الأجهزة، مثل أجهزة الموائع الدقيقة من شركة ميكرونيت التي تقلل بشكل كبير من استهلاك العينات والكواشف. توفر منصة أوبتيلوم التشخيصية لعقيدات الرئة، الحاصلة على موافقة إدارة الغذاء والدواء الأمريكية، نموذجًا تجاريًا وسابقة تنظيمية لاستخلاص خصائص أعمق من البيانات الروتينية لدعم اتخاذ القرارات السريرية.
يُعدّ GigaTIME علامة فارقة في هذا المجال.وهذا لا يوضح فقط الإمكانات الهائلة للذكاء الاصطناعي متعدد الوسائط في دراسة البيئة المناعية الدقيقة للورم، ولكنه يوفر أيضًا إطارًا تقنيًا قابلًا لإعادة الاستخدام وموارد بيانات للبحوث اللاحقة.سيعتمد التطور المستقبلي على التقدم المشترك لقدرات توليد البيانات "الواقعية الافتراضية" وتقنيات الكشف منخفضة التكلفة، مما سيؤدي في النهاية إلى توفير أدوات تحويلية لفهم تعقيد الأورام وتسريع الطب الدقيق.
روابط مرجعية:
1.https://mp.weixin.qq.com/s/AsqSemP3idCbIJ7xQ3gXGg
2.https://mp.weixin.qq.com/s/umg-UrMm6Qe-R-MbLpLZOQ