Command Palette
Search for a command to run...
化学療法抵抗性と腫瘍再発と闘いましょう!山東大学の研究チームは AI を使用して乳がん幹細胞に対する強力な防御線を構築

乳がんは女性の悪性腫瘍の「第一の死因」と言え、医学界では常に困難を克服するための焦点となってきました。現在、細胞傷害性化学療法は乳がん患者に対する最も一般的な全身治療です。これにより疾患をある程度軽減できますが、がん細胞は依然として再発または転移する可能性があります。
過去の研究によると、乳がん幹細胞(BCSC)は、化学療法や放射線療法に対する乳がんの抵抗性の根本原因です。 BCSC は乳がん細胞のほんの一部を構成していますが、無制限に増殖し、腫瘍を発生させる驚くべき潜在力を持っています。さらに衝撃的なのは、化学療法のプロセス自体も非BCSC細胞のBCSCへの変換を促進する可能性があり、その結果、腫瘍の再発と転移のリスクが悪化する可能性があることです。
化学療法に対する BCSC の反応機構を深く理解することは、乳がん患者の予後を改善するために非常に重要であることがわかります。BCSC を特定して阻害し、既存の治療選択肢を最適化できる方法が臨床的に緊急に必要とされています。 。
この課題に直面して、山東大学の Lv Haiquan 氏、Sun Rong 氏、Zhang Kai 氏、山西医科大学の Mei Qi 氏は、Helix Matrix Company およびその他の研究チームと協力して、機械学習テクノロジーを使用し、mRNA 解析に基づいた画期的な進歩を遂げました。原発性乳がんを評価する方法。がん患者サンプルの BCSC サイン中のがん幹細胞を特徴付ける新しいアプローチ。この研究は、BCSCの調節におけるポリアミン同化作用の中核的な役割を明らかにするだけでなく、乳がんの臨床治療に対する新しい戦略と方向性も提供します。
この研究は「ポリアミン同化作用が化学療法誘発性乳がん幹細胞濃縮を促進する」と題され、国際的に有名な学術誌「Advanced Science」に掲載された。
研究のハイライト:
* 研究者らは、乳がん患者サンプルのがん幹細胞性を評価するために、機械学習手法を通じて mRNA ベースの BCSC シグネチャを開発しました。
* この研究では、ポリアミン同化作用が BCSC の調節において重要な役割を果たしていることが判明しました。化学療法は、HIF-1 によって調節されるポリアミン同化作用経路を活性化することによって BCSC の濃縮を促進します。
* この研究では、併用すると化学療法誘発性の HIF-1 転写活性、ポリアミン代謝レベル、および BCSC 濃縮を効果的に阻害できる、新しい特異的 HIF-1 阻害剤ブリタニンを発見しました。

用紙のアドレス:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202404853
TCGA データセットを使用して、ピアソン相関分析と機械学習アルゴリズムの間の相関関係を構築します。
原発性乳がん患者サンプルの幹細胞の特性を遺伝子発現レベルを通じて定量的に評価するために、この研究では、Cancer Genome Atlas Consortium (TCGA) の乳房浸潤がんを利用しました。 (BRCA) データセットを使用すると、ピアソン相関係数分析による一変量ロジスティック回帰 (OCLR) 機械学習アルゴリズムに基づいて、mRNA 発現が mRNA 幹細胞インデックス (mRNAsi) と相関し、それによって mRNA ベースの BCSC シグネチャが開発されました。
同時に、この研究では、2,032 人の乳がん患者のデータセットに基づいてカプランマイヤー曲線も作成されました。これらのデータの一部は原発腫瘍における BCSC P-Sig および N-Sig の発現によって層別化されました。一部は化学療法を受けていることに基づいており、1,372 人の乳がん患者のデータセットが作成されました。
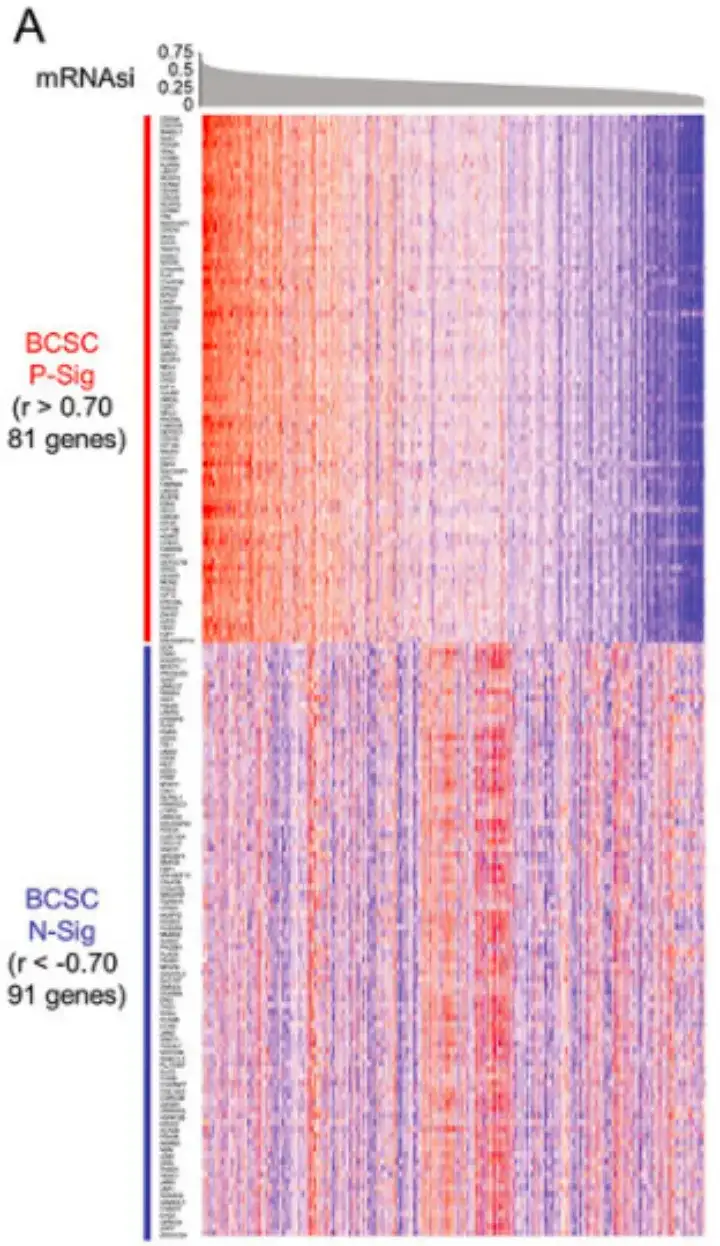
具体的には、以下の図 A に示すように、この研究ではまず、ピアソン相関係数 r>0.70 を持つ 81 個の遺伝子と、ピアソン相関係数 r<-0.70 を持つ 91 個の遺伝子を特定し、それらを BCSC 陽性サイン (P-Sig) および陰性サイン (P-Sig) として定義しました。 N-シグ)。
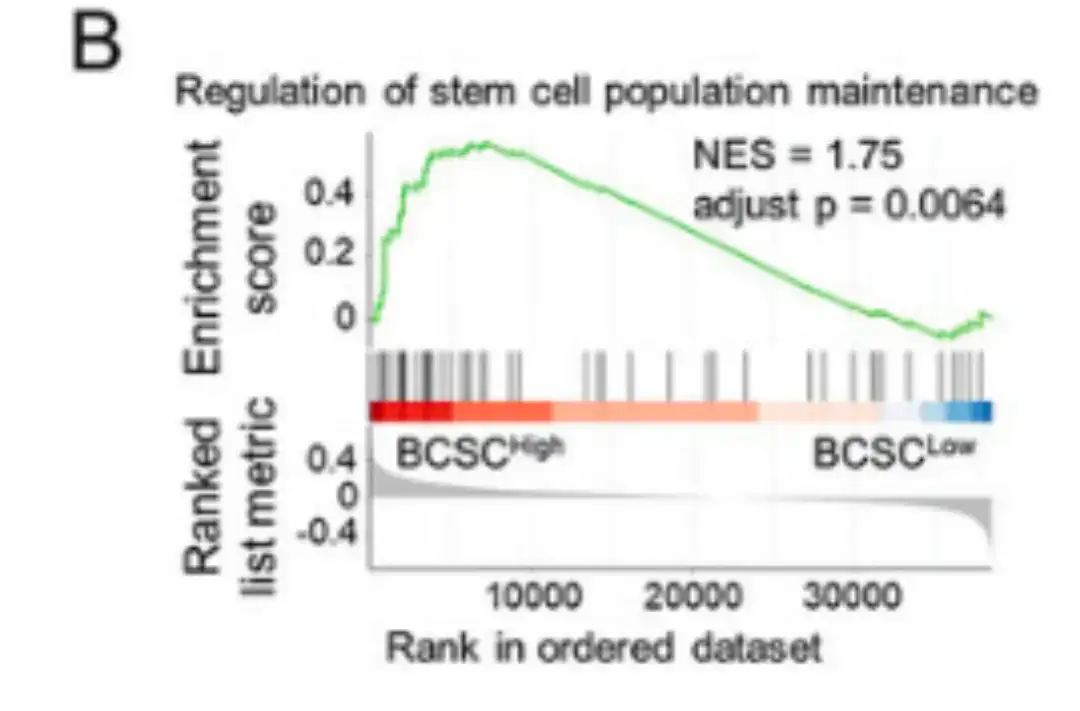
続いて、以下の図 B に示すように、この研究では、BCSChigh データ グループと BCSClow データ グループを比較し、BCSC サインの発現に基づいてグループを階層化することにより、ランキングベースの遺伝子セット濃縮分析 (GSEA) を実行しました。
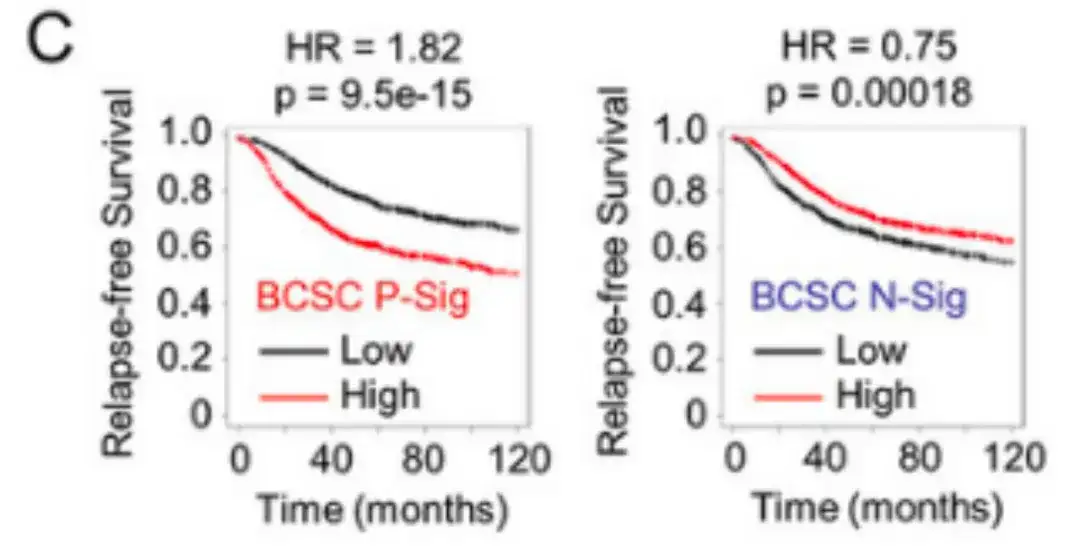
研究者らは、2,032 人の患者における BCSC シグネチャー発現と無再発生存期間 (RFS) の相関関係を分析した結果、BCSC P-Sig 発現が中央値を上回る患者では RFS が著しく低いのに対し、Sig 発現が中央値を上回る BCSC N- 患者では RFS が有意に低いことが判明しました。以下の図 C に示すように、RFS が増加しました。
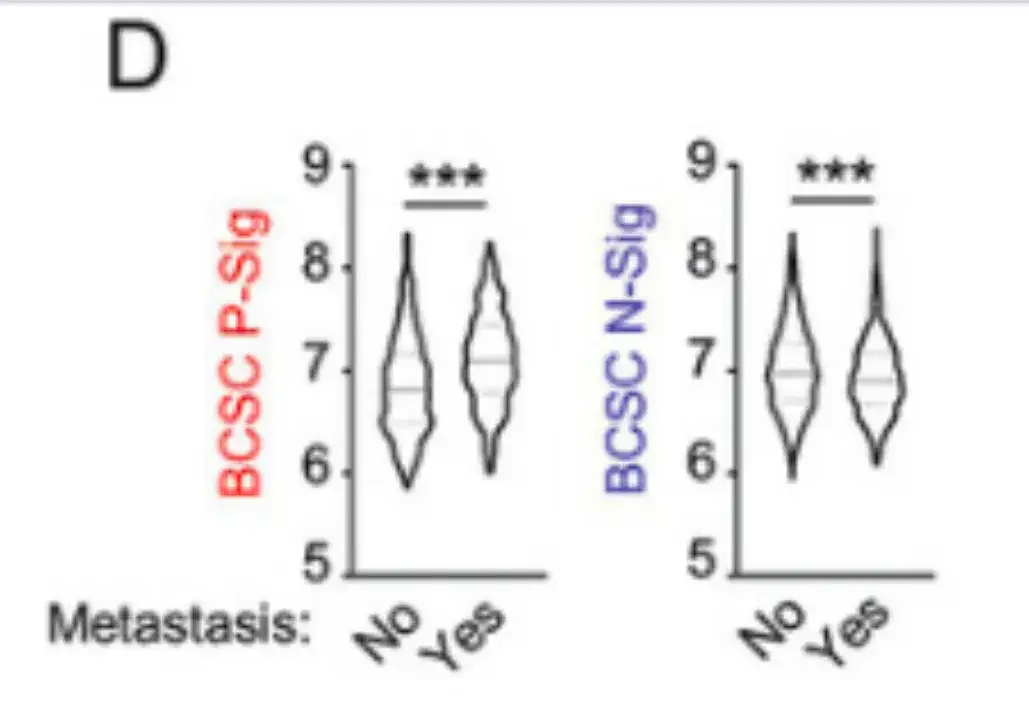
この研究では、国際乳がん協会の分子分類データベース (METABRIC) に登録されている 1,979 人の乳がん患者のデータも分析されました。結果を以下の図Dに示します。転移を発症しなかった患者と比較して、5年以内に転移を発症した患者では、原発腫瘍におけるBCSC P-Sigの発現が高く、BCSC N-Sigの発現が低かった。
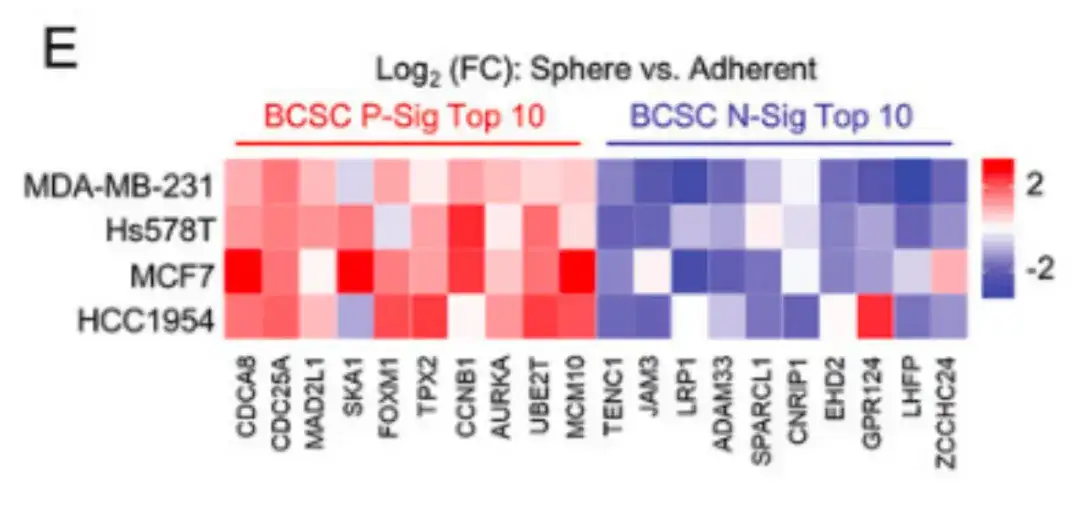
さらに、以下の図 E では、この研究では、複数の乳がん細胞株におけるBCSCの特徴も検証されました。マンモスフィア培地で培養された乳がん細胞は、標準的なポリスチレン組織培養皿で培養された細胞と比較して、BCSC P-Sig の発現が高く、BCSC N-Sig の発現が低い。
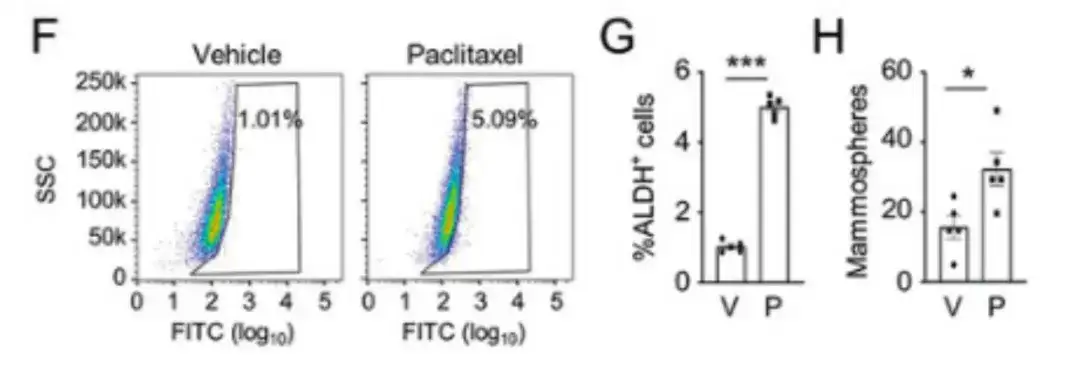
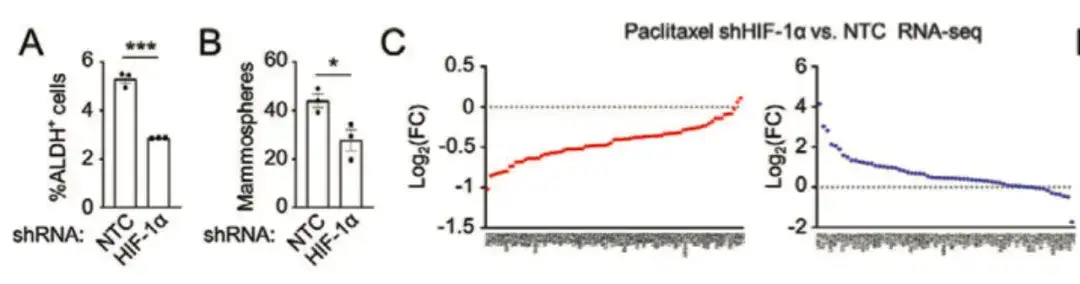
化学療法薬がBCSC集団にどのような影響を与えるかを評価するには、この研究では、ヒト乳がん細胞 MDA-MB-231 を雌の重症複合型免疫不全症 (SCID) マウスの乳房脂肪体 (MFP) に注射し、マウスをパクリタキセルで治療しました。以下の図F、G、およびHに示すように、パクリタキセルは、アルデヒドデヒドロゲナーゼ活性(ALDH+)細胞の割合およびマンモスフェア形成細胞の数を有意に増加させた。
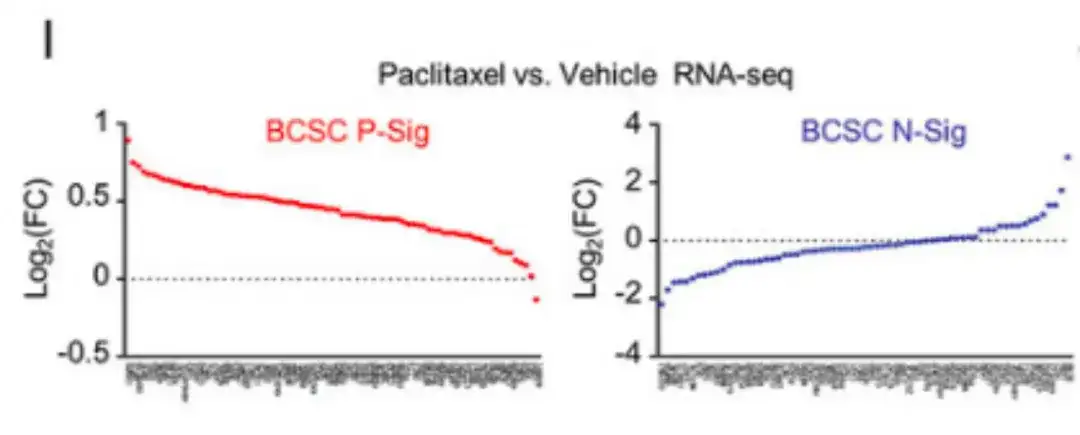
一方、以下の図 I では、RNA-seq 分析により、パクリタキセル治療によりほとんどの BCSC P-Sig 遺伝子の発現が増加し、ほとんどの BCSC N-Sig 遺伝子の発現が減少したことが示されています。
以下の図 J では、パクリタキセルに加えて、この研究では FDA 承認の化学療法薬ゲムシタビンとカルボプラチンでも乳がん細胞を治療しました。これらの薬剤は、BCSC P-Sig 遺伝子の発現を増加させ、BCSC N-Sig 遺伝子の発現を減少させました。以下の図 K に示すように、METABRIC 患者のサンプルでは、術前化学療法を受けている患者では原発腫瘍組織における BCSC P-Sig 遺伝子の発現が高いのに対し、BCSC N-Sig 遺伝子の発現は低いことも示されました。
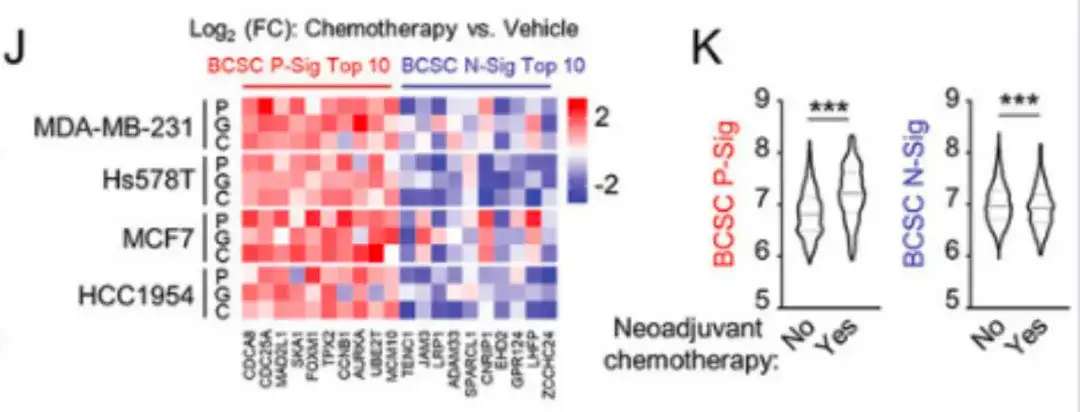
ポリアミン同化作用はBCSCの濃縮と正の相関があり、HIF-1阻害剤ブリタンニンはポリアミン生合成を減少させ、BCSCを根絶します。
化学療法によるBCSC濃縮の誘導機構を細胞代謝の観点から解明するために、この研究では、以下の図Aに示すように、TCGA BRCAの21人の患者をBCSC特性の発現に基づいてBCSChighグループとBCSClowグループに分け、2つのグループ間で399の代謝産物のレベルを比較しました。
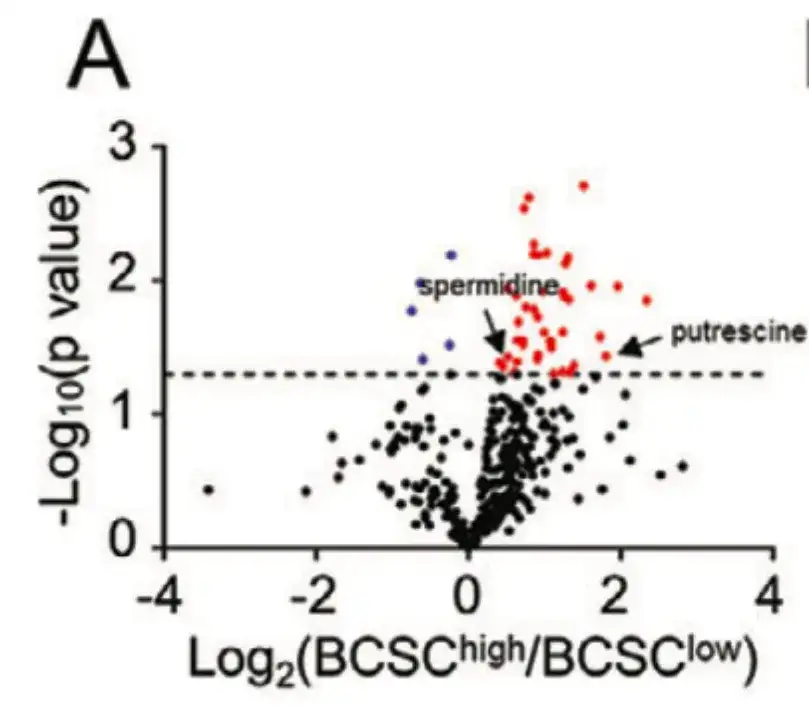
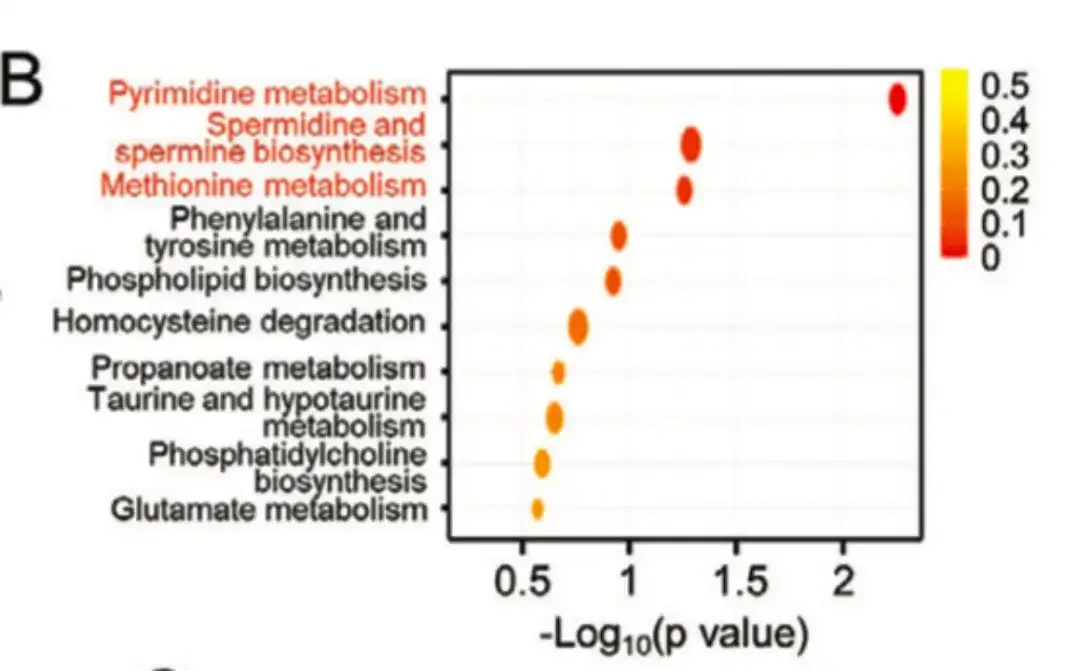
以下の図Bに示すように、この研究は代謝経路濃縮分析を通じて、ポリアミン同化作用に関連する経路で異なるレベルの代謝産物濃縮が形成されることを示しました。
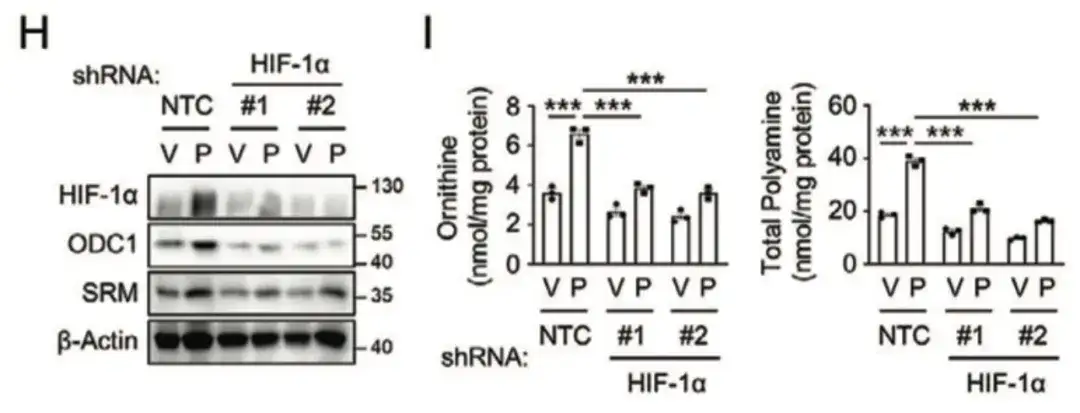
以下の図 C と D では、この研究では、オルニチンデカルボキシラーゼ 1 (ODC1)、ヒトスペルミジンシンターゼ (SRM)、およびスペルミンシンターゼ (SMS) などのポリアミン同化経路の主要な酵素の発現が、BCSClow グループよりも BCSChigh グループで高いことが判明しました。また、発現は単層培養よりも非接着性乳がん細胞株で増殖させたスフェロイド培養の方が高く、BCSC表現型制御におけるポリアミン生合成の重要な役割を示唆している。同時に、以下の図 E に示すように、パクリタキセル治療により、乳がん細胞株における ODC1 および SRM の発現が増加しました。
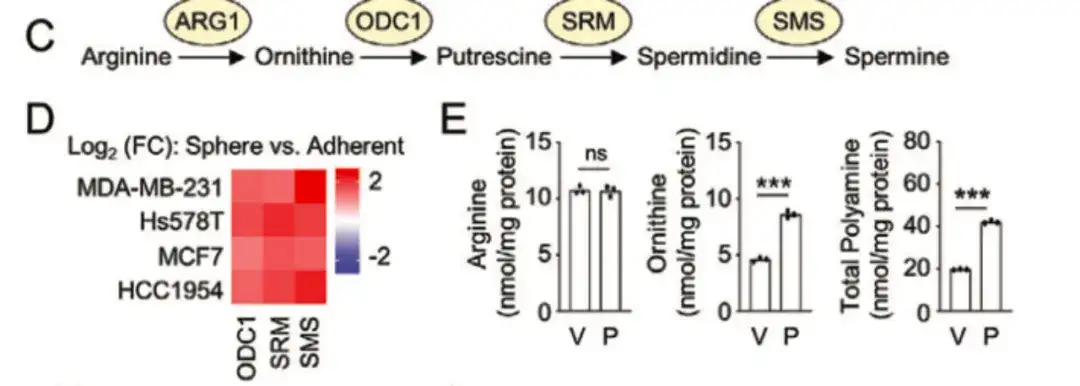
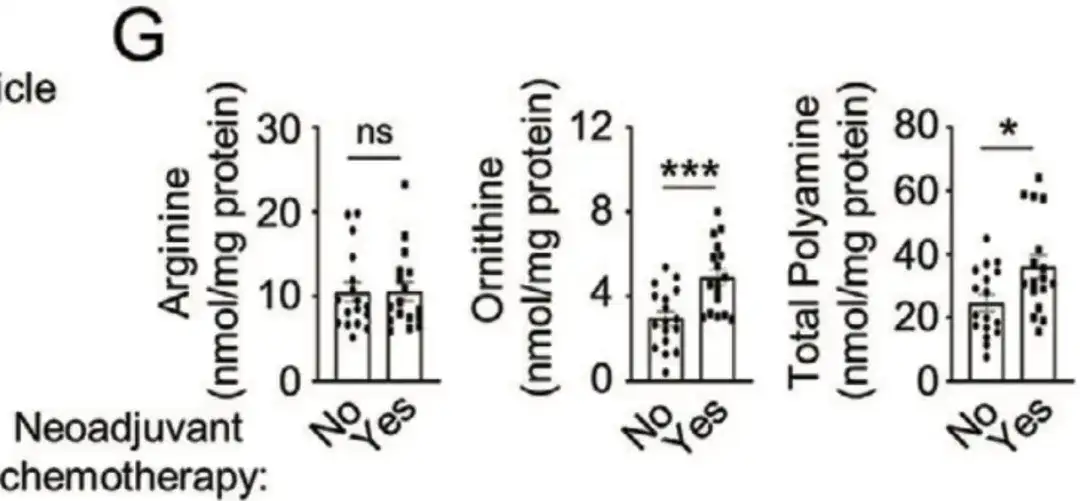
さらに、以下の図 G では、この研究では、山東大学斉魯病院の脱感作乳がん患者 34 人からもサンプルを収集しました。それを分析したところ、術前化学療法を受けた患者の細胞内オルニチンとポリアミンのレベルが有意に高かったことがわかりました。これらの研究は、ポリアミン同化作用の強化が化学療法誘発性のBCSC濃縮を促進することを示唆しています。
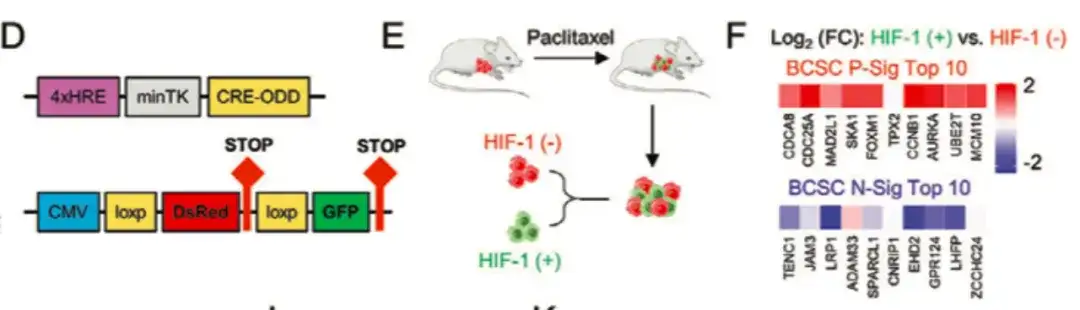
化学療法が乳がんにおけるポリアミン同化作用を促進する分子機構をさらに分析するために、この研究では次のことが判明しました。低酸素誘導因子 (HIF-1α) の阻害により、パクリタキセルを介した ALDH+ および球体形成能力の増加が減弱します。ほとんどのBCSC P-Sig遺伝子の発現は減少しましたが、ほとんどのBCSC N-Sig遺伝子の発現は増加しました。これは、以下の図ACに示すように、HIF-1がパクリタキセル誘導性のBCSC濃縮の制御において重要な役割を果たしていることを示しています。
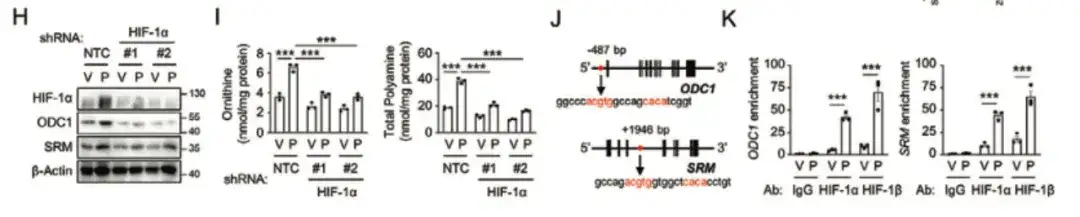
以下の DG に示すように、BCSC 表現型制御における HIF-1 の役割をさらに研究するために、この研究では HIF-1 発現蛍光追跡システムを使用して MDA-MB-231 をトランスフェクトし、パクリタキセル処理後のマウスを収集しました。腫瘍組織を取得し、細胞を DsRed+/GFP- (HIF-1-) 細胞群と GFP+ (HIF-1+) 細胞群に分けました。DsRed+/GFP- 細胞集団と比較して、HIF-1 発現と転写活性が高い GFP+ 細胞集団では、BCSC P-Sig 遺伝子発現が増加し、BCSC N-Sig 発現が減少しました。同時に、GFP+ 細胞の腫瘍形成能も低下しました。は、未処理グループまたは DsRed+/GFP- 細胞よりも有意に高かった。
以下の図 H および I では、この研究では、HIF-1α の阻害がパクリタキセル誘導性の ODC1 および SRM 発現をブロックすることを発見し、パクリタキセルが HIF-1 依存的にポリアミン同化作用を促進したことを示しています。
最後に、この研究では、以下の図 LQ に示すように、HIF-1 が転写を通じて ODC1 および SRM 遺伝子を活性化し、ポリアミンの同化作用を促進し、それが化学療法誘発性 BCSC の濃縮につながることを発見しました。

以下の図Aに示すように、この研究ではHIF-1転写活性レポーターシステムを使用してSUM159細胞をトランスフェクトし、4,320の天然化合物を含む天然物ライブラリー内の新しいHIF-1阻害剤をスクリーニングしました。研究の結果、Inula aucheriana 由来のブリタンニンは、用量依存的に HIF-1 の転写活性を効果的に阻害します。ブリタンニンとパクリタキセルを併用すると、パクリタキセルによって引き起こされる細胞内アルギニンおよびポリアミンレベルの増加を用量依存的にブロックできます。以下の図 BF に示すように。
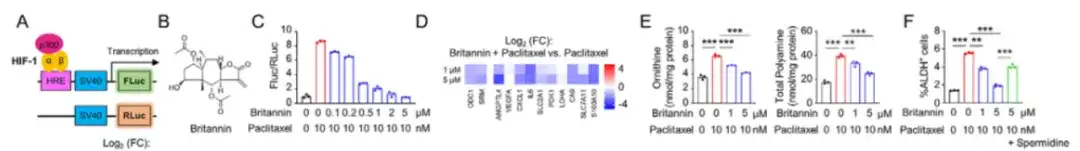
ブリタニンが HIF-1 転写活性を阻害するメカニズムを研究するために、以下の図 HK では、MDA-MB-231 細胞に HIF-1 転写活性レポーター システムを同時トランスフェクトしました。その結果、ブリタニンはパクリタキセル誘発HIF-1α TAD活性レポーターシステムを用量依存的に減弱させることができ、ブリタニンは転写活性化因子p300をブロックすることでHIF-1の転写活性を阻害できることが示された。
下のパネル LQ では、研究では 2 × 106 MDA-MB-231 細胞を SCID マウスに注射し、パクリタキセル単独またはブリタニンと組み合わせてマウスを治療しました。その結果、併用治療はマウスの外観や体重に影響を与えることなく原発腫瘍の増殖を有意に抑制でき、薬物治療を中止してから100日後に10匹中3匹のマウスに腫瘍の再発が見られなかったことが示された。これは、パクリタキセルとブリタンニンによるマウスの併用治療がBCSCを完全に根絶できることを示しています。

AI は病理学的診断を支援、HER2 標的治療が鍵となる可能性
現在、乳がんの診断は画像診断のみならず、病理診断も重要な役割を果たしています。 HER2 (ヒト上皮成長因子受容体 2) の発現状態は乳がん治療において重要な考慮事項であり、AI は病理切片の分析で HER2 の発現レベルを特定するのに役立ち、その後の標的療法の参考になります。
原理は単純に見えますが、実装するのは簡単ではありません。例えば、AI技術を利用して乳がんにおけるHER2診断の精度と再現性を向上させるには、大量のトレーニングが必要であり、AIシステムと医療従事者の診断の継続的なデバッグと比較が必要です。これに基づいて、研究者らは、HER2 陰性と陽性の区別に焦点を当て、さまざまな異種 HER2 低発現乳がんの診断における AI の価値を評価するために、HER2 発現の下限に AI を集中させました。
実際には、山東大学のルー・ハイ泉教授は、早ければ2022年に生物医学雑誌Theranosticsに表紙記事を発表し、化学療法と組み合わせてA2BRを標的にすると、乳がん幹細胞の濃縮が阻止され、化学療法後の乳がん患者の生存率が向上する可能性があることを明らかにした。
論文リンク:
https://www.thno.org/v12p2598.htm

今回、Lu Haiquan教授は、ブリタンニンの併用によりHIF-1のポリアミン同化作用を阻害し、BCSCを根絶できることを再度明らかにした。これは間違いなく乳がんの治療に新しいアイデアを提供するものである。将来、AIは乳がんの治療においてこれまでにない重要な役割を果たし、医療・健康分野での応用がますます大きな可能性を示しています。テクノロジーの継続的な進歩と応用により、AI は乳がん、さらにはがん治療においても不可欠なパートナーとなり、患者により多くの力と希望をもたらすでしょう。