Command Palette
Search for a command to run...
臨床MRIデータの価値を最大化するために、UCLチームは多発性硬化症病変の定量化を実現するMindGlideモデルを提案した。
多発性硬化症(MS)は、中枢神経系の白質における炎症性脱髄病変を特徴とする慢性の障害疾患です。若者や中年層をターゲットにすることが多かったため、「若者の見えない殺人者」とも呼ばれている。関連統計によれば、世界中で280万人以上が影響を受けている。アジアでは、10万人中約1人から5人がMSに罹患しており、この疾患は中国では外傷に次いで若年層および中年層における障害の第2位の原因となっている。 2018年、中国はこの病気を「希少疾病第一リスト」に掲載した。
脳の磁気共鳴画像法 (MRI) バイオマーカーは、例えば複数の造影剤を用いた MRI スキャンを使用して病気の進行を捉えるなど、MS の臨床治療と研究において非常に重要です。しかし、複数の造影剤を使用するには、さまざまな種類の特殊なスキャン機器が必要であり、時間がかかり、労力と費用もかかるため、多くの病院ではこれらの設備が整っていません。したがって、MRI 分析をいかに簡素化するかが、特に単一コントラストによる脳容積計算を通じて問題を解決する鍵となり、これにより多重コントラスト取得の必要性が軽減されるだけでなく、臨床試験のコストも削減されます。
これを基に、ユニバーシティ・カレッジ・ロンドンの研究チームが「MindGlide」というツールを開発しました。MS 患者の治療中に取得された MRI スキャンから重要な情報を抽出できます。たとえば、脳の損傷領域、脳萎縮、プラークなどの微妙な変化です。 MindGlide は、従来の MRI スキャンでは理想的な画像コントラストが得られないことを実証します。新たな病変や微妙な脳組織の損傷を発見する可能性はまだ残っています。また、医療従事者がMS患者の治療効果を解釈・評価する能力をさらに向上させることにも役立つことが期待されます。
関連研究は、「臨床MRIアーカイブを多発性硬化症研究に再利用することで古いスキャンから新たな洞察を得る」というタイトルでNature Communicationsに掲載されました。
研究のハイライト:
*単一のMRIコントラストから複数の臨床的に関連するMRIバイオマーカーの抽出を可能にし、MindGlideはいくつかの重要な分野で最先端の技術を上回っています。
* 限られたMRIデータや、これらの作業に通常は使用されない単一のコントラストでも、臨床的に意味のある組織セグメンテーションと病変の定量化を実現できます。

用紙のアドレス:
https://go.hyper.ai/fDEgm
オープンソース プロジェクト「awesome-ai4s」は、100 を超える AI4S 論文の解釈をまとめており、大規模なデータ セットとツールも提供しています。
https://github.com/hyperai/awesome-ai4s
データセット: すべてのデータはMS患者から収集されています
モデルの信頼性と妥当性を検証するために、この研究ではさまざまなトレーニング データ セットと外部検証データ セットが使用され、データはすべて MS 患者から収集されました。この研究は、モントリオール神経学研究所の国際進行性多発性硬化症連盟データベースによって支援された。関連するトレーニング データは、主に MS-stat 試験、ORATORIO 試験、英国の 3 つの病院から取得した小児再発寛解型 MS 患者の日常診療データセット、および 2 つのオープン ソース病変セグメンテーション データセット (MS-30 および ISBI) から抽出されました。
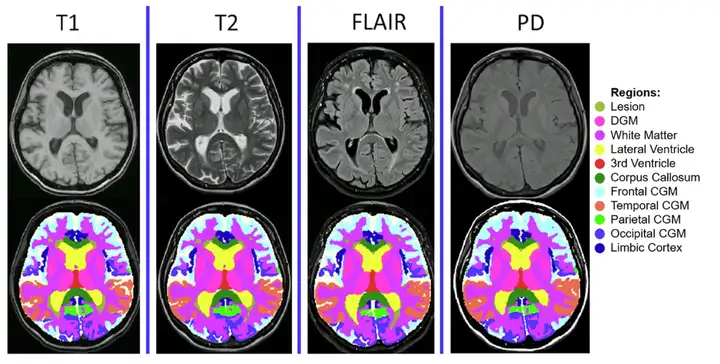
*MindGlide は、病院のアーカイブで一般的に使用される MRI コントラストと関連組織強度 (T1 強調、TI 強調、プロトン密度 (PD)、および T2 流体減衰反転回復 (FLAIR)) を使用して、2D および 3D スキャンを含む MRI を処理します。
モデルのトレーニング段階では、研究者らは、8,550枚の実際の画像と合成画像のデータセットを使用して、MindGlideをトレーニングしました。そのうち、2,871人の患者(再発寛解型MS患者(RRMS)1,082人、二次進行型MS患者(SPMS)1,453人、一次進行型MS患者(PPMS)336人を含む)から合計4,247枚の実際のMRIスキャン画像(TI強調画像2,092枚、FLAIR画像2,155枚を含む)が収集されました。スキャンは、1.5 テスラと 3 テスラの磁場で 592 台のプロ用 MRI スキャナーを使用して取得されました。その後、研究者らはトレーニングを拡張するために、さらに 4,303 件の合成スキャンを生成しました。
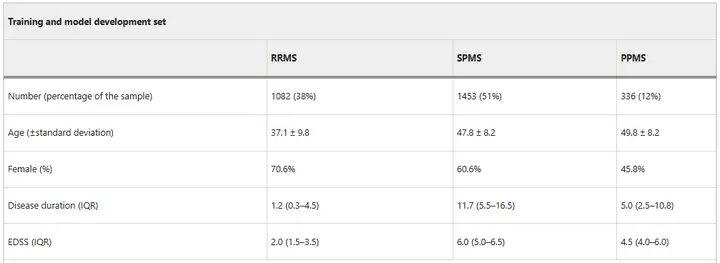
モデル検証段階では、研究者は外部検証セットを使用しました。MindGlide は、進行性 MS の臨床試験 2 件と再発寛解型 MS の小児患者の実際のグループを含め、14 歳から 64 歳までの年齢層で普遍的な使用についてテストされました。外部検証データセットには、186 台の MRI スキャナーから取得された 1,001 人の患者 (PPMS 試験で 699 人、SPMS 試験で 141 人、RRMS 試験で 161 人) が含まれていました。
で、PPMSデータセットには11,015件のMRIスキャンが含まれている(TI強調画像2,756枚、T2強調画像2,754枚、FLAIR画像2,749枚、PD画像2,756枚)、スライス厚はすべて3mm(1mm×1mm×3mm)であった。SPMSデータセットには763のスキャンが含まれています(378 TI 強調画像、385 T2 強調画像)、異なるスライス厚(T1 強調画像では 1mm x 1mm x 1mm、T2 強調画像では 3mm x 1mm x 1mm)小児RRMSデータセットには1,478のスキャンが含まれています(T1強調画像523枚、T2強調画像475枚、FLAIR画像480枚)、さまざまなスライス厚を含みます。
モデルアーキテクチャ: 効率的な3D畳み込みニューラルネットワーク
MindGlide は、U-Net アーキテクチャに基づく 3D 畳み込みニューラル ネットワーク (CNN) である「nnU-Net」に基づいて開発されています。自動的に自己構成する機能があるため、ハイパーパラメータの調整というコストのかかるプロセスを回避できます。トレーニングを通じて、MindGlide は脳の灰白質、白質領域、および MS 病変を同時にセグメント化できるため、実際の MRI の変化に適応し、従来の画像処理ソフトウェアのアーティファクトの問題を解決できます。全体的なアーキテクチャと戦略を下の図に示します。
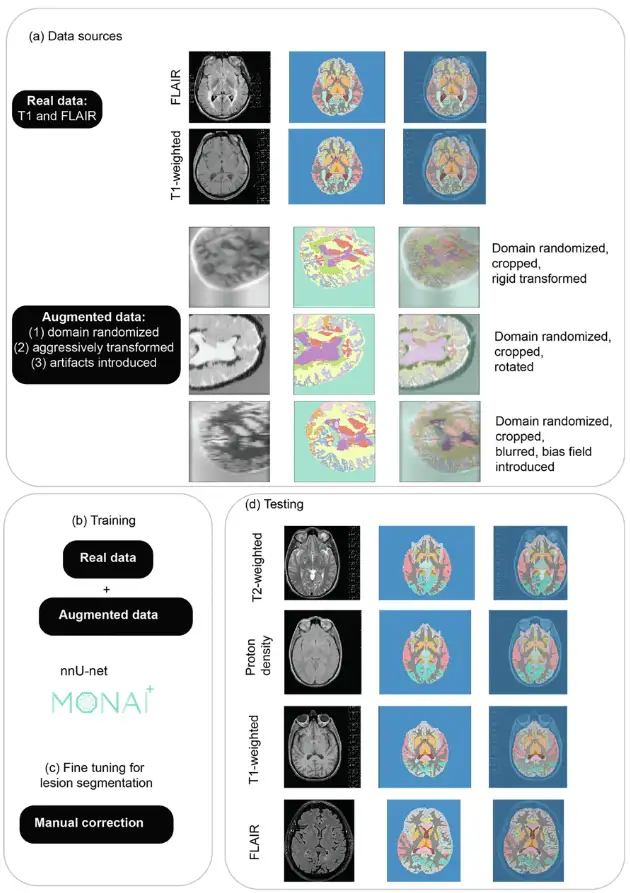
モデルトレーニングのための画像前処理では、研究者らは、まず画像解像度を 1 mm の等方性ボクセルに正規化し、次に nnU-Net に従って設計する最小限の前処理パイプラインを使用しました。その後、研究者らはスライディングウィンドウ技術を使用して 128 x 128 x 64 ボクセル パッチを抽出し、トレーニング中のメモリと計算効率を最適化しました。
データ拡張では主に、ランダムな変更を通じてトレーニング データの多様性を人工的に拡大し、モデルの一般化可能性を高め、過剰適合を減らします。研究者らは、実際のスキャンの形状と画像強度を歪める技術と合成スキャンを生成する技術という 2 つの技術を使用して適応性を拡大しました。図 (a) に示すように、ドメインランダム化を使用して強度変化を生成し、さまざまな MRI コントラストのモデルを準備します。
合成データは SynthSeg バージョン 2.0 を使用して生成され、研究者はトレーニング中の強化に MONAI バージョン 1.2.0 を使用し、その後、トレーニング データセットのラベルから直接、さまざまなコントラストの合成スキャンを生成しました。図 (a) は生成された合成データの例を示し、図 (b) は実際のデータと拡張データを使用して MindGlide をトレーニングする様子を示しています。
関連レポートでは、メディアは直感的なデータを使用してこのモデルの機能を実証しました。それは、以前は神経放射線科医が手作業で解釈するのに数週間かかっていた複雑なスキャンが、MindGlide を使用すると 1 画像あたりわずか 5 ~ 10 秒で完了します。これにより、これまで分析できなかった画像や日常的な MRI スキャンから新たな価値が得られるようになり、臨床試験や日常的なケアにおいてさまざまな治療法が病気の進行に及ぼす影響をテストするための、より信頼性の高い基盤が提供されます。
実験結果:多次元比較によりMindGlideの優位性が示された
MindGlide の検証効果を評価するために、研究者らはそれを既存の最先端技術である WMH-SynthSeg および SAMSEG と比較しました。前者は、異なる解像度とコントラストのスキャンから白質の高信号と脳の解剖学的構造を同時に分割することができ、後者は、異なる MRI コントラストの下で病変と脳の構造を堅牢に分割することができます。
まず、実験では、下の図に示すように、3 つの一貫性を人間の専門家によるラベル付けされた病変のセグメンテーションと障害と比較しました。 MindGlide と手動でラベル付けされた実際の病変との一致はより高くなりました。Dice スコアの中央値は 0.606、SAMSEG では 0.504、WMH-Synthseg では 0.385 でした。
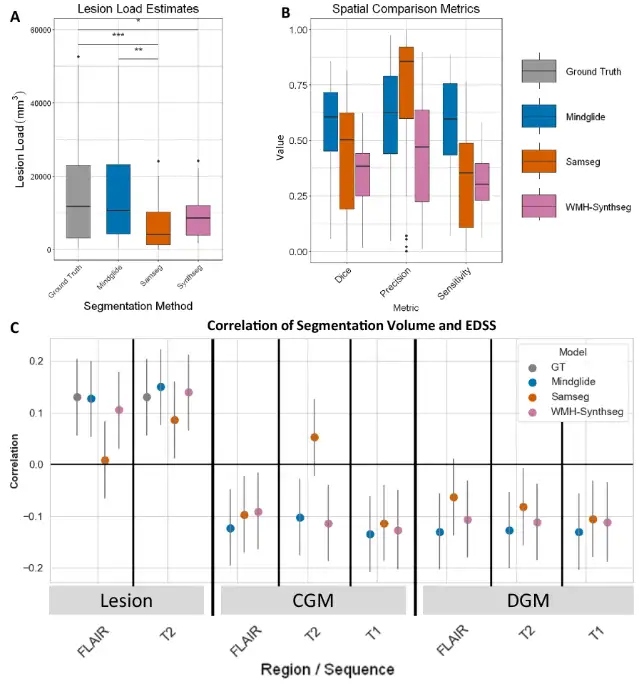
加えて、PPMS データセットでは、MindGlide によって導出された病変荷重と拡張障害状態尺度 (EDSS) の数値との相関も、既存の技術よりも高くなっています。
その後、研究者らは複数の実験を含む病変治療効果の長期的検証を実施し、MindGlide が治療効果の検出に有効であることを実証しました。例えば、SPMS 試験および PPMS 試験では、治療群の累積病変体積はプラセボ群よりも低かった。小児コホートでは、MindGlide は、下の図に示すように、異なる治療グループにおける病変体積の異なる変化を正常に検出しました。
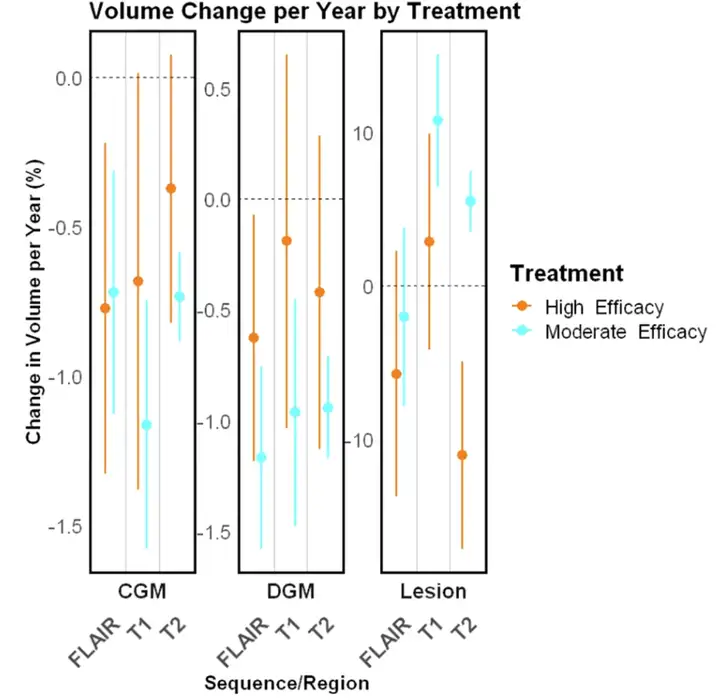
脳組織の損失に対する治療の効果を試験する際に、MindGlide では、治療群の皮質 GM 容積減少率がプラセボ群よりも大幅に低いことが示されました。次の図は、さまざまな対照的なセグメンテーションの例を示しています。
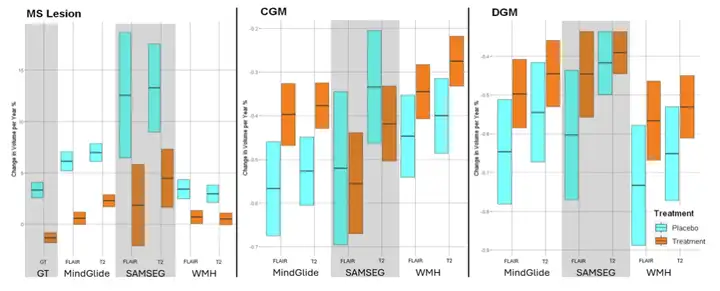
これに続いて研究者らは、PPMS臨床試験において、MindGlideの治療効果を他のセグメンテーションツールや実際の病変と比較しました。実験結果は、MindGlide が実際の結果に非常に近いことを示しています。対照的に、SAMSEG は治療効果を過大評価し、WHM-Synthseg は治療効果を過小評価しており、MindGlide は病変体積の推定においてより高い精度を持っていることを示しています。
下の図は、脳の局所容積の 3 つの評価を示しています。結果は、MindGlide の測定値が、縦断的 SAMSEG または WHM-Synthseg から得られた測定値と比較して、治療グループ間の治療効果が優れていることを示しました。
さらに、研究者らは日常診療の臨床データセットで WMH-Synthseg と MindGlide を視覚的に検査し、特にスキャンの厚さが 5 mm を超えた場合に前者が大きな失敗率を示していることを発見しました。視覚的に評価された 433 のコントラストのうち、WMH-Synthseg は 65 のスキャンをセグメント化できませんでしたが、MindGlide は 6 つのスキャンのみをセグメント化できませんでした。以下に例を示します。
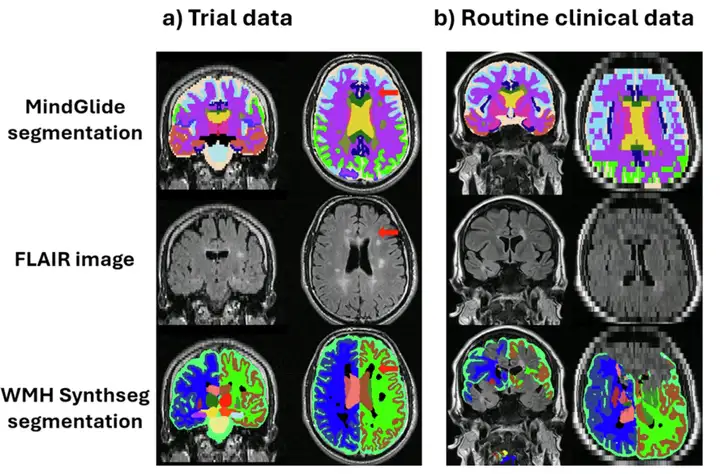
このうち、図 (b) は、WMH-Synthseg セグメンテーションが失敗した、日常診療臨床データセット (RRMS) の 7 mm 厚のスライスを示しています。これは、ほとんどのセグメンテーション ツールが優位または劣位の取得方向を使用するように設計されているのに対し、MindGlide では任意の方向で取得された画像のセグメンテーションが可能であるためです。
全体として、MindGlide は多くの点で既存の方法より優れており、単一の MRI コントラストから複数のバイオマーカーを抽出できるため、治療効果を効果的に監視でき、さまざまな臨床シナリオに適しています。MS 研究と臨床意思決定を強力にサポートします。
AIはMS研究において重要なツールとなっている
近年、人工知能の急速な発展により神経疾患への応用が加速しており、その独自の動作メカニズムと効率的な方法により、医学界に人工知能を通じてMS研究を行うための新たなアイデアを提供しています。偶然にも、多くの研究室が、人類の健康を脅かす大きな問題である多発性硬化症を克服するために人工知能を利用しようとしています。
例えば、トロント大学のFang Liu教授の研究グループは、「AMPA媒介興奮毒性を標的とする小分子は多発性硬化症のマウスモデルで治療効果を発揮する」と題する論文をScience Advancesに発表しました。この研究は、従来の理論的観点を克服し、画期的な小分子化合物を開発しました。これは、AMPA 受容体を介した興奮毒性の制御の新しいメカニズムを標的にして作用します。この研究では、人工知能を使用して、AMPA受容体のGluA 2サブユニットを標的とする小分子を仮想的にスクリーニングしました。これにより、国際的な医薬品開発のギャップが埋められただけでなく、さらに重要なことに、MSの治療にまったく新しいアイデアがもたらされました。
用紙のアドレス:
https://www.science.org/doi/10.1126/sciadv.adj6187
さらに、NeuroImage に掲載された研究では、MS 患者の MRI スキャンで白質病変と 41 の神経解剖学的構造を同時にセグメント化する新しいオープンソース ツールも提案されました。この方法は、前述の生成モデル SAMSEG に基づいており、さまざまなスキャンおよびイメージング プロトコルに適応でき、病変を事前に分割せずに萎縮を評価できます。既存のツールのいくつかの制限を克服します。関連記事は「多発性硬化症における全脳と病変の同時セグメンテーションのためのコントラスト適応法」というタイトルで公開されました。
用紙のアドレス:
https://www.sciencedirect.com/science/article/pii/S1053811920309563?via%3Dihub
これらすべての科学的・技術的成果と最先端の発見は、MS 研究における人工知能の価値を明らかにしています。まだ道のりは長いですが、人々に希望を与えています。上記論文の第一著者であるフィリップ・ゲーブル博士が期待しているように、患者の症状を解決するための臨床試験を人工知能を使って実施することが、今後5~10年以内に現実になるかもしれない。








