Command Palette
Search for a command to run...
Natureサブマガジンに掲載されました!カリフォルニア大学は AI を使用して 3D クライオ電子顕微鏡による再構成に革命をもたらし、構造生物学における大きな進歩を達成しました

科学研究の分野では、2017 年にノーベル化学賞を受賞したクライオ電子顕微鏡 (Cryo-EM) もその画期的な開発により、特定のテクノロジーが時代の焦点となることがよくあります。たとえば、Shi Yigong 氏のチームは、極低温電子顕微鏡技術を利用して、2015 年に初めてスプライセオソームの高分解能構造を捕捉しました。これは、過去において基礎生命科学の分野における中国の世界科学への最大の貢献として賞賛されました。 30 年が経過し、電子顕微鏡におけるクライオ電子顕微鏡への関心が広く注目されるきっかけにもなりました。
構造生物学の分野における重要なツールであるクライオ電子顕微鏡は、サンプルを急速に低温に冷却してサンプル内の水分子の結晶化を防ぎ、サンプルの生理学的状態に近い状態を維持します。サンプルが凍結されると、研究者はさまざまなクライオ EM 技術を使用して、原子に近い解像度を含むさまざまな解像度でサンプルを 3D 視覚化し、サンプルをより深くより包括的に理解できるようになります。
しかし、クライオ EM 技術はより成熟してきましたが、サンプル調製中の配向の利点の問題は常に問題でした。一般に、3D 再構築プロセスでは、空間全体をカバーするためにあらゆる方向からタンパク質を投影する必要があります。ただし、気液界面 (AWI) に吸着されたタンパク質は配向の利点を示すことが多く、その結果、投影データ セットが不完全になり、その結果、タンパク質密度にさまざまな程度の歪みが生じ、再構成歪みが発生します。
最近、UCLA の研究チームは、単一粒子 IsoNet (spIsoNet) と呼ばれる自己教師あり深層学習手法を提案しました。このアプローチは、サンプルの等方性を復元する新しい方法を提供します。 spIsoNet を単一粒子クライオ EM に適用すると、生体高分子再構成の品質が大幅に向上し、アライメント精度と角度等方性が向上し、構造生物学の分野に新たなブレークスルーをもたらすことができます。
この研究は「自己教師あり深層学習によるクライオEMの優先配向問題の克服」と題され、国際学術誌Nature Methodsに掲載された。
研究のハイライト:
* この研究では、自己教師あり深層学習に基づくエンドツーエンド手法である spIsoNet を開発しました。これは、クライオ EM の画質を向上させるために使用できます。
* spIsoNet は、優先配向問題によって引き起こされる 3D 再構築問題を解決できます。
* spIsoNet は、3D 再構成中の角度等方性と粒子の位置合わせ精度を向上させます

用紙のアドレス:
https://doi.org/10.1038/s41592-024-02505-1
spIsoNet データ セット アドレス:
https://go.hyper.ai/P7XQu
オープンソース プロジェクト「awesome-ai4s」は、100 を超える AI4S 論文の解釈をまとめ、大規模なデータ セットとツールを提供します。
https://github.com/hyperai/awesome-ai4s
データセット: それぞれが異なる特性とアプリケーション シナリオを持つ複数のデータ セットを選択します。
この研究では、研究者らは複数のデータ セットを使用して spIsoNet のパフォーマンスをテストしました。それぞれに独自の特性とアプリケーション シナリオがあります。
* β-ガラクトシダーゼ データセット:これには、特定の向きを持つ 2 つのサブセット、つまり 1,513 個の側面視粒子と 950 個の上面視粒子が含まれており、これらのサブセットは、spIsoNet が優先方向の影響を受ける画質 (マップ品質) を向上できるかどうかを検証するために使用されます。
* HA トリマー傾斜データ セット (EMPIAR-10097):これは、傾斜した表示方向を提供するグリッド傾斜戦略を通じて取得され、傾斜したサンプルを処理する spIsoNet の能力を評価するために使用できます。
* スキューのない HA トリマー データ セット (EMPIAR-10096):グリッドなしの傾斜条件下で収集され、130,000 個の粒子をインポートし、位置ずれ補正を実行することにより、解像度 3.45 Å の最終画像が得られ、傾斜サンプルと傾斜サンプルの処理効果の違いを比較するために使用できます。
* 非対称リボソーム データセット (EMPIAR-10406):これには、アミカシンと複合体を形成した A. baumannii 病原体の 70S リボソームが含まれており、複雑な生体分子構造の処理における spIsoNet のパフォーマンスを評価するために使用できます。
* HIV VLP 断層撮影データセット (EMPIAR-10164):これには、分解能 3.6 Å の未熟な HIV-1 dMACANT ウイルス様粒子 (VLP) が含まれています。今回の研究では、ウイルス粒子の構造についての洞察が得られました。
spIsoNet: U-net 深層学習モデルに基づいており、2 つのモジュールで構成されています
spIsoNet で使用されるニューラル ネットワークは、U-net ネットワーク アーキテクチャに基づいています。これは、生物医学画像の復元とセグメンテーションで広く認識されている深層学習モデルです。以下の図 b に示すように、U-net は、畳み込みブロックを積み重ねることにより、エンコーダー/デコーダー アーキテクチャに基づいて構築されます。
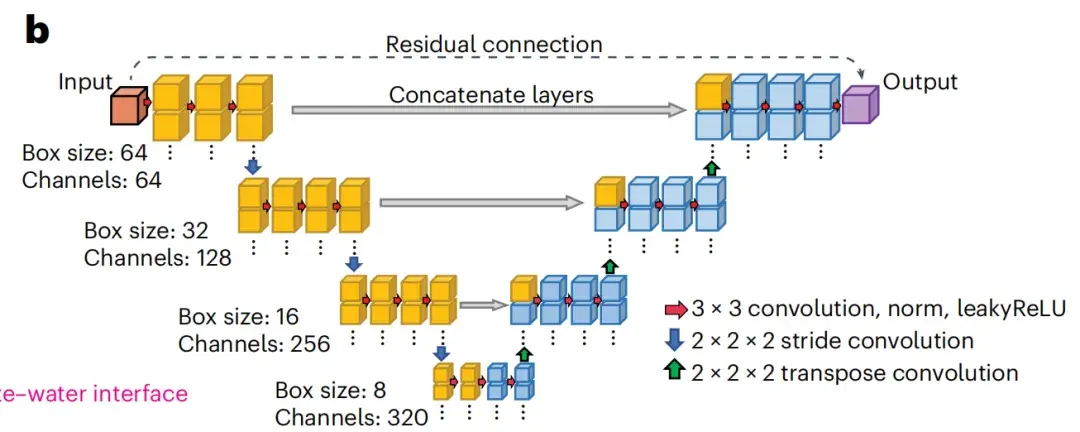
U-net モデルに基づいて、spIsoNet は主に 2 つのモジュールで構成されます。
異方性補正モジュール
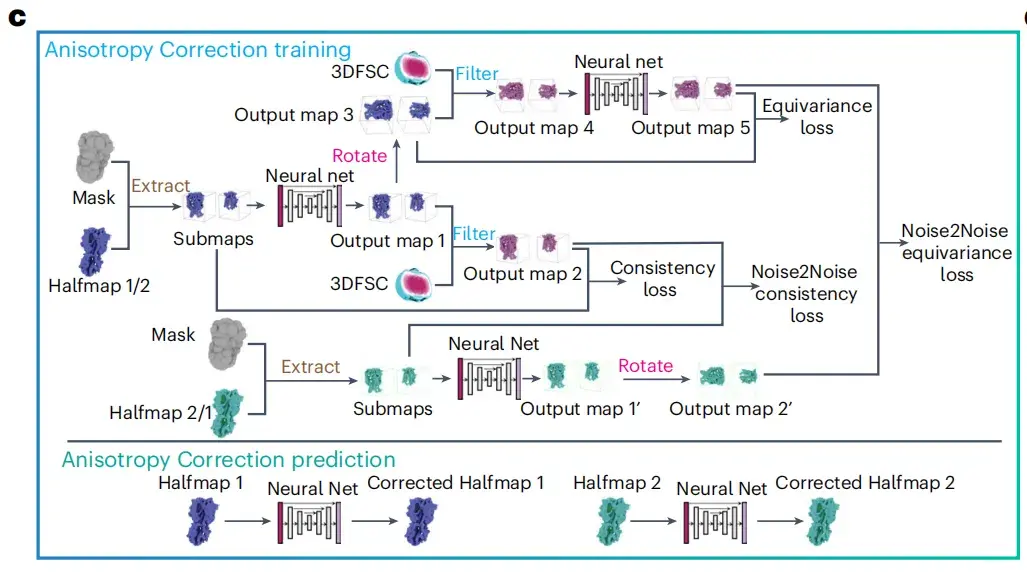
研究者らは、クライオ EM 画像の鮮明さを向上させるために異方性補正モジュールを設計しました。以下の図 c に示すように、このモジュールの操作は 2 つのハーフマップ、3 次元フーリエ シェル相関 (3DFSC) ボリューム、および溶媒マスクを入力データとして受け取ります。3DFSC アルゴリズムを統合することにより、4 つの異なる種類の損失関数の加重合計が得られます。 、一貫性損失、等分散性損失、Noise2Noise 一貫性損失、および Noise2Noise を含む等分散損失)により、クライオ EM 画像の品質が向上します。
異方性補正を活用したミスアライメント補正モジュール
以下の図 e に示すように、このモジュールは、画像フィルタリング (マップ フィルタリング)、異方性補正 (異方性補正)、および RELION 自動リファイン (RELION 自動リファイン) の 3 つの主要なステップを含むワークフローを統合します。異方性補正を通じてクライオ EM 画像の品質を向上させることを目的としています。
*異方性補正とは、特定のアルゴリズムを通じてオブジェクトのさまざまな方向の物理的および化学的特性の違いを補正し、等方性効果を実現することを指します。
* 位置ずれ補正技術は、主に画像処理中に幾何学的な歪みによって引き起こされる画像の位置ずれの問題を補正するために使用されます。
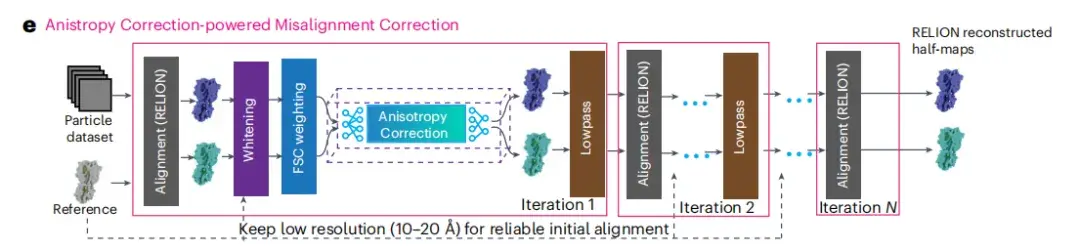
異方性補正が完了した後、研究者らはより正確な粒子配向パラメータと、RELION によって再構成された 2 つの半画像を取得しました。 3D リファインメントを反復するたびに、これらのハーフイメージは、画質をさらに向上させるために、ホワイトニングや FSC 重み付けなどの後処理フィルターによって処理されます。次に、spIsoNet 異方性補正モジュールは、これらのフィルタリングされたハーフ画像を処理し、処理された補正されたハーフ画像は、解像度に一致する規格を満たすようにローパス フィルタリング (Lowpass) されます。これら 2 つのフィルタリングおよび修正されたハーフ画像は、後続の方向推定の基準として使用されます。
研究結果: spIsoNet はクライオ EM の画質を大幅に向上させます
異方性補正が効く
研究者らは、spIsoNet の異方性補正モジュールが、シミュレートされたデータ内の欠落した情報を効果的に回復できることを発見しました。したがって、この研究では、まず、β-ガラクトシダーゼを含む RELION チュートリアル データセットで spIsoNet をテストしました。
以下の図 jm に示すように、2D クラス平均から側面図粒子と上面図粒子を選択し、研究者らは優先配向を持つ粒子の 2 つのサブセットをコンパイルし、標準的な RELION 3D 再構成を実行しました。テスト結果は、異方性補正モジュールだけで、上面図が支配的な方向または側面図が支配的な方向によって引き起こされる 3D 再構成アーティファクトを効果的に低減できることを示しています。
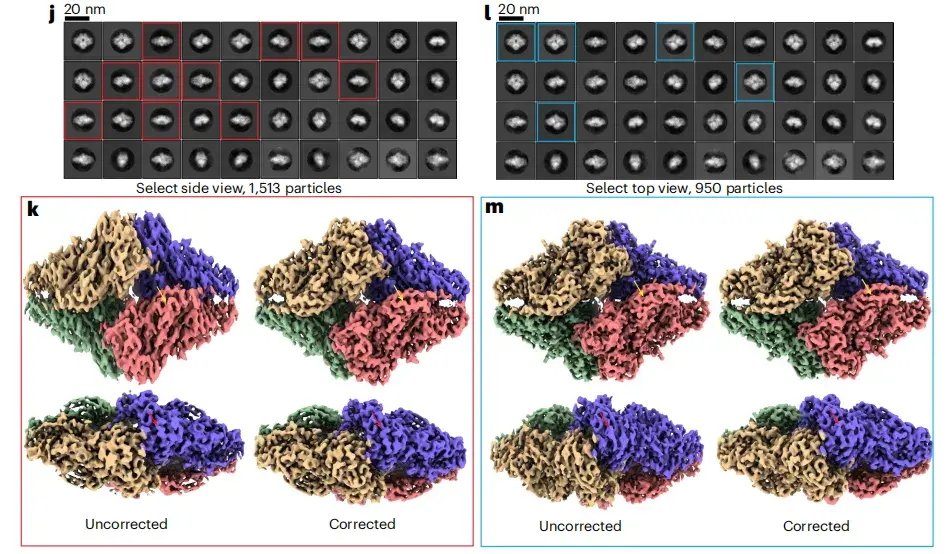
※このうち、jlは異なる角度から再構成した2D分類図、kmは異なる角度から再構成した3D分類図を指します。
異方性補正技術と位置ずれ補正技術の両方により、クライオ EM の画質が大幅に向上します
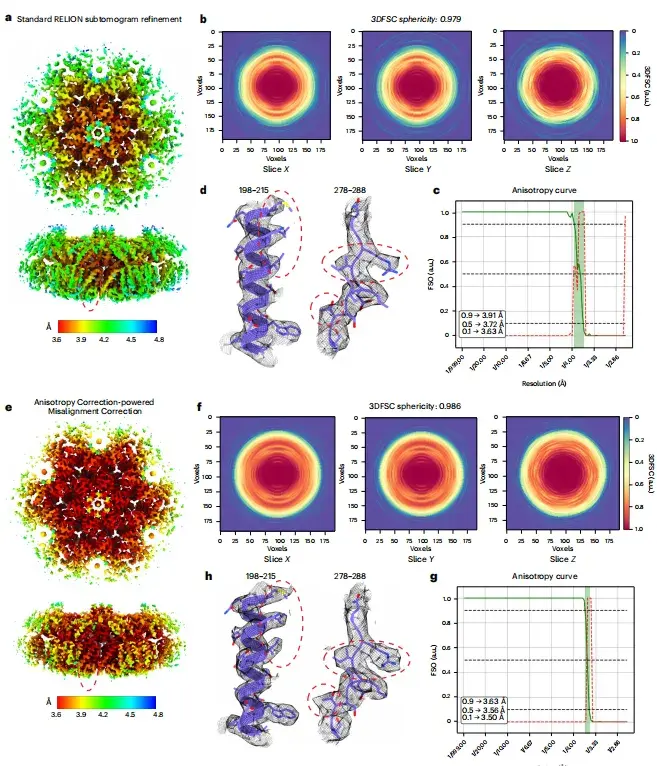
これまでの研究では、HA トリマー傾斜データセットのクライオ EM 画質が理想的ではないことが示されています。 spIsoNet の効果をテストするには、この研究では、まずハーフマップに対して異方性補正を実行しました。結果は、修正された画質が大幅に向上し、局所解像度が向上し、ノイズが減少したことを示しています。下の図 ab に示すように、補正された画像では、元の画像では識別が困難であった側鎖の密度がはっきりと見えるようになります。
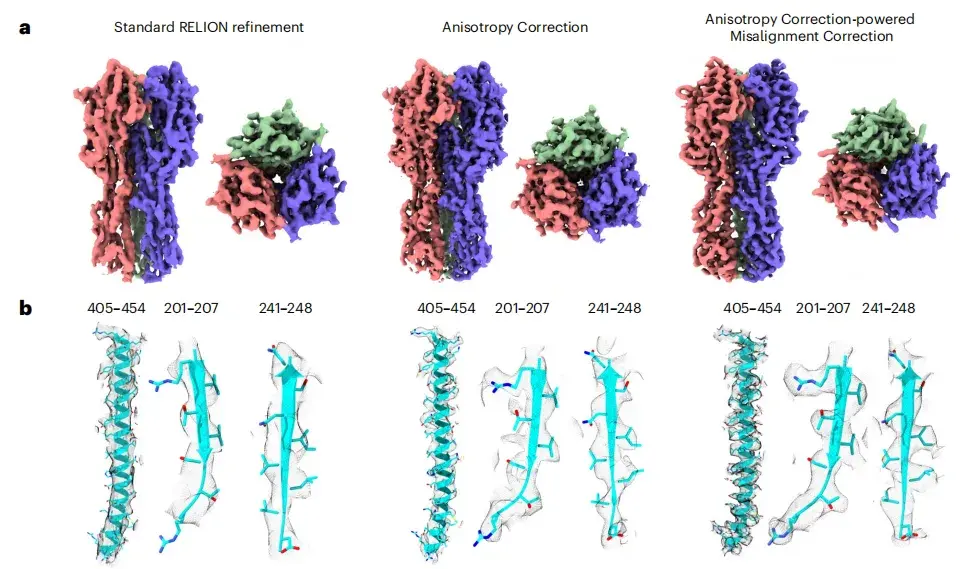
※左から右へ、RELION標準リファインメント、異方性補正、異方性補正による位置ずれ補正です。
さらに、以下の図 cf に示すように、位置ずれを補正した画像では、元の画像と比較して、画像からモデルへのフーリエ シェル相関 (3DFSC) が球面 (0.991) に近くなります。 、補正後の等方性フーリエ シェル占有領域 (FSO) も大きくなっています。
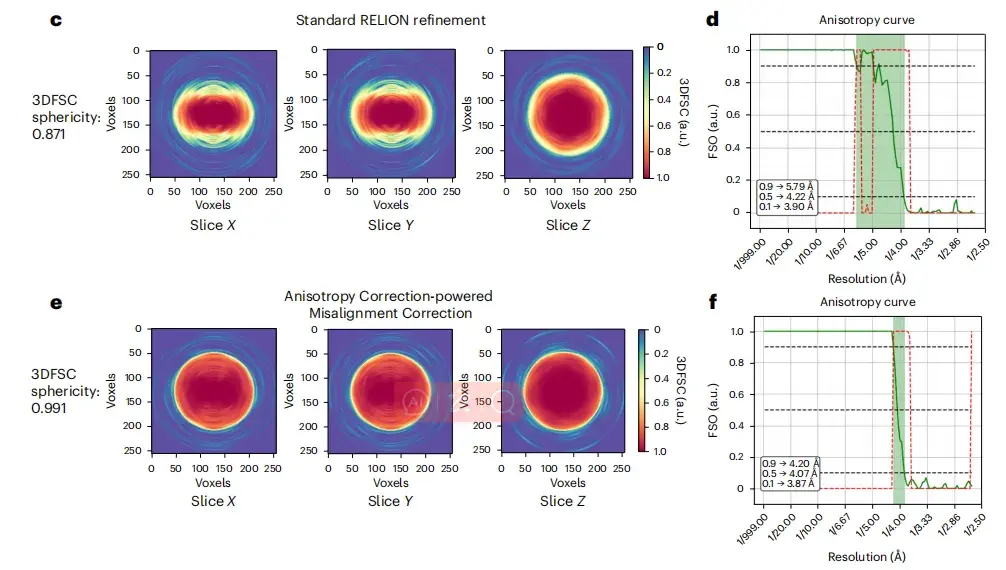
※このうち、ceはRELIONリファインメントとspIsoNetミスアライメント補正にそれぞれ使用した3DFSCスライス、dfはそれぞれRELIONリファインメントとspIsoNetミスアライメント補正の結果から算出したFSOとビンガムテストのP値です。
位置ずれの修正により、誤って割り当てられた多くの方向が正常に特定され、修正されました
深刻な選好指向問題を伴うタンパク質データセット - 歪みのない HA 三量体データセット (EMPIAR-10096)、この研究では、spIsoNet の異方性補正によるミスアライメント補正モジュールを利用して、粒子データ セットを処理しました。そして、傾斜データセット内の再構成された HA トリマー画像が参照モデルとして使用されました。
位置ずれ補正後、以下の図 bf に示すように、研究者は正しい形状の画像を取得し、等方性の大幅な改善を達成しました。以下の図 h に示すように、ハーフマップ FSC (3.5 Å) とモデルからマップへの FSC (3.6 Å) によって決定された画像解像度は一貫しています。
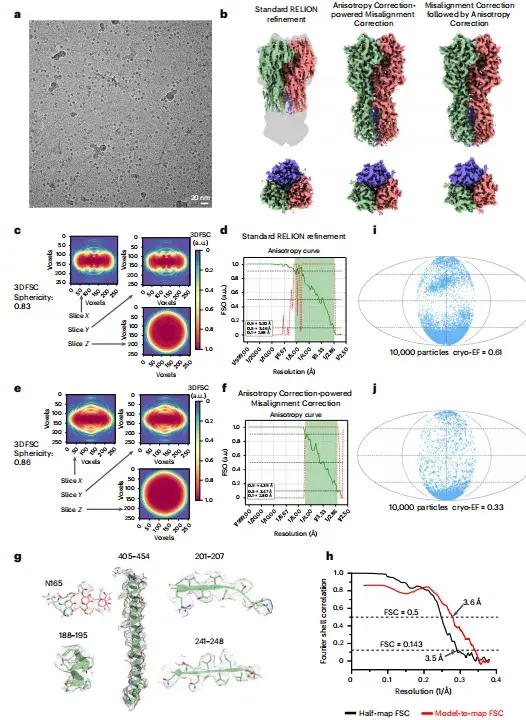
*a- 代表的なクライオ EM 顕微鏡写真、b- さまざまな方法で再構成された HA トリマーのクライオ EM 画像、c- 標準 RELION 精製に使用された 3DFSC のセクション、d- FSO および標準 RELION 精製結果に基づいて計算された FSO。ビンガム テスト、e-spIsoNet のミスアライメント補正された 3DFSC スライス、spIsoNet のミスアライメント補正結果とビンガム テストの P 値に基づいて計算された f-FSO値、g - クライオ EM 画像から選択されたアミノ酸残基とグリカンの代表的な密度、h - 補正された HA トリマー FSC 曲線、i、j - さまざまな方向の分布結果と対応するクライオ EF スコア
spIsoNet は、非対称粒子および核酸分子を含む粒子の整列の改善に優れています。
以下の図 a~d に示すように、異方性補正後は画質が大幅に改善され、より連続的な濃度分布、より高い局所解像度、およびより少ないノイズ干渉が示されています。研究の結果、70S または 80S リボソームのサブトモグラム平均を基準として使用し、アライメントに 15 Å の初期解像度を維持すると、モデルの偏りのない高品質の画像が一貫して得られ、異方性の影響が効果的に軽減されます。
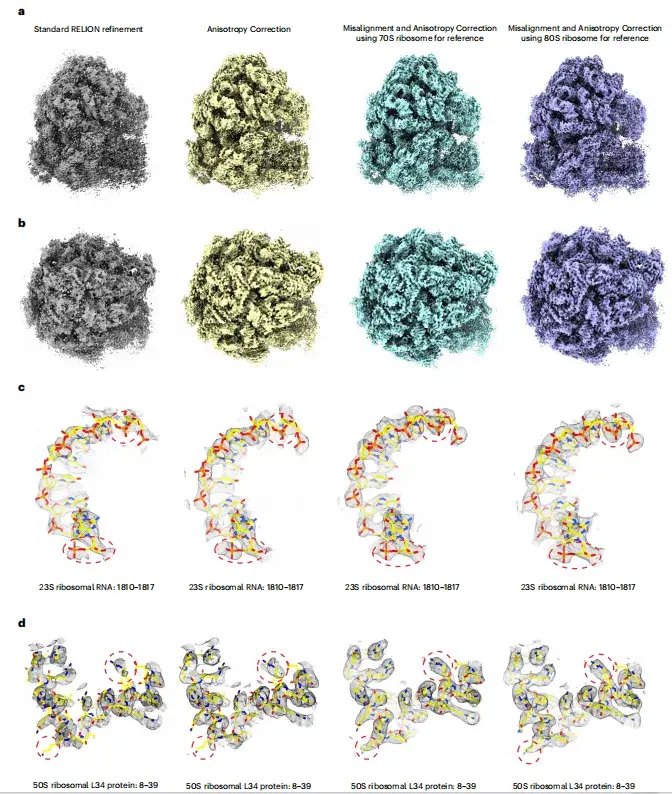
*さまざまな再構成方法で再構成された a,b-リボソーム マップ、c,d-適合した原子モデルを含む代表的な密度領域 (黄色)
spIsoNet にはその場構造生物学への応用の可能性がある
サブトモグラム平均化における spIsoNet のアプリケーションを評価するために、この研究では HIV-1 VLP 断層撮影データ セット (EMPIAR-10164) を例として取り上げます。
下の図 a に示すように、この研究では、RELION4 の標準プロセスで、異なる傾斜角を持つ 5 つのサブセットを使用して、3.7 Å 分解能の構造を取得しました。次に、位置ずれ補正を実行することにより、研究者は、以下の図 e に示すような等方性 3.6 Å 分解能構造を得ることができます。
以下の図 bh に示すように、構造解析により、側鎖密度がより明確になり、FSO 曲線でより高い 3DFSC 球形度が示され、粒子配向推定の精度の向上に役立ちます。
* a-標準 RELION から再構築された HIV-1 局所解像度マップ、b-標準 RELION 精製に使用された 3DFSC のスライス、標準 RELION 精製結果から計算された FSO およびビンガム テストの c-P 値、d-選択されたアミノ酸残基の代表密度からクライオ EM 画像内の糖鎖、spIsoNet 異方性補正技術 f-spIsoNet から再構築された e-HIV-1 局所解像度マップ異方性補正された 3DFSC のスライス、g - spIsoNet 異方性補正結果から計算された FSO およびビンガム テストの P 値、h - クライオ EM 画像から選択されたアミノ酸残基およびグリカンの代表密度
AI+クライオ電子顕微鏡、「強固な連携」の技術例
過去 2 年間、科学界で激しく議論されてきたテーマは、「AlphaFold は構造生物学を終わらせたのか?」というものでした。答えはもちろんノーです。
一方では、AlphaFold などの構造予測モデルのトレーニング データは、X 線顕微鏡や極低温電子顕微鏡などの従来の構造解析手法から得られます。一方で、Cryo-EM テクノロジーは、AlphaFold が現在達成できないタンパク質の動態の解析に優れています。では、AlphaFoldに代表されるAI技術は、クライオ電子顕微鏡に代表される従来の手法を支援できるのでしょうか?これは必需品と言えるでしょう。
たとえば、早ければ 2022 年には、北京大学の毛友東教授のチームはかつて AI とクライオ電子顕微鏡を使用して、誘導されたプロテアソームの基質分解の中間状態から基質阻害の中間状態への一時的な遷移をうまく捕捉しました。研究チームは、人工知能による四次元再構成技術を応用し、時間分解クライオ電子顕微鏡の解析精度を向上させることで、主要なタンパク質に関連する標的タンパク質複合体の原子レベルの機能動態観察を世界で初めて達成した。関連する結果は、「時間分解クライオ EM によるヒト プロテアソームの USP14 制御アロステリー」というタイトルで Nature に掲載されました。
論文リンク:
https://doi.org/10.1038/s41586-022-04671-8
少し前のことですが、ByteDance Research チームの研究者は、CryoSTAR と呼ばれる新しい方法を提案しました。これは、極低温電子顕微鏡実験データにタンパク質の原子構造モード事前分布を適用する最初の方法であり、原子モデル情報を構造規則化として使用して、生体高分子の立体構造の不均一性を明らかにし、粗視化モデルと密度マップを出力できます。さまざまなレベルでの分子の構造変化は、動的構造解析におけるクライオ EM の応用可能性を大幅に高めます。関連する結果は、「CryoSTAR: Leveraging Structural Prior and Constraints for Cryo-EM Heterogeneous Reconstruction」というタイトルで Nature Methods に掲載されました。
論文リンク:
https://www.nature.com/articles/s41592-024-02486-1
AI とクライオ EM の組み合わせが構造生物学に新たな章を開くことは疑いの余地がなく、また、従来の構造生物学手法を支援する AI テクノロジーの大きな可能性も実証しています。








