Command Palette
Search for a command to run...
يمكن أن يمنع انتشار الخلايا السرطانية! قامت كلية الصيدلة Huihu وجامعة تيانجين الطبية بتطوير بروتين جديد مثبط للورم dp53m

ربما كثير من الناس لا يعرفون،في الواقع، كل واحد منا لديه خلايا سرطانية في جسمه.يخضع جسم الإنسان إلى عملية إنشاء واستبدال مليارات أو حتى عشرات المليارات من الخلايا كل يوم. خلال هذه العملية الأيضية، من الطبيعي أن تحدث أخطاء في عملية تكرار الحمض النووي، مثل الطفرات الجينية التي تحول الخلايا الطبيعية إلى خلايا سرطانية في الموقع. لكن،هناك بعض البروتينات التي تعمل على قمع الورم في جسم الإنسان.مثل البروتين p53، يمكن لهذه البروتينات الحد من حدوث السرطان عن طريق تنظيم دورة الخلية وتحفيز موت الخلايا السرطانية أو شيخوخة الخلايا. وهذا أيضًا سبب مهم يجعل معظمنا قادرًا على "التعايش بسلام" مع الخلايا السرطانية.
يتم ترميز بروتين قمع الورم p53، المعروف باسم "حارس الجينوم"، بواسطة الجين TP53 ويلعب دورًا مهمًا في منع حدوث السرطان.ومع ذلك، يمكن أن يتعرض TP53 لطفرة غير مقصودة في العديد من النقاط الساخنة المحددة الشائعة، مثل R175، وG245، وR248، وR273، وR282، مما يؤدي إلى طفرات p53 ويؤدي إلى فقدان وظيفة بروتين قمع الورم الطبيعي. بالإضافة إلى ذلك، بسبب التأثير السلبي السائد لبعض الطفرات p53، لن يفقد الطفر p53 وظيفته الأصلية في قمع الورم فحسب، بل سيتداخل أيضًا مع نشاط قمع الورم في النوع البري الطبيعي p53 (p53-WT)، وبالتالي زيادة خطر حدوث الورم.
بالمقارنة مع العديد من الطفرات الأخرى لـ p53،يمتلك بروتين p53-R175H المتحور قدرة أكبر على التسبب في الأورام، والنقائل، ومقاومة الأدوية.إن تطوير الأدوية التي تستهدف p53-R175H والسماح للأدوية المستهدفة بتحديد p53-R175H وتحلله بدقة هي استراتيجية فعالة لمنع حدوث السرطان. ومع ذلك، نظرًا لأن معظم بروتينات p53 الطافرة تفتقر إلى مواقع نشطة للأدوية الجزيئية الصغيرة، يصبح من الصعب للغاية تصميم أدوية مستهدفة يمكنها التعرف بدقة على بروتينات p53 الطافرة والتأثير عليها.
في هذا الصدد،البروفيسور وو سيجين من كلية هويهو للصيدلة في جامعة شيآن جياوتونغ-ليفربول، إلى جانب البروفيسور شي سونغبو والبروفيسور تشونج ديانشينغ من مستشفى جامعة تيانجين الطبية العام،نُشرت ورقة بحثية بعنوان "PROTAC مُصمم هندسيًا يعتمد على أبتامر الحمض النووي لعلاج دقيق لسرطان النقطة الساخنة p53-R175H" في Elsevier.
طورت هذه الدراسة مُحللًا انتقائيًا لـ p53-R175H، dp53m.يمكن لهذا المُحطِّم التعرف بشكل خاص على بروتين p53-R175H المتحور واستخدام نظام تحلل البروتين الطبيعي في الخلية - نظام بروتياز اليوبيكويتين لتحقيق تحلل مستهدف للبروتين المستهدف ومنع التعبير الوظيفي لبروتين p53 المتحور.
يتميز هذا المنتج بفعالية كبيرة في مكافحة الأورام ولا يسبب أي تفاعلات سامة واضحة. بالإضافة إلى ذلك، يمكن لـ dp53m أيضًا العمل بشكل تآزري مع عقار العلاج الكيميائي سيسبلاتين لتعزيز حساسية الخلايا السرطانية للسيسبلاتين، وهو أمر بالغ الأهمية لعلاج السرطان.
أبرز الأبحاث:
- قام الباحثون بتعديل القواعد غير الأساسية تحت إشراف محاكاة الديناميكية الجزيئية ووجهوا أبتامر الحمض النووي الريبي إلى أبتامر الحمض النووي (p53m-DA) عن طريق طريقة ما بعد SELEX الموجهة بالالتحام الجزيئي التكراري.
- باعتباره أحد مكونات dp53m، يمكن لـ p53m-DA التعرف بشكل خاص على بروتين p53-R175H. يشارك CRBN في تحلل البروتين، لذلك يمكن لـ dp53m التعرف بشكل خاص على بروتين p53-R175H وتحلله.

عنوان الورقة:
https://pubmed.ncbi.nlm.nih.gov/38811338
يجمع مشروع المصدر المفتوح "awesome-ai4s" أكثر من 100 تفسير لورقة AI4S ويوفر أيضًا مجموعات بيانات وأدوات ضخمة:
https://github.com/hyperai/awesome-ai4s
هندسة ما بعد SELEX: بناء أبتامر DNA عالي الأداء يتعرف بشكل خاص على الطفرة p53-R175H
وفي دراسة أجريت على البروتين p53، وجد الباحثون أن طفرة R175H تؤثر على وظيفة ربط الحمض النووي عن طريق تغيير الحالة البنيوية للبروتين p53. إن الجمع بين العديد من الجزيئات المثبطة الصغيرة والأبتامرات يمكن أن يستعيد جزئيًا نشاط p53-R175H، ولكن لم يتم الإبلاغ عن الآلية الجزيئية لتأثيرها.
استخدمت هذه الدراسة في البداية أساليب المحاكاة الجزيئية لاستكشاف الآلية الجزيئية الجوهرية للأبتامرات في استعادة وظيفة p53-R175H.بالمقارنة مع p53-WT الطبيعي، في الطفرة p53-R175H، تكون المسافة بين L3 وC-helix أقرب، والمسافة بين L2 وL3 أكبر. قد تكون التغييرات البنيوية في هذه المواضع هي السبب الرئيسي وراء فقدان الطفرة p53-R175H لوظيفتها النموذجية، كما توفر أيضًا أساسًا بنيويًا للتعرف المحدد على أبتامراتها وجزيئات PROTAC ذات الصلة.
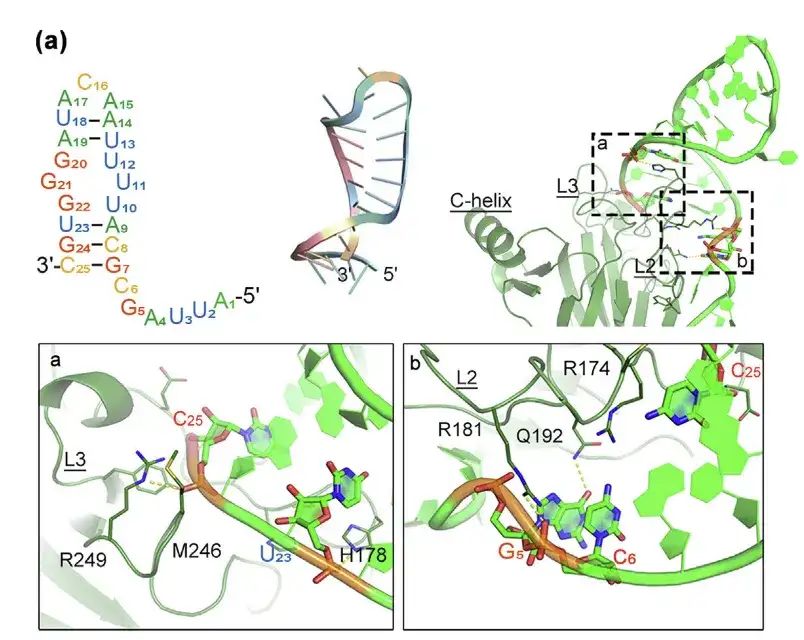
- التنبؤ ببنية البروتين p53m-RA وتفاعله مع البروتين p53-R175H باستخدام النمذجة الجزيئية
- تظهر واجهة الترابط في المنطقتين أ و ب.
في الدراسات السابقة، أظهرت الدراسات أن أبتامر الحمض النووي الريبي المستهدف لـ p53-R175H (p53m-RA) يتمتع بتقارب كبير لـ p53-R175H، ومع ذلك، فهو غير مستقر للغاية في المصل، مما يحد من تطبيقه العملي.
مراجع:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9884801
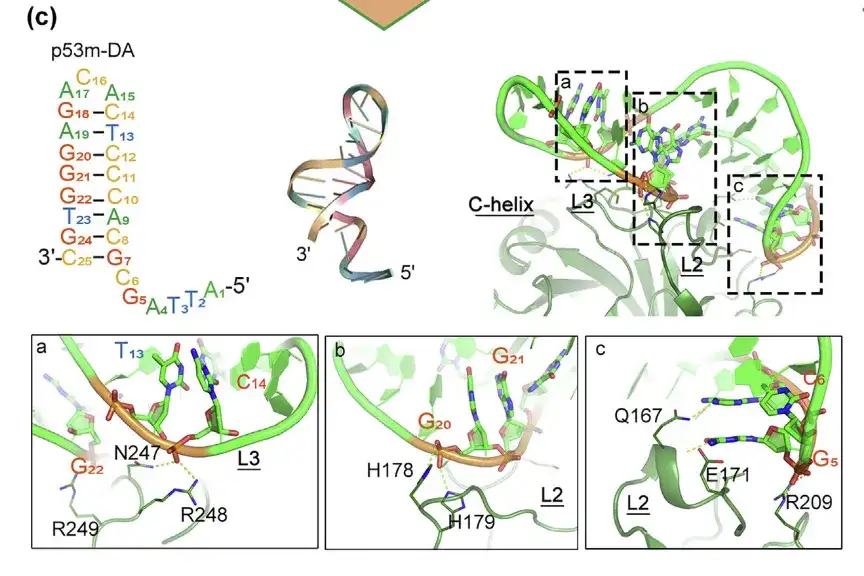
p53m-DA المُحسَّن بعد SELEX وتفاعله مع p53-R175H
توجد واجهة الترابط في المناطق أ، ب، ج
لتعزيز الاستقرار البنيوي وتقارب الأبتامر، قام الباحثون بتعديل القواعد غير الأساسية تحت إشراف محاكاة الديناميكية الجزيئية وقاموا بتصميم أبتامر الحمض النووي الريبي إلى أبتامر الحمض النووي الريبي (p53m-DA) من خلال ما بعد SELEX.
تم توفير القوة الحسابية للمحاكاة الجزيئية في هذه الدراسة من خلال أوبن بايز إمداد
وأظهرت النتائج أن بنية المنطقة المقترنة من p53m-DA كانت عبارة عن أخدود رئيسي، وكانت منطقة الحلقة غير المقترنة عبارة عن أخدود ثانوي. يلعب الأخدود الرئيسي دورًا رئيسيًا في الارتباط مع H178 وH179 وE171 وQ167 في L2، ويلعب الأخدود الثانوي دورًا رئيسيًا في التفاعل مع N247 وR248 وR249 في L3.بالإضافة إلى ذلك، حافظ p53m-DA بشكل مستمر على تكوين حلزوني مزدوج السلسلة طوال عملية المحاكاة، مما يشير إلى استقرار بنيته.
L2 و L3 هي مناطق موجودة في البروتين المتحور
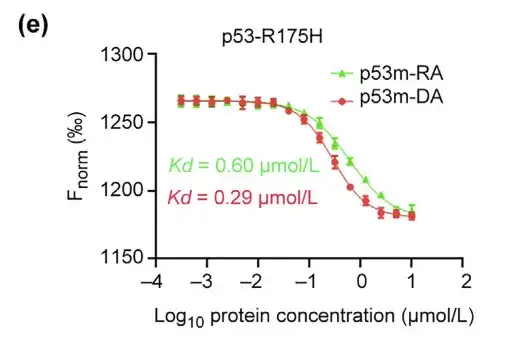
كما قام الباحثون بتقييم تقارب وانتقائية p53m-DA لـ p53-R175H. أظهر اختبار MST أن معامل Kd لـ p53m-DA كان 0.29 lmol/L، وهو أقل بنحو مرتين من معامل Kd لـ p53m-RA.
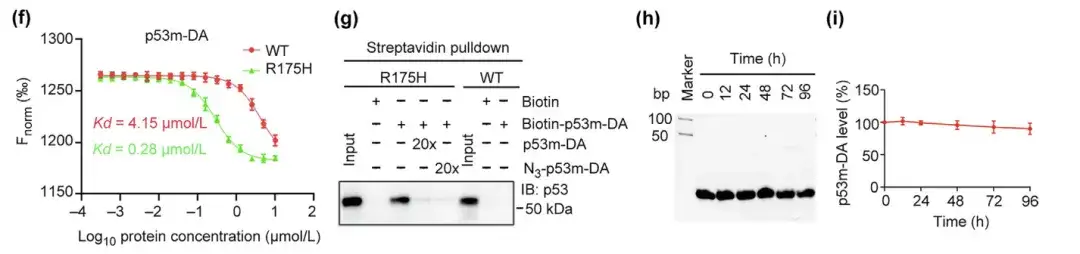
(و) تقارب p53m-DA لـ p53-WT و p53-R175H
(ز) الارتباط النوعي لـ p53m-DA مع p53-R175H عن طريق اختبار سحب الستربتافيدين
(ح، ط) تقييم استقرار p53m-DA في المصل وتحديد الكمية المتبقية من p53m-DA
علاوة على ذلك، كانت تقارب p53m-DA للطفرة p53-R175H أعلى بنحو 14 ضعفًا من تقاربها للطفرة p53-WT الطبيعية. في اختبار سحب الستربتافيدين، ارتبط p53m-DA بشكل خاص بـ p53-R175H ولكنه لم يتفاعل مع p53-WT، مما يشير إلى خصوصية p53m-DA لـ p53-R175H. ومن الجدير بالذكر أن استقرار مصل p53m-DA قد تحسن بشكل كبير، مع الحد الأدنى من التدهور بعد 96 ساعة.
في ملخص،p53m-DA هو أبتامر ذو خصوصية واستقرار عاليين.
dp53m: مُحلل p53-R175H محدد
التجربة 1: تخليق DP53M
يقع الطرف 5' من الأبتامر p53m-DA خارج موقع ارتباطه مع p53-R175H. استخدم الباحثون تفاعل النقر لربط الثاليدوميد الألكيني (ربيط لإنزيم CRBN E3) بالطرف 5' من N3-p53m-DA. كان البروتين الناتج عن الكيميرا المستهدفة لتحلل البروتين PROTAC (المسمى dp53m) قادرًا على الارتباط بشكل انتقائي بـ p53-R175H. يظهر هيكل dp53m في الشكل أدناه:
*PROTAC: يتكون من ربيطة E3 ربيطة، وربيطة تستهدف POI، ورابط كيميائي بين الربيطة
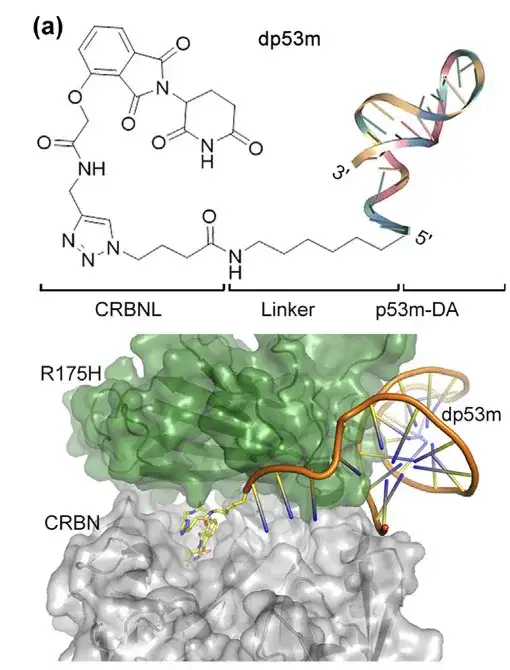
(أ) تم محاكاة بنية dp53m باستخدام الالتحام البروتيني-البروتيني وحسابات الديناميكيات الجزيئية.
أسفل: واجهة الارتباط مع p53-R175H وCRBN
التجربة 2: يمكن لـ dp53m التعرف على الطفرة p53-R175H وتحليلها بشكل خاص
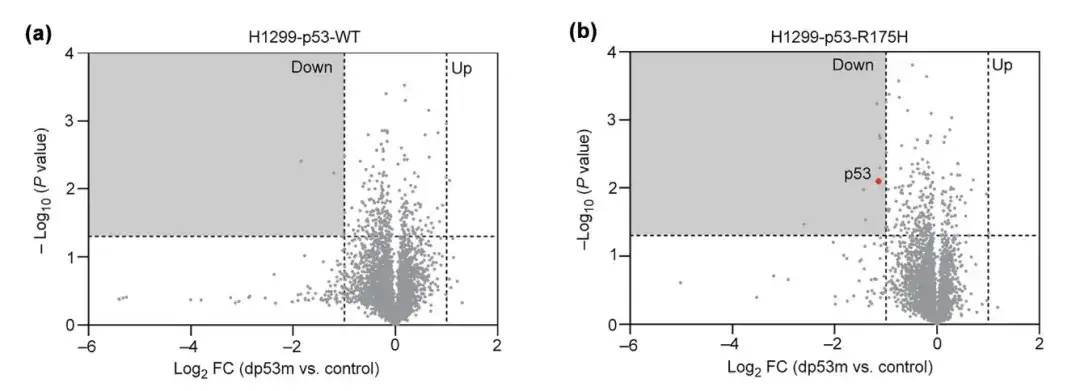
للتحقق من خصوصية الخلايا لـ dp53m بالنسبة لـ p53-R175H، تم علاج p53-R175H وp53-WT المفرط التعبير عنها في خلايا H1299 باستخدام PBS أو dp53m لمدة 16 ساعة وتم مراقبة مستويات التغير البروتيني لديهم. أظهرت النتائج أن dp53m أدى إلى تدهور p53-R175H بشكل ملحوظ ولكن ليس p53-WT.
*PBS هو محلول ملحي منظم بالفوسفات، يستخدم كمجموعة تحكم
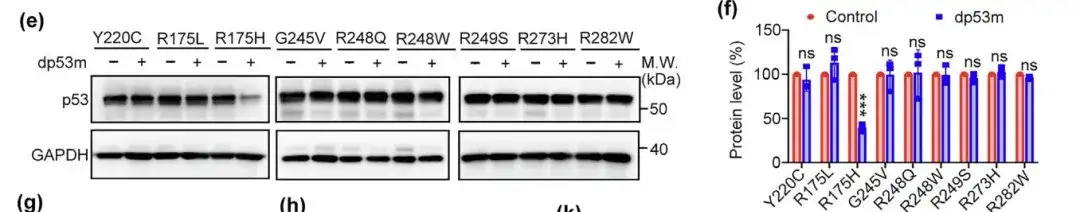
بالإضافة إلى ذلك، قام الباحثون أيضًا بتقييم إمكانية تحلل dp53m ضد الطفرات الساخنة الأخرى مثل Y220C وR175L وG245V وR248Q وR248W وR249S وR273H وR282W. وأظهرت النتائج أن dp53m فقط قام بتحلل p53-R175H بشكل فعال.وقد تم إثبات قدرتها على تحلل p53-R175H.
بالمقارنة مع p53WT، أدى علاج dp53m إلى زيادة تعدد يوبيكويتين p53-R175H. أظهرت الدراسات أن تحلل dp53m يمكن منعه بواسطة مثبط البروتياز MG132 أو ربيطة CRBN أو siRNA المستهدفة لـ CRBN.من المفترض أن تحلل p53-R175H الناجم عن dp53m يحدث من خلال آلية اليوبيكويتين-البروتوزوم.
في ملخص،dp53m هو مُحلل p53-R175H محدد، وتحدث عملية تحلله من خلال آلية اليوبيكويتين-البروتوزوم.
dp53m يمنع تكاثر الخلايا السرطانية وهجرتها ونمو الورم
التجربة 1: dp53m يثبط تكاثر الخلايا السرطانية وهجرتها التي يسببها p53-R175H
قام الباحثون بمعالجة خلايا H1299-p53-WT، وH1299-p53-R175H، وA549، وDetroit 562، وSKBR3 باستخدام PBS، وp53m-DA، أو dp53 m، على التوالي، وأجروا اختبارات قابلية البقاء عليها، ولاحظوا تكوين المستعمرات في الخلايا.
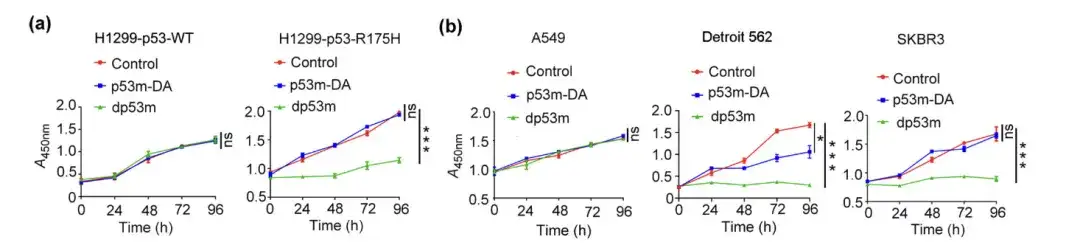
اختبار قابلية بقاء خلايا H1299-p53-WT، وH1299-p53-R175H، وA549، وDetroit 562، وSKBR3 المعالجة بـ PBS، أو p53m-DA، أو dp53m
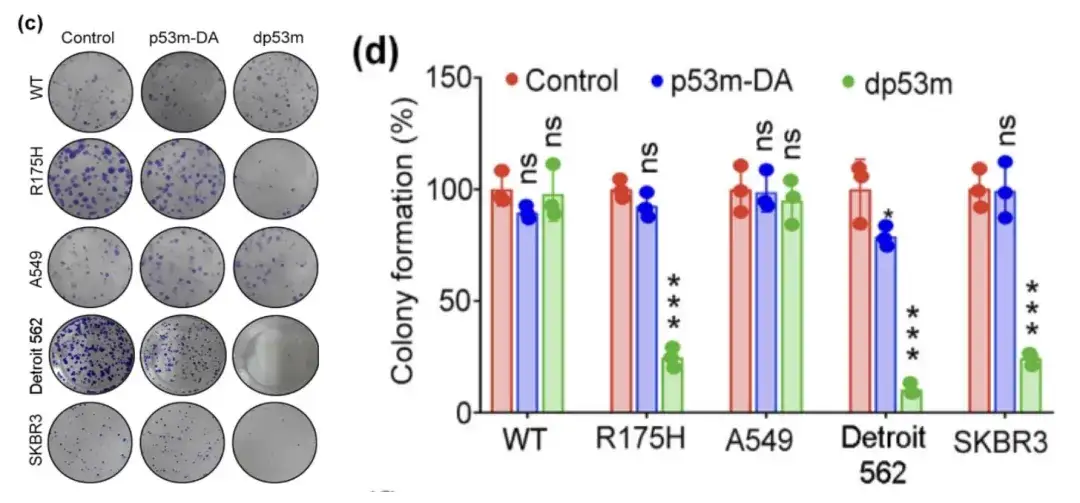
* dp53m يثبط تكوين المستعمرات في خلايا H1299-p53-R175H وDetroit 562 وSKBR3
* لم يتم ملاحظة أي تأثير كبير في خلايا H1299-p53-WT و A549
يوضح الشكل أعلاه أن dp53m يظهر تأثيرًا مثبطًا للانتشار بشكل كبير في الخلايا السرطانية التي تعبر عن p53-R175H (H1299-p53-R175H، Detroit 562، وSKBR3)، في حين أن الخلايا التي تعبر عن p53-WT لا تتأثر بشكل أساسي.ويشير هذا إلى أن dp53m يتمتع بإمكانات علاجية كبيرة في الخلايا السرطانية التي تحمل طفرة p53-R175H.
التجربة 2: dp53m يثبط نمو الأورام المستحثة بواسطة p53-R175H في الجسم الحي
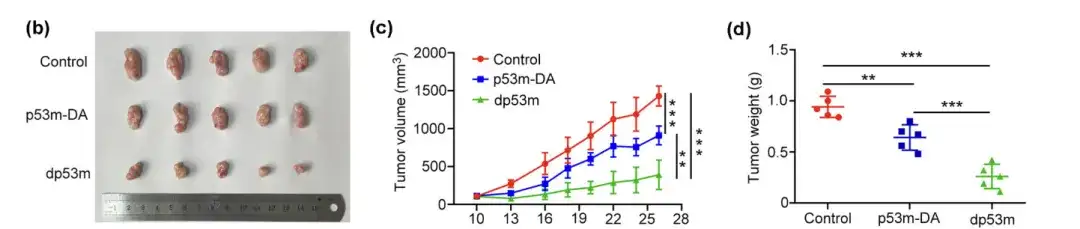
(ب) المظهر العياني للأورام المعزولة بعد العلاج
(ج) حجم الورم المقاس في الوقت المشار إليه
(د) تحديد الوزن النهائي للورم
قام الباحثون بتوزيع الفئران الحاملة للورم بشكل عشوائي على ثلاث مجموعات وأعطوها p53m-DA أو dp53m أو محلول ملحي كعنصر تحكم عن طريق الوريد. بالمقارنة مع مجموعة التحكم أو p53m-DA،لقد ثبت أن dp53m يثبط نمو الورم بشكل ملحوظ.
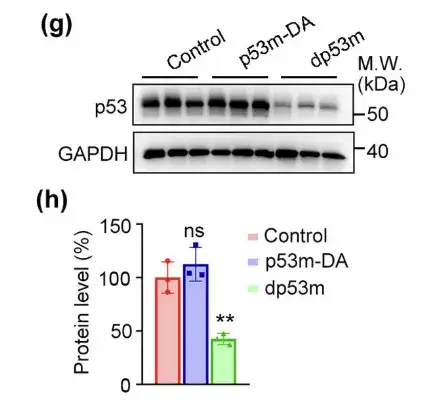
كما هو متوقع،نجح dp53m بشكل فعال في تقليل مستوى التعبير عن p53-R175H في الأورام.
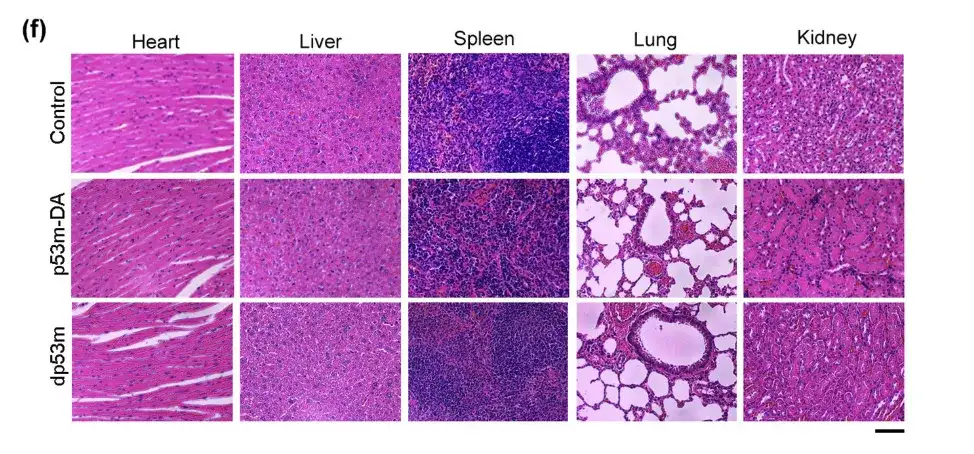
وفي الشكل العلوي لم تظهر أي فروق ذات دلالة إحصائية في أنسجة القلب والكبد والرئة والطحال والكلى بين المجموعات الثلاث من الفئران.ويشير هذا إلى عدم وجود سمية من dp53m في الجسم الحي.
في ملخص،يمكن لـ dp53m أن يثبط نمو الأورام الناجمة عن p53-R175H دون سمية واضحة.
وبالإضافة إلى ذلك، ونظراً لأن الطفرة p53-R175H مرتبطة بمقاومة الأدوية العلاجية الكيميائية مثل السيسبلاتين، قام الباحثون أيضاً بتحليل تأثير dp53m على النشاط المضاد للأورام للسيسبلاتين. وأظهرت النتائج وجود تفاعل تآزري قوي بين dp53m والسيسبلاتين.وهذا يعني أن dp53m يمكن أن يعزز حساسية خلايا السرطان p53-R175H للسيسبلاتين.وهذا يوفر "شريكًا لا يقهر" لعلاج السرطان.
تعزيز خط الدفاع المضاد للسرطان، العلماء يبنون طريق الأمل معًا
السرطان هو مرض يحدث بسبب نمو الخلايا بشكل غير منضبط. وقد زاد معدل حدوثه بشكل ملحوظ مع شيخوخة السكان في العالم، وزيادة التلوث البيئي، والتغيرات في عادات نمط الحياة. وبحسب بيانات الوكالة الدولية لأبحاث السرطان، من المتوقع أن يرتفع عدد حالات الإصابة الجديدة بالسرطان في جميع أنحاء العالم من حوالي 19.29 مليون حالة في عام 2020 إلى حوالي 30.23 مليون حالة في عام 2040، أي بزيادة قدرها 56.71%.
يلعب الباحثون دورًا حاسمًا في المعركة العالمية ضد السرطان. المؤلفون الثلاثة المراسلون في هذه الدراسة هم:السيد وو سيجين من كلية هويهو للصيدلة بجامعة شيآن جياوتونغ-ليفربول، والأستاذ شي سونغبو والأستاذ تشونج ديانشينغ من مستشفى جامعة تيانجين الطبية العام هم ممثلون بارزون في هذا المجال.
ومن بينهم البروفيسور وو سيجين الذي يركز على البحث والتطوير للأدوية المستهدفة الجديدة. تركز أبحاثه الحالية على استخدام تصميم الأدوية بمساعدة الكمبيوتر واكتشافها لتحديد الأدوية العلاجية الجديدة باستخدام أساليب المحاكاة مثل النمذجة وتحليل الفارماكوفور والالتحام والديناميكيات الجزيئية (MD). في دراسته التي أجراها عام 2022، وجد أن التعبير المتزايد عن جين SOST كان مرتبطًا بسوء التشخيص لدى مرضى سرطان الثدي، كما قام جين SOST بتنشيط مسارات الإشارة اللاحقة لتعزيز تكاثر خلايا سرطان الثدي ونقائل العظام. ومن خلال الفحص الحسابي، حددت الدراسة مركبًا علاجيًا مرشحًا، S6، والذي يمكنه تعطيل التفاعل بين SOST وSTAT3 لتثبيط فسفرة STAT3 وتقليل نقائل سرطان الثدي في العظام.
عنوان الورقة:
https://pubmed.ncbi.nlm.nih.gov/36581888
وعلاوة على ذلك، اقترح البروفيسور شي سونغبو، الذي يتركز اتجاهه البحثي الرئيسي على تحلل البروتين المستهدف وتوصيل الدواء، في دراسته التي أجراها عام 2023 أنه يمكن استخدام استراتيجية جديدة لتحفيز تحلل البروتينات "غير القابلة للعلاج" باستخدام الأبتامرات كـ "رؤوس حربية مستهدفة". ولتأكيد هذا المفهوم، اختار الباحثون النوكليولين المسبب للسرطان (NCL) كهدف، وفي النهاية أنتجوا سلسلة من مُحللات NCL. أدى dNCL#T1 إلى تحفيز تحلل NCL بطريقة تعتمد على نظام البروتياز اليوبيكويتين، والذي يمكن أن يمنع تكاثر خلايا سرطان الثدي الناجم عن NCL. ولم تقدم هذه الدراسة منظورًا جديدًا لتحلل البروتين فحسب، بل أرست أيضًا أساسًا متينًا لتطوير الأدوية العلاجية لأمراض مثل السرطان.
عنوان الورقة:
https://pubmed.ncbi.nlm.nih.gov/36608275
وأخيرًا، أجرى البروفيسور تشونج ديانشينغ أيضًا أبحاثًا معمقة في مجالات التشخيص المبكر والعلاج الكيميائي والعلاج المستهدف والعلاج المضاد لسرطان الرئة، ونشر أكثر من 90 بحثًا أكاديميًا. في دراسته التي أجراها عام 2024، وجد أن CBX4 يعزز انتشار سرطان الغدة الرئوية (LUAD) من خلال زيادة تنظيم التعبير عن PHGDH وتخليق السيرين، في حين يثبط نقائل LUAD عن طريق قمع نسخ ZEB2. تساعدنا هذه النتيجة على فهم التفاعل بين CBX4 والعوامل فوق الجينية وتوفر رؤى حول الأساليب العلاجية المحتملة لمرض LUAD.
عنوان الورقة:
https://www.nature.com/articles/s41419-024-06745-z
بالإضافة إلى المعلم وو سيجين والأستاذ شي سونغبو والأستاذ تشونغ ديانشينغ، هناك العديد من العلماء والأطباء الذين يعملون بصمت وبجد. نحن نتطلع إلى اليوم الذي لن يكون فيه السرطان كابوسًا للبشرية مع استمرار التقدم العلمي والتكنولوجي.








