Command Palette
Search for a command to run...
حل تحدي النمذجة على المستوى الذري لتباين تكوين البروتين! تحليل إطار عمل PLACER لفريق ديفيد بيكر

في عالم الجزيئات، تُعدّ التفاعلات بين البروتينات والأحماض النووية، والجزيئات العضوية وغير العضوية الصغيرة، والأيونات المعدنية، أساسيةً لوظائف الحياة. ويمكن أن يؤثر كل إدراك أو ارتباط لهذه التفاعلات على الوظائف البيولوجية، ويحدد فعالية الأدوية، بل ويؤثر على نجاح أو فشل تصميم إنزيمات جديدة. ومع ذلك، لا تزال النمذجة الذرية لهذه التفاعلات وتباينها التكويني مهمةً بالغة الصعوبة بالنسبة للصناعة.
لقد أدت أدوات الالتحام الجزيئي الصغيرة المعتمدة على التعلم العميق (DL) مثل DiffDock إلى تحسين الدقة مقارنة بالطرق السابقة.ومع ذلك، فإن فرق الأداء ليس كبيرا في المهام عالية الدقة.علاوة على ذلك، يتدهور الأداء بشكل كبير عند مواجهة مستقبلات غير مرئية؛ بالإضافة إلى ذلك، تم تطوير العديد من الأساليب القائمة على التعلم العميق لتوليد تشكيلات جزيئية صغيرة من الهياكل الكيميائية.ومع ذلك، فإن هذه الأساليب عادة ما تنمذج فئات محددة فقط من الكائنات المتفاعلة، وبالتالي تحد من قدرتها على تحديد الطيف الكامل لوظيفة البروتين.
وبناءً على ذلك، قام فريق بحثي بقيادة البروفيسور الحائز على جائزة نوبل ديفيد بيكر من جامعة واشنطن بتطوير شبكة عصبية بيانية تسمى PLACER (محلل المجموعة التوافقية الذرية للبروتين والربيطة).يمكنه إنشاء هياكل جزيئات عضوية صغيرة مختلفة بدقة استنادًا إلى التركيب الذري ومعلومات الرابطة للجزيئات الصغيرة؛ ونظرًا للبيئة البنيوية العيانية للبروتينات، يمكنه إنشاء الهياكل التفصيلية للجزيئات الصغيرة والسلاسل الجانبية للبروتين لمهام الالتحام بين الجزيئات الصغيرة والبروتين.في أبحاث تصميم الإنزيمات، اكتشف فريق البحث أن استخدام PLACER لتقييم دقة المواقع النشطة المُصممة ودرجة التنظيم المسبق يُمكن أن يُحسّن بشكل كبير من معدل نجاح التصميم ونشاط الإنزيم. على سبيل المثال، حصل الباحثون على مضاد ألدولاز مُنظم مسبقًا بنسبة kcat/KM = 11,000 M⁻¹·min⁻¹.إنها تتفوق على جميع نتائج التصميم قبل ظهور التعلم العميق.
وقد تم نشر نتائج البحث ذات الصلة، بعنوان "نمذجة مجموعات التكوين البروتيني الجزيئي الصغير باستخدام PLACER"، في وقائع الأكاديمية الوطنية للعلوم (PNAS).
أبرز الأبحاث:
* PLACER عالي السرعة وعشوائي، مما يمكنه من إنشاء عدد كبير من عينات التنبؤ بسرعة لتصوير توزيع التباين التكويني.
* من خلال استخدام تمثيل موحد على المستوى الذري لجميع التفاعلات، يمكن توسيع PLACER بسهولة إلى ما هو أبعد من الجزيئات الحيوية، مثل الجزيئات الحلقية الكبيرة والجزيئات الصغيرة المعقدة الأخرى.
* يتمتع PLACER بقيمة كبيرة لتصميم الإنزيم الحسابي وتصميم الجزيئات الصغيرة: حيث يمكنه تقييم دقة إعادة بناء الموقع النشط المصمم والتنظيم المسبق للمجموعات الوظيفية الرئيسية المحفزة/المتفاعلة في السلسلة الجانبية بسرعة.

عنوان الورقة:
https://www.biorxiv.org/content/10.1101/2024.09.25.614868v2
قم بمتابعة حساب WeChat الرسمي الخاص بنا وقم بالرد "enzyme design" في الخلفية للحصول على ملف PDF كامل.
مجموعات البيانات: إن بناء البيانات المتنوعة ومتعددة المستويات يؤكد قدرة التعميم الممتازة
للتنبؤ بتكوين الجزيئات الصغيرة، اختار الفريق أكثر من 226,000 بنية بلورية جزيئية صغيرة عضوية غير بوليمرية من قاعدة بيانات كامبريدج للهياكل (CSD) كمجموعة تدريب، واختار 7,116 عينة كمجموعة تحقق. يوفر كل جزيء معلومات كاملة عن التركيب الذري والروابط الكيميائية، بينما تُضبط إحداثيات الذرات عشوائيًا، مما يُمكّن النموذج من تعلم القدرة على استعادة هياكل دقيقة في ظل ظروف الضوضاء.لا تضمن استراتيجية التدريب هذه أن النموذج يمكنه التقاط التغييرات الدقيقة للجزيئات الصغيرة في التكوينات المختلفة فحسب، بل تسمح أيضًا بإنشاء مجموعة متنوعة من التكوينات الجزيئية من خلال عمليات تشغيل متعددة.
فيما يتعلق بأنظمة الجزيئات البروتينية الصغيرة، اختار فريق البحث هياكل عالية الدقة (<2.5 Å) من بنك بيانات البروتين (PDB)، بما في ذلك معقدات الجزيئات البروتينية الصغيرة، بإجمالي حوالي 113,000 عينة تدريب و7,090 عينة تحقق. والجدير بالذكر،استبعد الفريق جزيئات الماء فقط، لكنه احتفظ بالمعلومات حول الجزيئات الصغيرة غير البيولوجية المحتملة (مثل المذيبات) لأنها لا تزال تقدم أدلة قيمة حول التفضيلات الفيزيائية والكيميائية للواجهات الجزيئية.يتم اقتصاص بيانات التدريب لتحتوي على ما يصل إلى 600 ذرة ثقيلة ويتم إزعاجها بالضوضاء الغوسية حول مراكز الذرات المختارة عشوائيًا لمحاكاة البيئة الديناميكية المعقدة للبروتينات والجزيئات الصغيرة في الواقع.
يضمن بناء البيانات متعدد الطبقات والمتنوع هذا أن يُظهر PLACER قدرة تعميم ممتازة عند معالجة كل شيء بدءًا من الجزيئات الصغيرة الفردية إلى أنظمة الجزيئات البروتينية الصغيرة المعقدة.
تستخدم الشبكة العصبية PLACER بنية ثلاثية المسارات، مع التركيز على السلاسل الجانبية على المستوى الذري وتكوينات الجزيئات الصغيرة.
PLACER هي شبكة عصبية لإزالة الضوضاء، تتضمن مدخلاتها معلومات عن هياكل بروتينية مضطربة جزئيًا ومعلومات عن البنية الكيميائية (باستثناء الإحداثيات) لأي جزيئات متفاعلة. أما مخرجاتها، فهي البنية الذرية الكاملة للمركب وعدم اليقين في موضع كل ذرة في نموذج التنبؤ، كما هو موضح في الشكل (أ) أدناه.
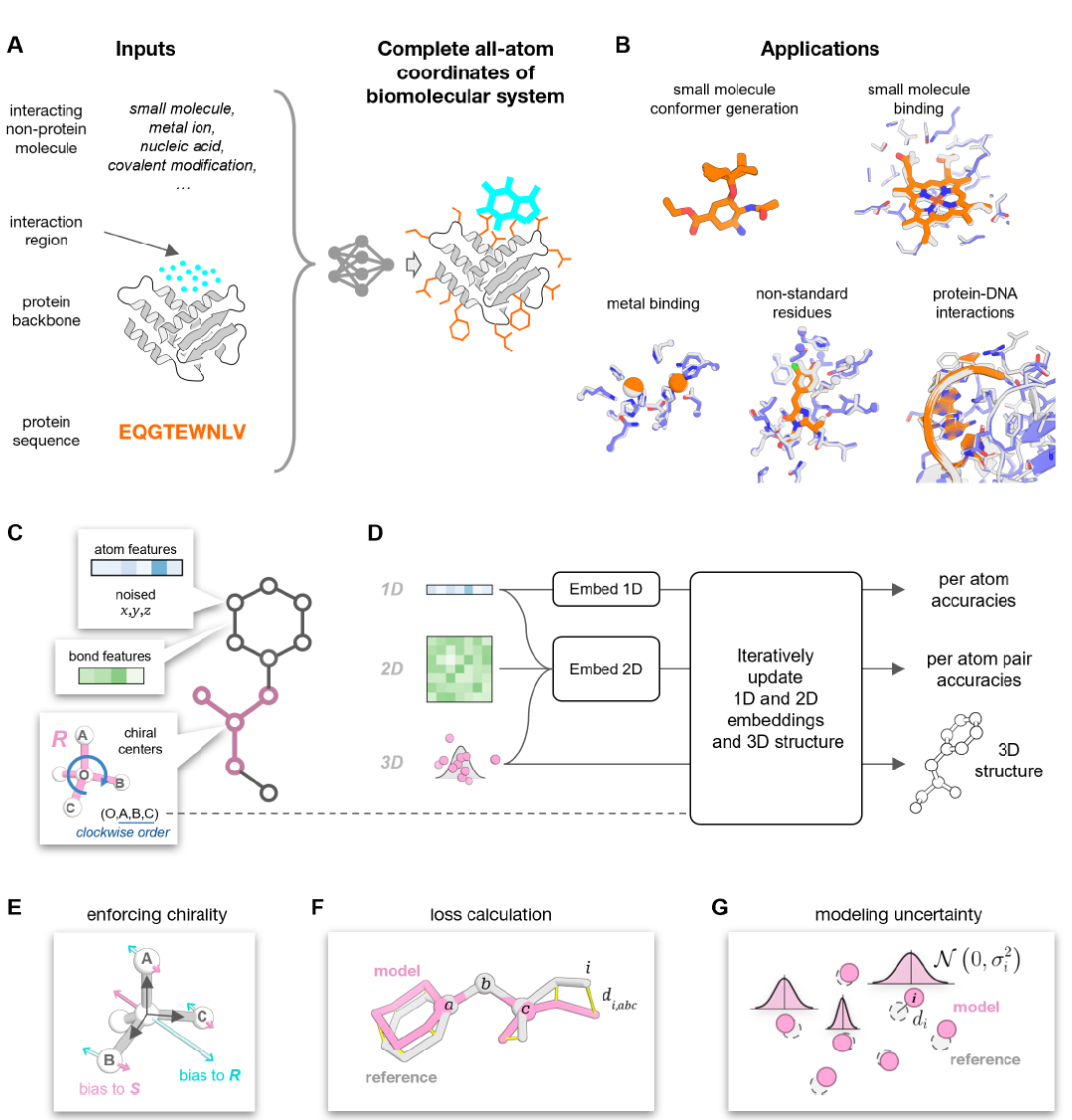
خلال مرحلة الإدخال، يتحول النظام الجزيئي إلى رسم بياني كيميائي، حيث تُمثل العقد ذرات ثقيلة فردية (لم تُصمم ذرات الهيدروجين لتقليل التكاليف الحسابية)، وتُمثل الحواف الروابط الكيميائية بين الذرات (انظر الشكل ج أعلاه). يتسق هذا التمثيل عبر أنواع الجزيئات المختلفة. تحتوي كل عقدة في الشبكة على معلومات حول نوع الذرة وإحداثياتها ثلاثية الأبعاد المضطربة في البداية. تتمثل مهمة الشبكة في إزالة الضوضاء من إحداثيات الإدخال بشكل متكرر مع تقدير أوجه عدم اليقين في مواقع الذرات داخل بنية نموذج المخرجات (انظر الشكل د أعلاه).
يعتمد PLACER على بنية ثلاثية المسارات مستوحاة من RoseTTAFold (RF)، والبنية العامة للشبكة هي كما يلي:
* تصميم ثلاثي المدارات (1D، 2D، 3D): المدارات أحادية الأبعاد تتعامل مع معلومات السمات الذرية؛ المدارات ثنائية الأبعاد تتعامل مع العلاقات الزوجية بين الذرات (مثل الروابط الكيميائية والقرب المكاني)؛ المدارات ثلاثية الأبعاد مسؤولة عن تحديث إحداثيات الذرات.
* التحسين التكراري: بعد اكتمال التضمين الأولي للخصائص أحادية وثنائية الأبعاد، تُمرَّر هذه الخصائص إلى كتلة التكرار لتحديث متجهات التضمين والبنية ثلاثية الأبعاد تكراريًا. في كتلة التكرار، يُنشأ أولًا رسم بياني لجوار الذرات - لكل ذرة، يُختار نصف القرب المكاني ونصف القرب الكيميائي، ليصل المجموع إلى 32 ذرة أقرب جار. بعد ذلك، تُسقط أزواج الخصائص ثنائية الأبعاد في تضمينات الحافة من خلال طبقة محول التغذية الأمامية، وتُستخدم، مع الخصائص أحادية البعد، ورسم بياني لجوار الذرات، والبنية الذرية ثلاثية الأبعاد الحالية، كمدخلات لشبكة محول SE3 لتحديث إحداثيات ثلاثية الأبعاد ومتجهات التضمين أحادية البعد.
* معالجة المركز الكيرالي: تُمرَّر معلومات المركز الكيرالي إلى الشبكة عبر سمات النوع الأول (المتجه) (انظر الشكل هـ أعلاه)؛ تخضع سمات المدارات ثنائية الأبعاد لتحديثات زوجية، وتُدمج مع انحيازات هيكلية. تتفرع رؤوس التنبؤ بالثقة للذرات وأزواجها من المدارات أحادية وثنائية الأبعاد على التوالي لإكمال حساب الكتل التكرارية؛ تحتوي الشبكة المُدرَّبة بالكامل على ثماني كتل تكرارية بأوزان مشتركة.
* تصميم دالة الخسارة: يستخدم تدريب PLACER مزيجًا من الخسارة الهيكلية وفقدان ثقة التنبؤ، ويُطبّق بعد كل تكرار. الخسارة الهيكلية الأساسية هي خطأ نقطة محاذاة الإطار (FAPE) لجميع الذرات؛ ويتم تقييم ثقة بنية النموذج على مستوى الذرات ومستوى أزواج الذرات.
من خلال هذه الشبكة المصممة بعنايةيمكن لـ PLACER إنشاء مجموعات متنوعة ودقيقة ذريًا من تكوينات جزيئات البروتين الصغيرة بدءًا من إحداثيات تم تهيئتها عشوائيًا.يوفر هذا أساسًا موثوقًا للتحليل والتصميم اللاحقين. بخلاف طرق التنبؤ ببنية البروتين مثل AlphaFold،لا يتنبأ PLACER بالبنية الرئيسية لسلسلة البروتينات، ولكنه يركز على السلاسل الجانبية على المستوى الذري وتكوينات الجزيئات الصغيرة، وبالتالي يعمل على تحسين سرعة الحوسبة بشكل كبير ويسمح بإنشاء مجموعات تكوين متنوعة.
عرض النتائج: توفير الدعم للهندسة الدقيقة من الجزيئات الصغيرة إلى أنظمة البروتين المعقدة
التنبؤ بتكوين الجزيئات الصغيرة
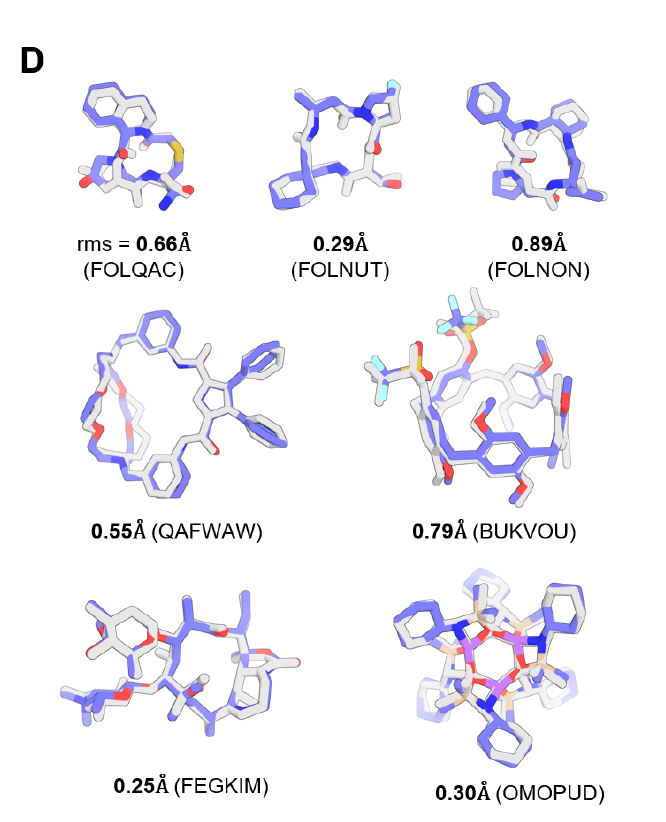
تثبت الاختبارات التي أجريت على مجموعة بيانات الجزيئات الصغيرة CSD أن PLACER المدرب بالكامل يمكنه توليد الهياكل ثلاثية الأبعاد للجزيئات المعقدة بشكل صحيح بدقة أقل من Å.تشمل الأمثلة الحلقات الكبيرة التي تحتوي على أكثر من 50 ذرة (انظر الشكل د أدناه)، بما في ذلك الحلقات الكبيرة للببتيد (انظر الصف العلوي من الشكل د أدناه). تُظهر تجارب الاستئصال أن فقدان معلومات مسافة الرابطة أو تقليل عدد التكرارات يُقلل بشكل كبير من دقة التنبؤ، مما يُظهر الأهمية الحاسمة لاستراتيجيات التكرار والخصائص المُصممة لـ PLACER.
تفاعلات البروتين مع الجزيئات الصغيرة
استخدم الباحثون PLACER لإنشاء مجموعة من التكوينات الجزيئية الصغيرة في جيب البروتين المستهدف (الشكل أ أدناه) عن طريق تشغيل الشبكة عدة مرات، وفي كل مرة مع تهيئة عشوائية مختلفة لإحداثيات الإدخال.يوضح تحليل مجموعة التكوين المولدة أن PLACER غير حساس للموضع الأولي للربيطة: يمكن لمواضع بداية متعددة مختلفة أن تنتج تنبؤات قريبة من التكوين الطبيعي (الشكل ب أدناه)، وتغطي هذه المواضع المساحة الكاملة لعينة الإدخال (الشكل د أدناه).لاحظ الباحثون أيضًا أن درجة RMSD المتوقعة (pRMSD) المحسوبة على أساس ذرات الربيطة يمكن استخدامها لاختيار نماذج أكثر دقة من مجموعة العينات (الشكل E أدناه)، مع إظهار النموذج الأعلى درجة درجة عالية من الاتفاق مع البنية التجريبية (الشكل C أدناه).
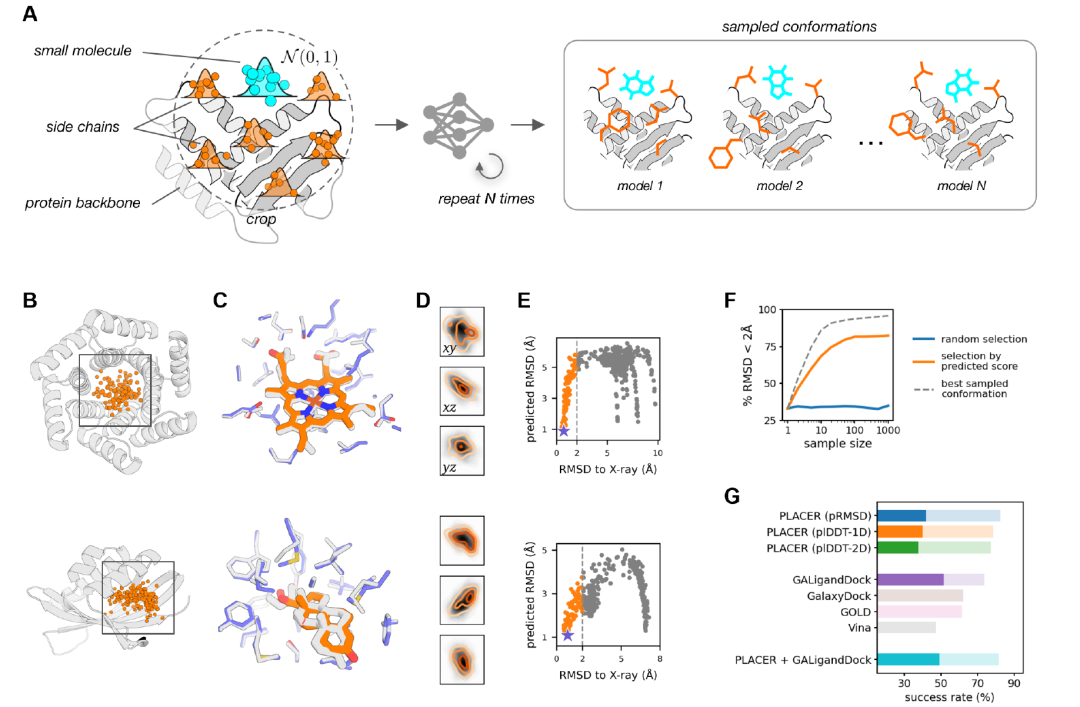
كما هو موضح في الشكل (ز) أعلاه، في اختبار التكوين غير الطبيعي لـ 65 هدفًا دوائيًا، أظهر PLACER أداءً ممتازًا في توليد واختيار تكوينات شبه طبيعية، متجاوزًا معدل نجاح باستخدام تسجيل pRMSD معدل نجاح أدوات الإرساء التقليدية مثل Vina وGOLD وGalaxyDock. وبالمقارنة مع طريقة Rosetta GALigandDock الأفضل أداءً، كان أداء PLACER أفضل في نطاق الدقة المنخفضة (نسبة المركبات ذات RMSD للربيطة < 2 Å) (82.4% مقابل 73.6%)، ولكنه كان أسوأ قليلاً في نطاق الدقة العالية (RMSD < 1 Å) (41.8% مقابل 51.6%).
مع ذلك، يظل أداء PLACER جديرًا بالملاحظة، لأنه، على عكس الطرق الأخرى، غير مُدرَّب خصيصًا لمهام ربط البروتينات بالجزيئات الصغيرة غير الطبيعية. يستطيع PLACER إعادة بناء تكوين الجزيئات الصغيرة والسلاسل الجانبية للبروتين من الصفر، بينما تعتمد طرق الاختبار الأخرى بشكل أساسي على إحداثيات البروتين المُدخل.
تصميم الموقع النشط للإنزيم
يُعدّ تطبيق PLACER في تصميم الألدولازات الرجعية جديرًا بالملاحظة بشكل خاص. أجرى فريق البحث 50 محاكاة متكررة لسلسلة RA95 من الألدولازات الرجعية ونسخها المُحسّنة المُطوّرة، مُحللين التنوع التكويني لليسين ذي الموقع النشط ووسيطه التساهمي. أظهرت النتائج أنه بالنسبة للإنزيمات منخفضة النشاط في التصميم الحسابي الأولي، ولّد PLACER مجموعات تكوينية شديدة التنوع، مما يُشير إلى نقص في التنظيم المسبق؛ بينما في النسخ المُطوّرة الأكثر نشاطًا، أصبحت المجموعات التكوينية أكثر تنظيمًا. هذا يُشير إلى أن...يعد الافتقار إلى التنظيم المسبق أحد العيوب الرئيسية في تصميم الإنزيم المبكر، في حين يوفر PLACER أداة تقييم سريعة يمكن استخدامها لتوجيه عمل تصميم الإنزيم.
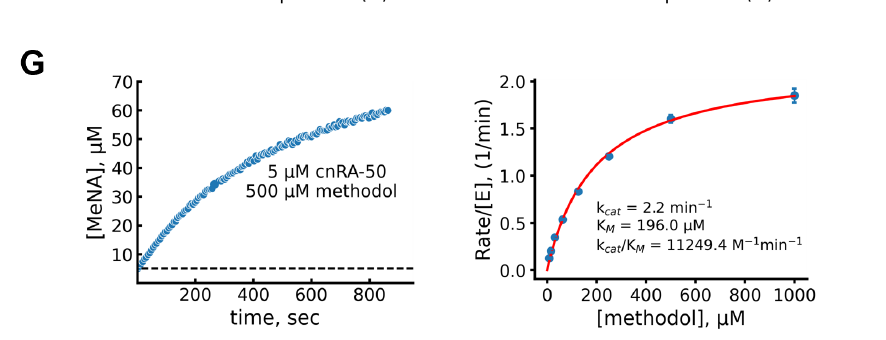
علاوةً على ذلك، صمم الفريق نوعًا جديدًا من إنزيم عكس الألدوستيرون يعتمد على طيّ شبيه بـ NTF2، وقيّم العلاقة بين درجة التنظيم المسبق وقيمة kcat/KM باستخدام PLACER. أظهرت النتائج أن PLACER تنبأت بالتصاميم عالية التنظيم المسبق، وتميزت عمومًا بكفاءة تحفيزية أعلى، حيث حقق التصميم الأكثر نشاطًا، cnRA-50، قيمة kcat/KM بلغت 11,000 M⁻¹min⁻¹، وهي أعلى بكثير من التصاميم الحسابية السابقة، وتقترب من نشاط التصاميم المُعدّة باستخدام أحدث أساليب انتشار الترددات الراديوية (RFdiffusion) وproteinMPNN.
ويتوقع فريق البحث أن،سيتم استخدام طرق توليد المجموعة التوافقية القائمة على PLACER على نطاق واسع في النمذجة البنيوية للجزيئات غير البروتينية المعقدة في الحالات المعزولة أو البيئات البروتينية، وكذلك لتقييم تصميم الإنزيم وتصميم الاقتران بين الجزيئات الصغيرة البروتينية.
البروفيسور ديفيد بيكر: رائد ركز منذ فترة طويلة على تصميم البروتين الحاسوبي
في 9 أكتوبر 2024، حصل رائد تصميم البروتين الشهير البروفيسور ديفيد بيكر، إلى جانب مطوري AlphaFold2 ديميس هاسابيس وجون إم. جامبر من DeepMind، على جائزة نوبل في الكيمياء لعام 2024.
ركّز البروفيسور ديفيد بيكر منذ فترة طويلة على تصميم البروتينات الحاسوبية، وتوفير أدوات التعلم العميق مفتوحة المصدر، مثل RoseTTAFold وRFdiffusion وProteinMPNN، لتمكين تصميم بروتينات جديدة. كما قاد عملية تطوير هذه التقنيات من خلال تأسيس شركة، مما جعله خبيرًا عالميًا في هذا المجال. وفي أحدث أبحاثه، حقق فريقه إنجازاتٍ كبيرة في العديد من الاتجاهات الجديدة.
على سبيل المثال، عند تطوير أدوية جديدة، غالبًا ما يستخدم الباحثون البروتينات كأهداف رئيسية للأدوية، حيث يربطون الدواء ببروتينات مستقرة هيكليًا للتدخل في تطور المرض. ومع ذلك، لا يزال استهداف البروتينات المضطربة طبيعيًا (IDPs)، التي تفتقر إلى بنية وتسلسل وتفضيلات تكوينية محددة جيدًا، أمرًا صعبًا. في ظل هذه الظروف، اقترح فريق ديفيد بيكر في أغسطس 2025 استراتيجية لتصميم البروتينات تُسمى "لوجوس"، تستند إلى استراتيجية ربط ملائمة مستحثة، حيث تُصمم بروتينات ربط قادرة على التكيف مع 39 تسلسلًا من الأحماض الأمينية المضطربة المستهدفة. هذا يعني أن المزيد من البروتينات يمكن أن يوفر أهدافًا لتطوير أدوية جديدة، مما قد يُسرّع الأبحاث في مجال السرطان ومرض الزهايمر.
عنوان الورقة:تصميم البروتينات المرتبطة بالمناطق المضطربة جوهريًا
عنوان الورقة:https://www.science.org/doi/10.1126/science.adr8063
في 18 سبتمبر 2025، اقترح فريق ديفيد بيكر نموذج انتشار ذري كامل - RFdiffusion3 (RFD3) - يُمكّن من تصميم تفاعلات جزيئية حيوية كاملة الذرات. يُمكن لهذا النموذج توليد هياكل بروتينية في سياق الربائط والأحماض النووية ومجموعات أخرى غير بروتينية، وهو أبسط وأكثر كفاءة من الطرق السابقة. في سلسلة من اختبارات المحاكاة الحاسوبية، تفوق نموذج RFdiffusion3 على الطرق السابقة، حيث بلغت تكاليفه الحسابية عُشر تكاليف سابقاته فقط.
عنوان الورقة:تصميم جديد للتفاعلات الجزيئية الحيوية لجميع الذرات باستخدام انتشار الترددات الراديوية3
عنوان الورقة:https://www.biorxiv.org/content/10.1101/2025.09.18.676967v1
تلعب قنوات الأيونات الطبيعية دورًا محوريًا في الأنظمة البيولوجية، وقد استُخدمت نسخها المُهندَسة صناعيًا على نطاق واسع في أدوات وأجهزة الاستشعار الكيميائية الجينية. في حين استُخدم تصميم البروتين لبناء بروتينات عبر غشائية ذات هياكل مسامية، إلا أن تصميم "مرشحات انتقائية" - أي تلك التي تحتوي على سلاسل جانبية دقيقة من الأحماض الأمينية تستهدف أيونات محددة - مثل قنوات الأيونات الطبيعية، كان قيدًا تكنولوجيًا. في أكتوبر 2025، استخدم أحدث بحث لفريق ديفيد بيكر، ولأول مرة، الذكاء الاصطناعي لتصميم قناة أيونات كالسيوم جديدة من الصفر. تُظهر هذه الدراسة أنه حتى الوظائف الكيميائية الحيوية المعقدة التي لا نفهمها إلا جزئيًا يمكن بناؤها الآن من المبادئ الأولية باستخدام الذكاء الاصطناعي.
عنوان الورقة:التصميم من الأسفل إلى الأعلى لقنوات Ca² ⁺ من هندسة مرشح الانتقائية المحددة
عنوان الورقة:https://www.nature.com/articles/s41586-025-09646-z
بالنظر إلى إنجازاتهم الأخيرة، يُعيد البروفيسور ديفيد بيكر وفريقه صياغة مشهد علم البروتينات بوتيرة مذهلة، بدءًا من استراتيجية "لوجوس" القادرة على الارتباط بالبروتينات غير المنظمة طبيعيًا، ووصولًا إلى انتشار الترددات الراديوية (RFdiffusion3)، التي تُمكّن من تصميم التفاعلات الجزيئية على المستوى الذري، وصولًا إلى البحث الرائد حول أول بناء جديد لقنوات أيونات الكالسيوم. يواصل فريق بيكر دفع تصميم البروتينات الحاسوبي من النظرية إلى الواقع. لا يقتصر عملهم على توسيع آفاق التصميم الجزيئي الحيوي فحسب، بل يُبرز أيضًا مستقبل "بناء وظائف الحياة باستخدام الخوارزميات" بشكل متزايد.
روابط مرجعية:
1.https://www.biorxiv.org/content/10.1101/2024.09.25.614868v2
2.https://www.thepaper.cn/newsDetail_forward_31663354
3.https://www.biorxiv.org/content/10.1101/2025.09.18.676967v1
4.https://www.nature.com/articles/s41586-025-09646-z








