Command Palette
Search for a command to run...
يقترح فريق ديفيد بيكر نهجًا جديدًا لتصميم بروتينات ربط المناطق غير المنظمة، والتي تستهدف على وجه التحديد أهدافًا غير قابلة للعلاج، في مجلة العلوم.

لأن معظم الأمراض ترتبط ارتباطًا مباشرًا بخلل في وظيفة البروتينات، تلعب البروتينات دورًا رئيسيًا في تطوير الأدوية. عند تطوير أدوية جديدة، غالبًا ما يستخدم الباحثون البروتينات كأهداف رئيسية للأدوية، مما يسمح للأدوية بالارتباط ببروتينات مستقرة جزئيًا للتدخل في مسار المرض.ومع ذلك، فإن استهداف الأدوية للبروتينات المضطربة جوهريًا (IDPs) التي تفتقر إلى التفضيلات البنيوية والتسلسلية والتكوينية المحددة جيدًا لا يزال يمثل تحديًا.
تعتمد الطريقة التقليدية لاستخدام استهداف الأجسام المضادة بشكل أساسي على قدرة الأجسام المضادة على الارتباط ببروتينات محددة بدقة عالية لتحقيق التعرف على البروتينات المستهدفة وتنظيمها. ومع ذلك، لا يتطلب هذا المسار الاستهدافي الكثير من العمليات التجريبية فحسب، بل إن المستضدات غير المنتظمة تتحلل بسهولة وتصبح غير فعالة بعد الحقن. لذلك،إن البروتينات التي تحتوي على مناطق مضطربة جوهريًا (IDRs) تمثل أكثر من 50% في البروتيوم يتم الحكم عليها عمومًا بأنها أهداف "غير قابلة للعلاج" ولم يتم استخدامها مطلقًا في تطوير الأدوية.
وفي هذا السياق، اقترح ديفيد بيكر، عالم الأحياء الحاسوبية المتميز الذي فاز بجائزة نوبل في الكيمياء لعام 2024 ومدير معهد تصميم البروتين في جامعة واشنطن، وفريقه استراتيجية لتصميم البروتين تسمى "لوجوس".بناءً على استراتيجية الربط الملائم المستحث، تم تصميم بروتينات الربط التي يمكنها التكيف مع 39 تسلسلًا من الأحماض الأمينية غير المنظمة المستهدفة.أنتجت هذه الدراسة هيكلًا بروتينيًا متخصصًا ممتدًا متكررًا، ثم عممته باستخدام نموذج انتشار الترددات الراديوية. يتضمن الهيكل جيوبًا مصممة خصيصًا لتسلسلات الببتيد المتكررة، مما يُمكّن قالب الببتيد المُصمم للرابط والهدف من التعرف عالميًا على مناطق البروتين غير المنتظمة. هذا يعني أن المزيد من البروتينات يمكن أن توفر أهدافًا لتطوير أدوية جديدة، مما قد يُسرّع الأبحاث في مجال السرطان ومرض الزهايمر.
وقد نُشرت نتائج البحث ذات الصلة في مجلة Science تحت عنوان "تصميم بروتينات ربط المناطق المضطربة جوهريًا".
أبرز الأبحاث:
*إنشاء مكتبة هيكلية نموذجية مناسبة للتعرف العام لتحقيق تحريض تكوين التكيف الملزم لأي تسلسل مستهدف.
* تم تصميم بروتينات ربط لـ 18 تسلسل ببتيد صناعي و 21 منطقة مضطربة بشكل طبيعي (IDRs) ذات تنوع واسع وإمكانات علاجية، وقادرة على استهداف المناطق المضطربة من المستقبلات خارج الخلية المرتبطة بالسرطان ودفع توطين البروتين داخل الخلايا.

عنوان الورقة:
https://www.science.org/doi/10.1126/science.adr8063
اتبع الحساب الرسمي ورد "البروتين الطبيعي المضطرب" للحصول على ملف PDF كامل
مزيد من أوراق البحث الرائدة في مجال الذكاء الاصطناعي:
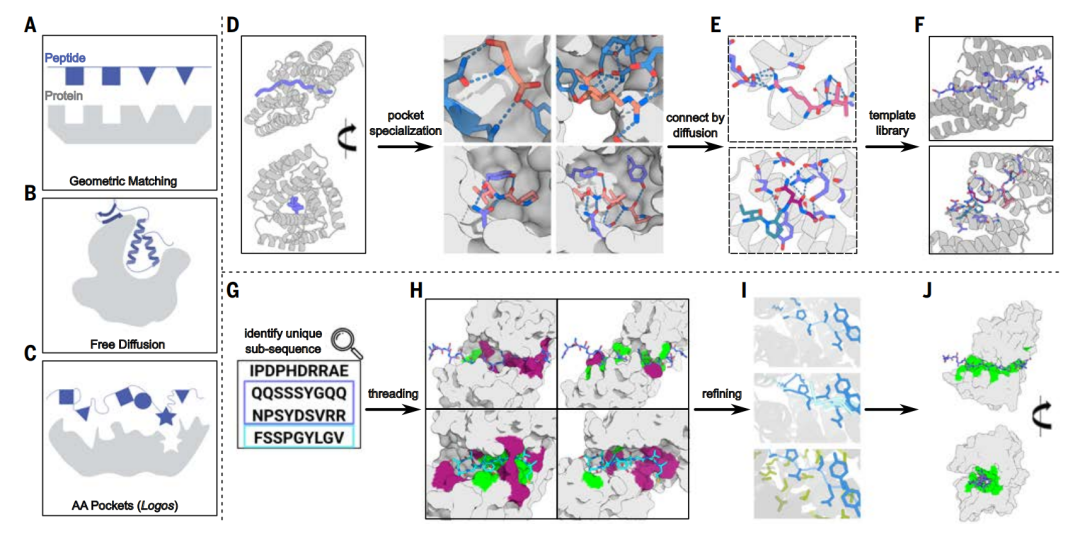
إنشاء مكتبة القوالب: التعريف العالمي للببتيد
تجمع هذه الدراسة بين أساليب التصميم الفيزيائي وأساليب تصميم التعلم العميق كحلٍّ لمشكلة ارتباط IDRs. يحدّ من ذلك عدم توافق وحدات الببتيد مع تسلسلات الأهداف غير المتجانسة.بدأت الدراسة بتركيبات بروتينية متكررة مختلفة، باستخدام نموذج الانتشار لإعادة تنظيم جيوب ربط الأحماض الأمينية في وحدات تكرار مختلفة وتمييزها إلى أحماض أمينية مختلفة وقوالب تكوينية.وهذا يسمح بالتعرف على التسلسلات على نطاق أوسع.
لتحديد الببتيدات في البروتينات غير المنتظمة طبيعيًا، أنشأت الدراسة أولًا مكتبة قوالب أساسية. تتميز مكتبة القوالب بخاصيتين:
*يجب أن يكون كل هيكل قالب قادرًا على "تغليف" تكوين سلسلة الببتيد الممتدة وتوفير عدد كبير من الفرص للتفاعلات مثل الرابطة الهيدروجينية والتعبئة الضيقة، وبالتالي تحقيق التعرف عالي التحديد على تسلسل الهدف.
*هيكل القالب واسع ويمكن أن يتطابق مع أي تسلسل مستهدف، بحيث يمكن لقالب واحد على الأقل أن يحفزه على أن يصبح تكوينًا ملزمًا محددًا ومناسبًا.
تنقسم عملية إنشاء مكتبة قوالب العمود الفقري إلى ثلاث خطوات: إنشاء العمود الفقري، وتخصص الجيب النشط للبروتين، وتجميع الجيب النشط للبروتين.
جيل السقالة
خلال مرحلة تكوين العمود الفقري، اختار فريق البحث استهداف تشكيلات ممتدة متعددة بدلاً من تقييد أنفسهم بتشكيل البولي برولين الثاني، حيث يحدث تشكيل البولي برولين الثاني بشكل أساسي في الببتيدات الغنية بالبرولين.
في التكوين الممتد، تواجه السلاسل الجانبية للأحماض الأمينية بالتناوب اتجاهات متعاكسة، وهو ما يتوافق مع خصائص التكرار المكون من بقاياين.استخدم الباحثون طريقة تصميم روزيتا لتصميم سلسلة من تسلسلات تكرار ثنائي الببتيد.بما في ذلك LK وRT وYD وPV وGA (كلها اختصارات مكونة من حرف واحد للأحماض الأمينية)، وهي مصممة للتشابك والارتباط بهذه الأجزاء الببتيدية في تكوينات ممتدة مختلفة، بحيث تتفاعل كل وحدة متكررة مع وحدة ثنائي الببتيد.
بعد ذلك، وصف الباحثون هذه النسخ المصممة من وحدات التكرار الأربع لبروتينات الربط من خلال تجارب استقطاب الفلورسنت. أظهرت النتائج قدرة ربط نانومولية لببتيدات التكرار LK وPV، لكنها أظهرت قدرة ربط أضعف لببتيدات RT وYD الأكثر قطبية، ولم تُرصد أي إشارة ربط على الإطلاق للحمض الغلوتاميكي عالي المرونة.
التخصص الجيب
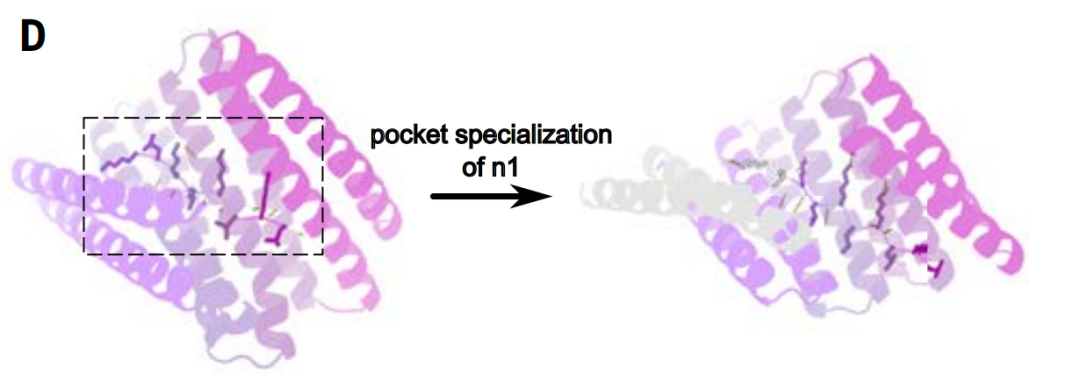
في خطوة تحديد الجيب النشط للبروتين، استخدم الباحثون نمذجة الانتشار لضبط الجيب لتحقيق تطابق أكثر دقة مع تسلسل الببتيد المستهدف المحدد.
لتحسين كفاءة مطابقة القالب، حسّن الباحثون جيب الارتباط المُصمم، بزيادة عدد وحدات التكرار المتفاعلة من أربع إلى خمس، مع تحسين التوافق مع تسلسل الهدف. كما عزز هذا النهج التقارب بين هياكل الهدف. وحُفظت الأحماض الأمينية، التي تتراوح من أربعة إلى تسعة أحماض أمينية، المحيطة بكل رابطة هيدروجينية متشعبة في السلسلة الجانبية بين بروتين التكرار والهيكل الببتيدي، ثابتة، مع تنويع التفاعلات الكارهة للماء بين بروتينات الارتباط المُصممة.
ميزة هذه الاستراتيجية هي أن متطلبات التكوين الهندسي للروابط الهيدروجينية أكثر صرامة. بالمقارنة، يتميز التكديس الكاره للماء غير القطبي بحرية مكانية أكبر. لذلك، يُعدّ الاحتفاظ بروابط الهيدروجين مباشرةً في قالب أكثر فعاليةً في التصميم من أخذ عينات من روابط الهيدروجين من الصفر مرارًا وتكرارًا.
يظهر الهيكل الخامس الموسع حديثًا باللون الرمادي الفاتح
تجميع الجيب
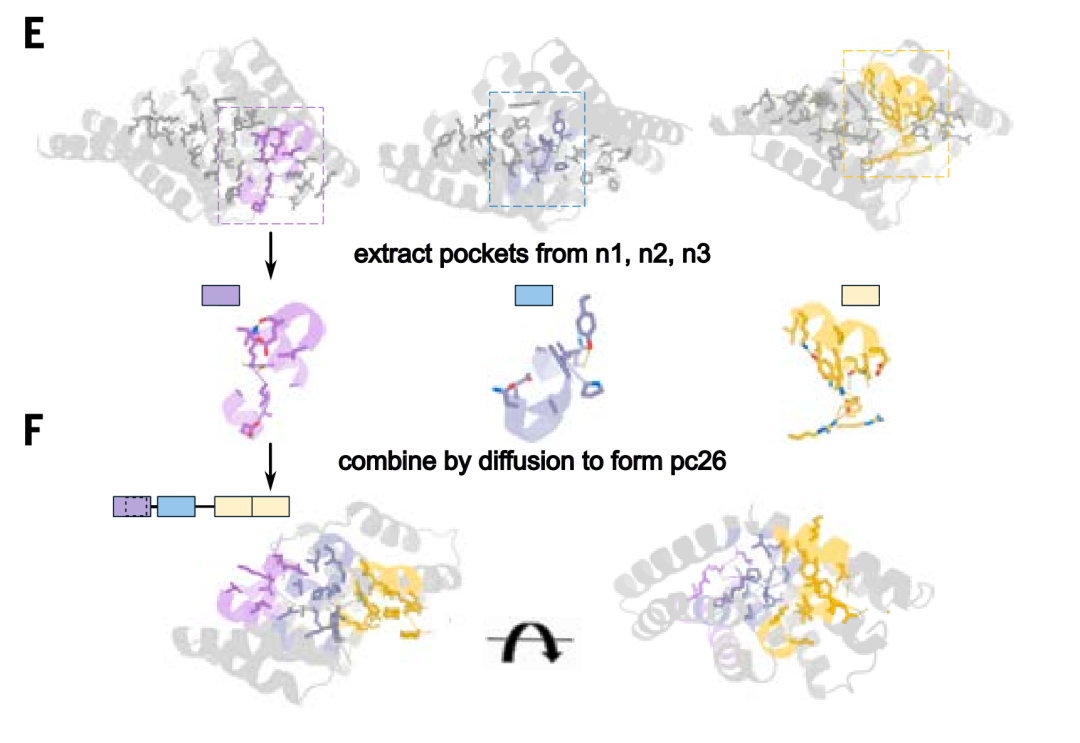
أثناء خطوة تجميع الجيب،استخدم الباحثون نموذج انتشار الترددات الراديوية لإنشاء واجهات بين الجيوب، مما أدى إلى إنشاء بنية صلبة شاملة وتوليد قالب لتجميع جيوب الربط في العمود الفقري الجديد.يتم ترتيب الجيوب المختلفة في القالب وفقًا لترتيبات وهندسة مختلفة للتفاعل مع هدف الببتيد في سلسلة من التكوينات الموسعة، مما يسمح بالتعرف بشكل عام على التسلسلات غير المتكررة.
بعد إنشاء نماذج بروتينية هجينة تتفاعل مع أهداف ببتيدية هجينة، حددت الدراسة مواقع جيوب الارتباط بارامتريًا وربطتها عبر انتشار الترددات الراديوية. باستخدام هذا النهج، أنتجت الدراسة 70 مقترح تصميم لسبعة أهداف هجينة. كشف التوصيف باستخدام وفرة إنزيم لوسيفيراز المنقسم وتجارب تداخل الطبقات الحيوية أنه بمتوسط 10 تصاميم فقط تم اختبارها لكل هدف، حققت ستة من الأهداف السبعة ارتباطًا نانوموليًا مزدوج الرقم.
لتوسيع حجم مكتبة القوالب لتغطية مجموعة أوسع من التسلسلات، استخدمت الدراسة تقنية التجميع الجيبي لبناء 36 هيكلًا عظميًا هجينًا يحتوي على جيوب تتعرف على البقايا القطبية، وتم إنشاء 1000 قالب يتكون من بروتين رابط مصمم وهيكل عظمي ببتيدي مطابق، حيث يمكن للأحماض الأمينية في تكوين الببتيد أن تتطابق مع الجيوب المصممة في بروتين الرابط.
تصميم وتحسين بروتين ربط IDR
بعد إنشاء مكتبة قوالب، أدرج الباحثون مناطق غير منظمة طبيعيًا في مكتبة القوالب، واستخدموها لتوليد بروتينات ربط قادرة على الارتباط بتسلسلات تركيبية غير متكررة وأي هدف غير منظم طبيعيًا. تنقسم هذه الخطوة إلى جزأين: مطابقة الخيوط والتحسين الهيكلي.
مطابقة الخيوط: تحديد زوج القالب والشظية التسلسلي الأكثر توافقًا
في مطابقة الخيوط، يتم ربط التسلسل المستهدف بالعمود الفقري لكل قالب لتحديد جزء التسلسل الأكثر توافقًا للاقتران مع القالب.
بشكل عام، يحتوي IDP أو IDR على عدد كبير من الببتيدات المحتملة التي يمكن استخدامها كأهداف. للعثور على الببتيد ذو القدرة الأكبر على الاستهداف في IDR،استبعدت الدراسة في البداية الببتيدات ذات التعقيد التسلسلي المنخفض والببتيدات ذات التطابقات الوثيقة المتعددة في البروتيوم لمنع التفاعلات المتبادلة مع المواد الرابطة لهذه الأهداف.بعد إعادة أخذ العينات من العمود الفقري المحلي عن طريق تعيين أجزاء التسلسل الفريدة للأحماض الأمينية المتبقية إلى العمود الفقري المستهدف لمكتبة القالب،استخدمت الدراسة أداة تصميم تسلسل البروتين القائمة على التعلم العميق ProteinMPNN لتحسين تسلسل بروتين الربط وتقييمه على أساس التوافق بين بروتين الربط المصمم وتسلسل الهدف والاتساق بين قيمة التنبؤ AF2 والنموذج.
في الحالات التي كانت فيها مقاييس AF2 دون المستوى الأمثل، استُخدم انتشار الترددات الراديوية (RFdiffusion) لتخصيص البنية الأساسية لهدف محدد. ثم استُخدمت المطابقة المترابطة لتوليد روابط لـ IDPs وIDRs وشظايا IDP ذات الصلة العلاجية، مما أدى إلى توليد متوسط 28 تصميمًا لكل هدف.
التحسين الهيكلي: تحسين التوافق بين البروتين الرابط والببتيد المستهدف
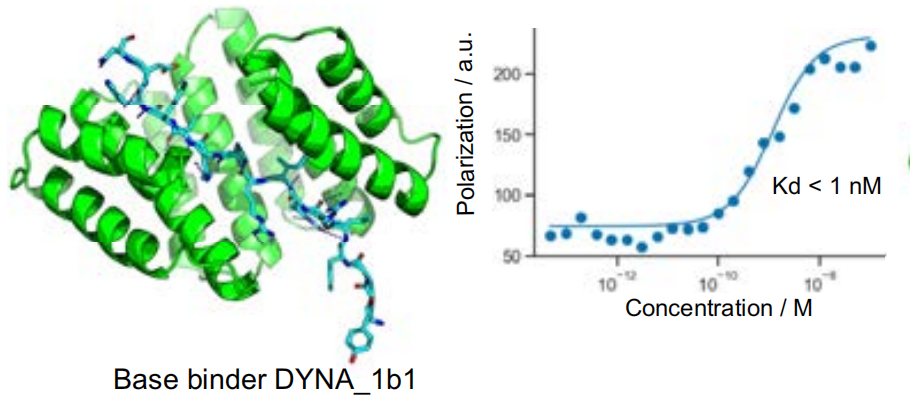
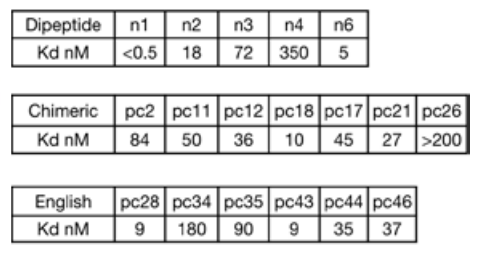
تم أيضًا تحسين أفضل تطابق لتعزيز التوافق بين بروتين الارتباط المصمم والببتيد المستهدف.وقد اختارت الدراسة ثابت تفكك بروتين ربط DYNA_1b1 والدينورفين للاختبار، وحسنت انتشار الترددات الراديوية لأعلى معدل إصابة للأهداف الاصطناعية.وأظهرت النتائج أنه من بين 48 تصميمًا، أظهر 45 تصميمًا تقاربًا قويًا في اختبار الفحص، وأظهرت ثوابت التفكك في 6 تصميمات فقط تقاربًا ضعيفًا.
التحقق من صحة التعامد بين بنية الدينورفين وبروتين الارتباط
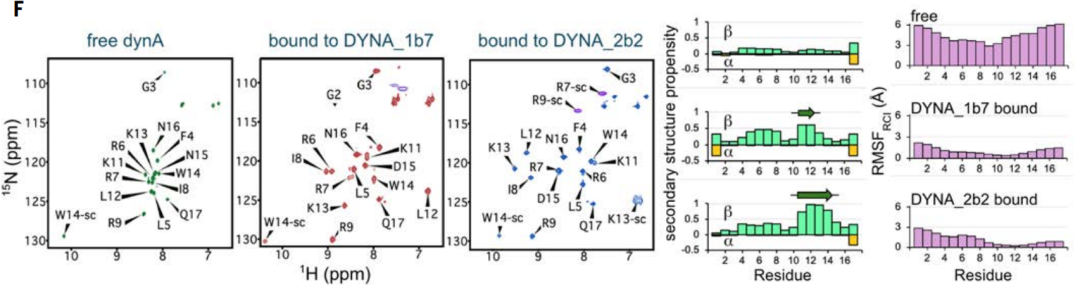
لتحقق من التغييرات في بنية الدينورفين أثناء الارتباط، تم الكشف عن أطياف الرنين المغناطيسي النووي (NMR) للدينورفين A المسمى بالنظير في المحلول عندما كان غير مرتبط، ومرتبطًا بـ DYNA_1b1، ومرتبطًا بـ DYNA_2b2 بتقارب أعلى.
ومن خلال نتائج الرنين المغناطيسي النووي، تبين أن الدينورفين أ الحر مضطرب بطبيعته، ولكن المناطق الموجودة في العمود الفقري المصمم تصبح منظمة عند الارتباط.بالنسبة لكلا المركبين المرتبطين، كشفت بيانات الرنين المغناطيسي النووي عن تشكيلات حالة مرتبطة ممتدة، متوافقة مع النموذج المصمم وتؤكد فعالية عمل الدينورفين في تحريض البروتينات والببتيدات غير المنظمة على تكوين تشكيلات غير أصلية.
لاستكشاف إمكانات تحسين لوجوس، اختار الباحثون رابطًا للدينورفين، DYNA_1b1، بثابت ارتباط (Kd) يقارب 1 نانومول. حسّن الباحثون التصاميم الأعلى تصنيفًا باستخدام تقنية انتشار الترددات الراديوية (RFdiffusion). من بين 48 تصميمًا، أظهر 45 تصميمًا ارتباطًا قويًا عند تركيز 5 نانومول عبر فحص BLI، مع ستة تصاميم أظهرت قيم Kd ≤ 100 بيكومول، كما تم قياسها بواسطة BLI. كشفت قياسات استقطاب الفلورسنت لاثنين من التصاميم المُحسّنة (DYNA_2b1 وDYNA_2b2) عن قيم Kd أقل من 60 بيكومول و100 بيكومول على التوالي، كما هو موضح في الشكل (ب) أدناه.
ملاحظة: Dynorphin هو ربيطة ببتيدية لمستقبلات كابا الأفيونية (KOR) مرتبطة بالألم المزمن.
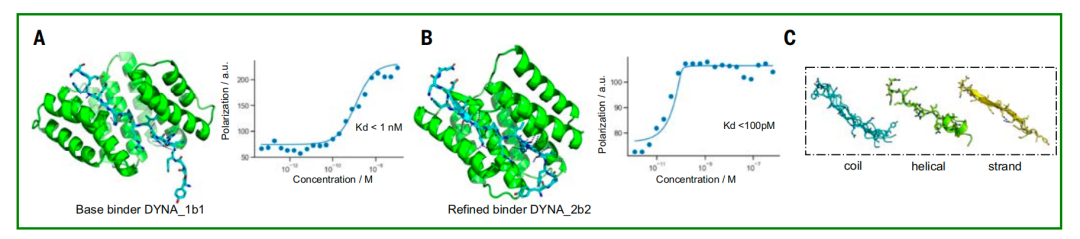
في التصاميم الأصلية والمُحسّنة للداينورفين أ، أظهر الببتيد تكوينات متعددة، بما في ذلك لفائف عشوائية، وهياكل جزئية لسلسلة بيتا، وهياكل جزئية لجزيئات ألفا الحلزونية، كما هو موضح في الشكل ج أعلاه. على الرغم من أن الداينورفين أ و ب يشتركان في تشابه تسلسلي مع 62%، إلا أن بروتينات الارتباط الخاصة بهما لا تتقاطع، وترتبط فقط بأهدافها الخاصة. في الوقت نفسه، يتوافق التركيب البلوري المشترك للبروتين المصمم DYNA_1b7 المرتبط بالداينورفين أ بشكل كبير مع نموذج التصميم الحسابي، وخاصةً عند واجهة الارتباط الأساسية (الأشكال د أعلاه). كما أكدت بيانات الرنين المغناطيسي النووي ذلك.يصبح الهيكل العظمي للدينورفين أ الذي كان مضطربًا في الأصل منظمًا بعد الارتباط بالبروتين المصمم، مما يؤكد مرة أخرى فعالية آلية الملاءمة المستحثة (الشكل F أعلاه).
التحقق من وظيفة وتقويم البروتينات الرابطة
استخدمت الدراسة نماذج الترسيب المناعي لمركبي WASH وPER. يتضمن مركب WASH البروتينات WASH، وFAM21، وCCDC53، وSWIP، وWASHC2. أظهرت الاختبارات أن FAM21_1b1 استخلص مركب WASH كاملاً من محاليل الخلايا.
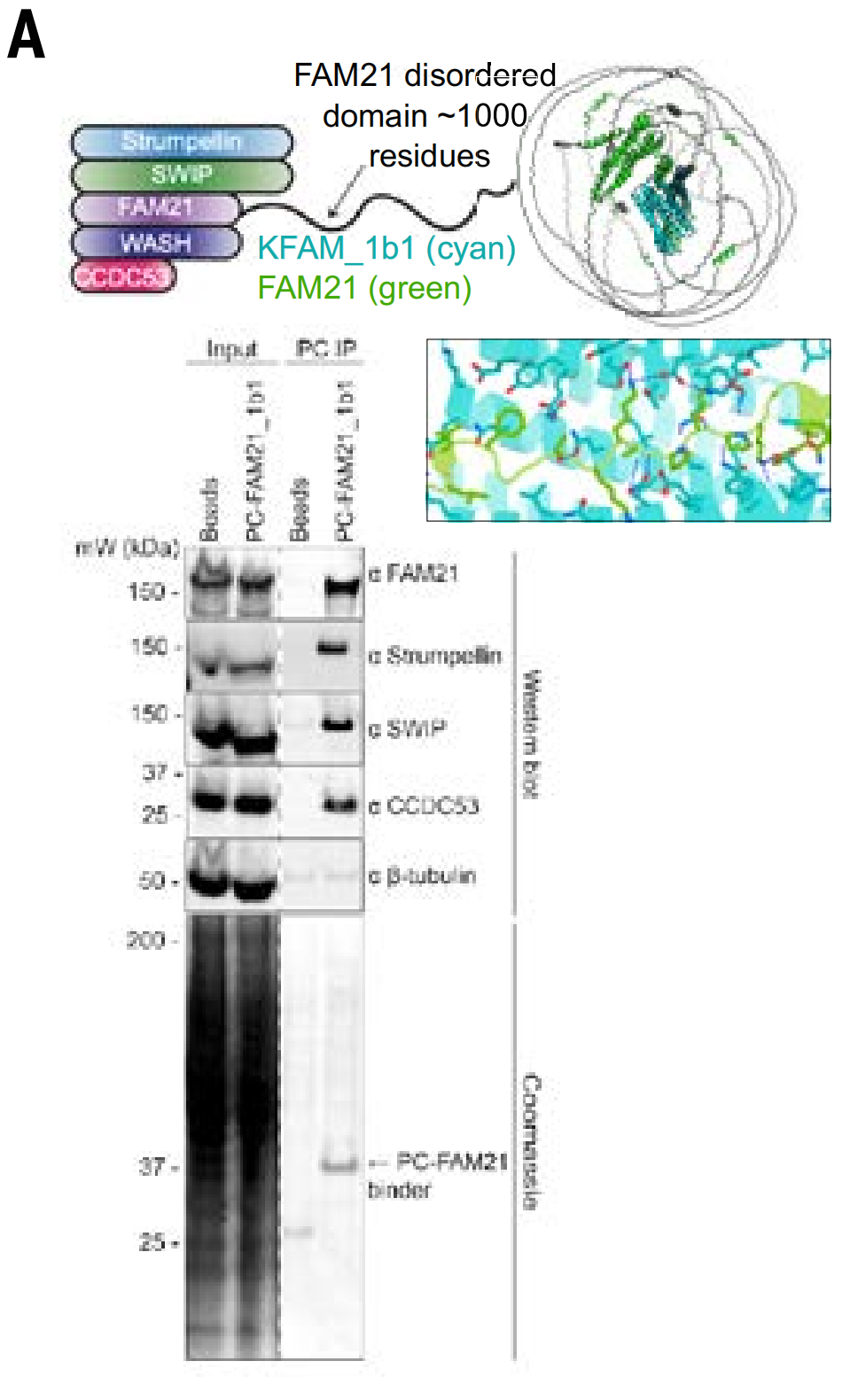
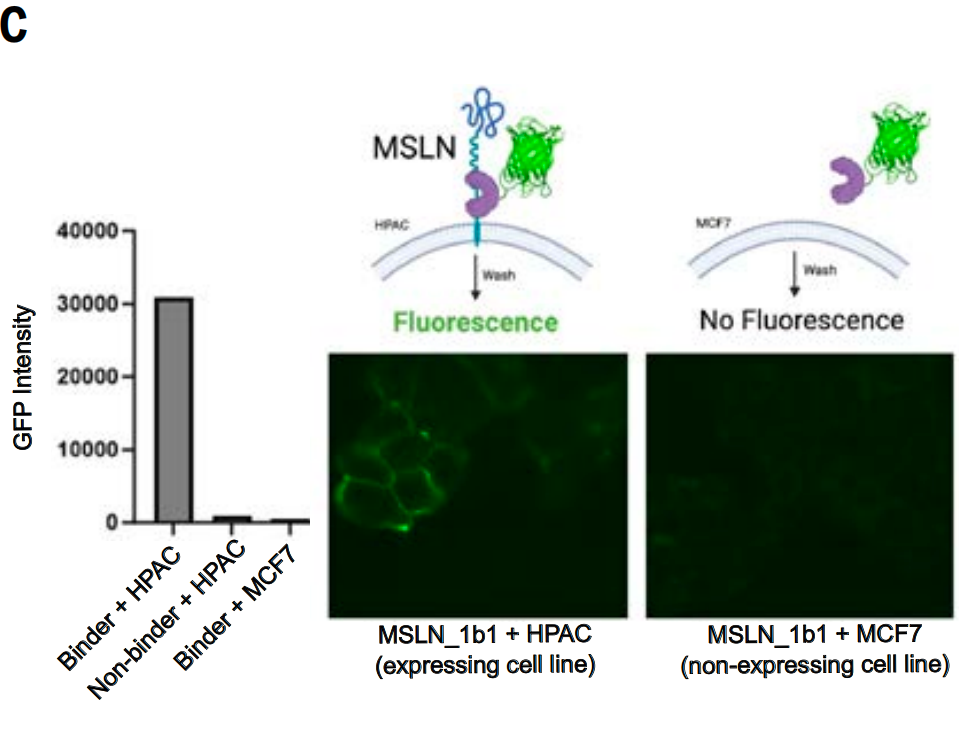
بالإضافة إلى ذلك، قاموا أيضًا بدراسة ما إذا كان البروتين الرابط (MSLN_1b1) المصمم لمنطقة الغشاء المجاور لـ MSLN يمكنه الارتباط بشكل خاص بالخلايا التي تعبر عن هذا الهدف (لأن انقسام البروتيناز في هذه المنطقة يجعل منطقة المجال خارج الخلية الأكثر بعدًا أقل ملاءمة كهدف).
ملاحظة: Mesothelin (MSLN) هو جليكوبروتين سطح الخلية الذي يتم تنظيمه بشكل تصاعدي في العديد من أنواع السرطان، وبالتالي فقد جذب الكثير من الاهتمام في العلاج المستهدف للأورام.
قام الباحثون بدمج البروتين الفلوري الأخضر (GFP) مع MSLN_1b1 وحضنوه مع الخلايا المعبرة عن MSLN (خط خلايا سرطان البنكرياس البشري HPAC) وخط الخلايا الذي لا يعبر عن MSLN (خط خلايا سرطان الثدي MCF7 التابع لمؤسسة سرطان ميشيغان)، مع تضمين بروتين اندماج GFP الذي لا يرتبط بـ MSLN كعنصر تحكم.
كشف الفحص المجهري الفلوري أن بروتين الاندماج GFP-MSLN_1b1 يتجمع عند الوصلات الخلوية في خلايا HPAC، بما يتوافق مع خصائص تموضع MSLN. لم تُلاحظ هذه الظاهرة في خلايا التحكم MCF7. علاوة على ذلك، لم يُظهر بروتين الارتباط الضابط أي إشارة ارتباط في خلايا HPAC، كما هو موضح في الشكل C أدناه. لذلك، يتعرف MSLN_1b1 بشكل خاص على MSLN ويرتبط به على سطح الخلية.
الذكاء الاصطناعي يفتح آفاقًا جديدة لاستهداف البروتين
حاليًا، يتزايد دور الذكاء الاصطناعي في أبحاث استهداف البروتينات، مما يدفع البحث إلى مرحلة جديدة من "التوازي متعدد التقنيات". بالإضافة إلى فريق ديفيد بيكر، حقق فريقا جورج م. بورسليم وأوفير شاليم في جامعة بنسلفانيا إنجازات ثورية في أبحاث استهداف البروتينات. اقترح هذا الفريق تقنية "تعديل البروتينات"، مستفيدًا بنجاح من نظام إنتين مقسم لتعديل تسلسل الأحماض الأمينية للبروتينات مباشرةً بعد تخليقها في خلايا الثدييات الحية. هذه هي المرة الأولى التي تُدمج فيها الأحماض الأمينية غير القياسية والعلامات الكيميائية (البيوتين والفلوروفورات) بدقة في البروتينات الذاتية. نُشرت نتائج البحث في مجلة "ساينس" تحت عنوان "تعديل البروتينات داخل الخلايا يُمكّن من دمج البقايا غير التقليدية في البروتينات الذاتية".
عنوان الورقة:
https://www.science.org/doi/10.1126/science.adr5499
علاوة على ذلك، طوّر فريق صيني ودولي بقيادة غاو كايشيا من معهد علم الوراثة وعلم الأحياء التنموي التابع للأكاديمية الصينية للعلوم، ولي قوه تيان من جامعة هواتشونغ الزراعية، بالاعتماد على عمل فريق ديفيد بيكر في تصميم البروتينات، AiCE، وهي طريقة هندسة بروتينات شاملة تعتمد على نماذج الطي العكسي. باستخدام هذه الاستراتيجية لتصميم البروتينات المدعومة بالذكاء الاصطناعي، نجح الفريق في تحسين ثماني فئات من البروتينات، بما في ذلك ديامينازات ونوكليازات، وطوّروا مُحرّر قواعد بروتينية مبتكرًا. نُشرت ورقة البحث، بعنوان "تطوير تطور البروتينات باستخدام نماذج الطي العكسي التي تدمج القيود الهيكلية والتطورية"، في مجلة Cell.
عنوان الورقة:
https://www.cell.com/cell/abstract/S0092-8674(25)00680-4
من تحرير الخلايا الحية إلى العلاجات العصبية الوقائية، ومن ابتكارات الجليكوزيل إلى تصميم السلاسل المتعددة المدعوم بالذكاء الاصطناعي، ومع التقدم المستمر للذكاء الاصطناعي في الطب الحيوي، تستخدم فرق بحثية حول العالم مناهج متنوعة بشكل غير مسبوق لمواجهة التحديات الطبية الحيوية الكامنة وراء البروتينات المضطربة طبيعيًا. سيُسهم استكشاف فريق البحث لاستهداف المناطق المضطربة طبيعيًا في ابتكار مناهج علاجية جديدة لأمراض مثل السرطان ومرض الزهايمر.
روابط مرجعية:








