Command Palette
Search for a command to run...
مكافحة مقاومة العلاج الكيميائي وعودة الورم! يستخدم فريق البحث بجامعة شاندونغ الذكاء الاصطناعي لبناء دفاع قوي ضد الخلايا الجذعية لسرطان الثدي

يعد سرطان الثدي القاتل الأول بين الأورام الخبيثة لدى النساء وكان دائمًا محط اهتمام المجتمع الطبي. في الوقت الحالي، يعد العلاج الكيميائي السام هو العلاج الجهازي الأكثر شيوعًا لمرضى سرطان الثدي. على الرغم من أنه يمكن أن يخفف الحالة إلى حد ما، إلا أن الخلايا السرطانية قد تتكرر أو تنتشر.
وقد أظهرت الدراسات السابقة أنتشكل الخلايا الجذعية لسرطان الثدي (BCSCs) مصدر مقاومة سرطان الثدي للعلاج الكيميائي والعلاج الإشعاعي. على الرغم من أن الخلايا الجذعية المكونة للدم لا تشكل سوى جزء صغير من خلايا سرطان الثدي، إلا أنها تمتلك إمكانات مذهلة للتكاثر غير المحدودة والقدرة على بدء الأورام. والأمر الأكثر إثارة للصدمة هو أن عملية العلاج الكيميائي نفسها قد تعزز أيضًا تحويل الخلايا غير BCSC إلى BCSC، مما يزيد من خطر تكرار الورم وانتشاره.
ومن الممكن ملاحظة أن الفهم العميق لآلية استجابة خلايا BCSC للعلاج الكيميائي مهم جدًا لتحسين تشخيص مرضى سرطان الثدي. من الناحية السريرية، هناك حاجة ماسة إلى طريقة يمكنها التعرف على خلايا BCSC وتثبيطها لتحسين خيارات العلاج الحالية.
وفي مواجهة هذا التحدي،وقد نجح كل من ليو هايكوان، وسون رونغ، وتشانغ كاي من جامعة شاندونغ، ومي تشي من جامعة شانشي الطبية، بالتعاون مع فرق البحث من شركة Helix Matrix وغيرها، في تحقيق تقدم كبير في هذا المجال. وباستخدام تكنولوجيا التعلم الآلي وبناءً على تحليل mRNA، نجح الباحثون في تطوير طريقة جديدة، وهي توقيع BCSC، لتقييم خصائص الخلايا الجذعية السرطانية في عينات من مرضى سرطان الثدي الأولي.لا تكشف هذه الدراسة عن الدور الأساسي لاستقلاب البوليامين في تنظيم الخلايا الجذعية السرطانية فحسب، بل تقدم أيضًا استراتيجيات واتجاهات جديدة للعلاج السريري لسرطان الثدي.
نُشرت الدراسة في المجلة العالمية المرموقة Advanced Science تحت عنوان "البناء متعدد الأمين يعزز إثراء الخلايا الجذعية لسرطان الثدي الناتج عن العلاج الكيميائي".
أبرز الأبحاث:
* قام الباحثون بتطوير توقيع BCSC يعتمد على mRNA باستخدام أساليب التعلم الآلي لتقييم الخلايا الجذعية السرطانية في عينات مرضى سرطان الثدي
* وجدت هذه الدراسة أن عملية بناء البوليامين تلعب دورًا رئيسيًا في تنظيم BCSC. يعمل العلاج الكيميائي على تعزيز إثراء BCSC من خلال تنشيط مسار بناء البوليامين الذي ينظمه HIF-1.
* اكتشفت هذه الدراسة مثبطًا جديدًا محددًا لـ HIF-1، وهو Britannin، والذي يمكنه تثبيط النشاط النسخي لـ HIF-1 الناجم عن العلاج الكيميائي، ومستويات استقلاب البوليامين، وإثراء BCSC بشكل فعال عند استخدامه معًا

عنوان الورقة:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202404853
استخدام مجموعات بيانات TCGA لبناء ارتباطات بين تحليل ارتباط بيرسون وخوارزميات التعلم الآلي
لتقييم خصائص الخلايا الجذعية كميًا لعينات مرضى سرطان الثدي الأولي من خلال مستويات التعبير الجيني،استخدمت الدراسة بيانات من اتحاد أطلس جينوم السرطان (TCGA) حول سرطان الثدي الغازي. تم استخدام مجموعة بيانات BRCA1 (BRCA2) لربط تعبير mRNA بمؤشر الخلايا الجذعية mRNA (mRNAsi) باستخدام خوارزمية التعلم الآلي الانحدار اللوجستي أحادي المتغير (OCLR)، وبالتالي تطوير توقيع BCSC يعتمد على mRNA.
كما أنشأت الدراسة منحنيات كابلان ماير استنادًا إلى مجموعة بيانات مكونة من 2032 مريضة بسرطان الثدي، والتي تم تصنيفها جزئيًا حسب التعبير عن BCSC P-Sig و N-Sig في الأورام الأولية، وجزئيًا بناءً على مجموعة بيانات مكونة من 1372 مريضة بسرطان الثدي تلقين العلاج الكيميائي.
على وجه التحديد، كما هو موضح في الشكل أ أدناه، حددت هذه الدراسة أولاً 81 جينًا بمعاملات ارتباط بيرسون r> 0.70 و91 جينًا بمعاملات ارتباط بيرسون r <-0.70، وعرفتها على أنها توقيع إيجابي لـ BCSC (P-Sig) وتوقيع سلبي (N-Sig)، على التوالي.
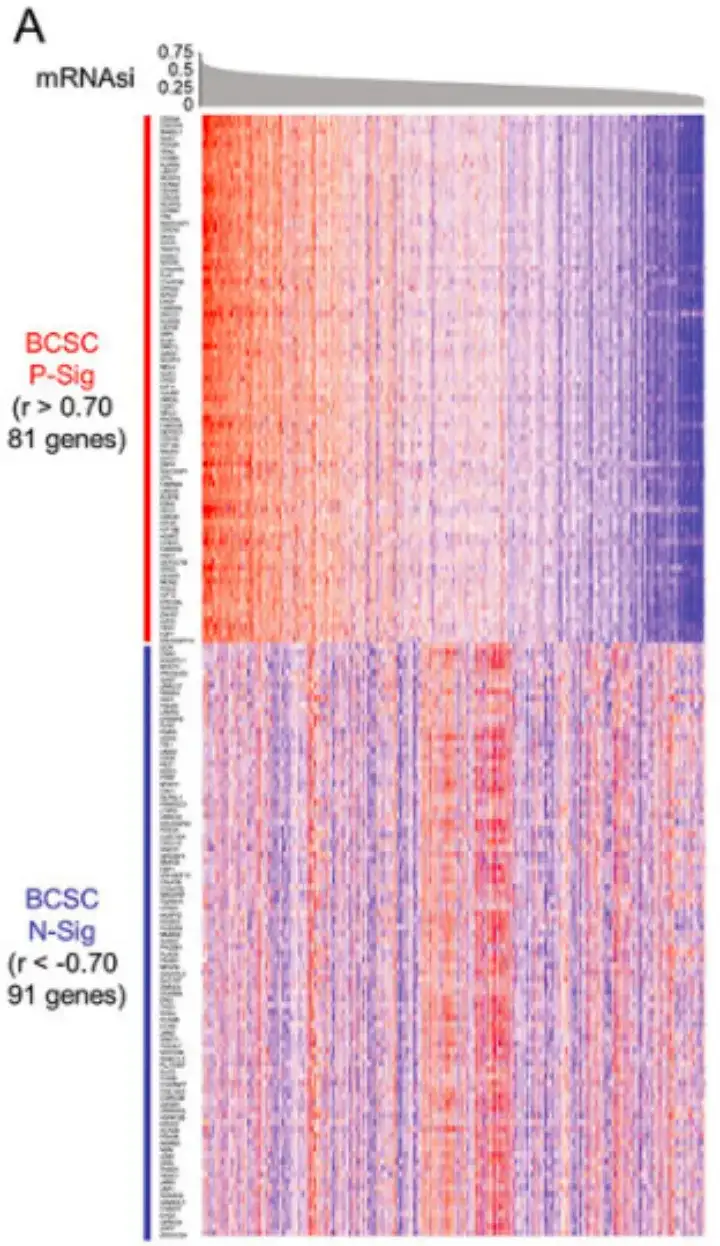
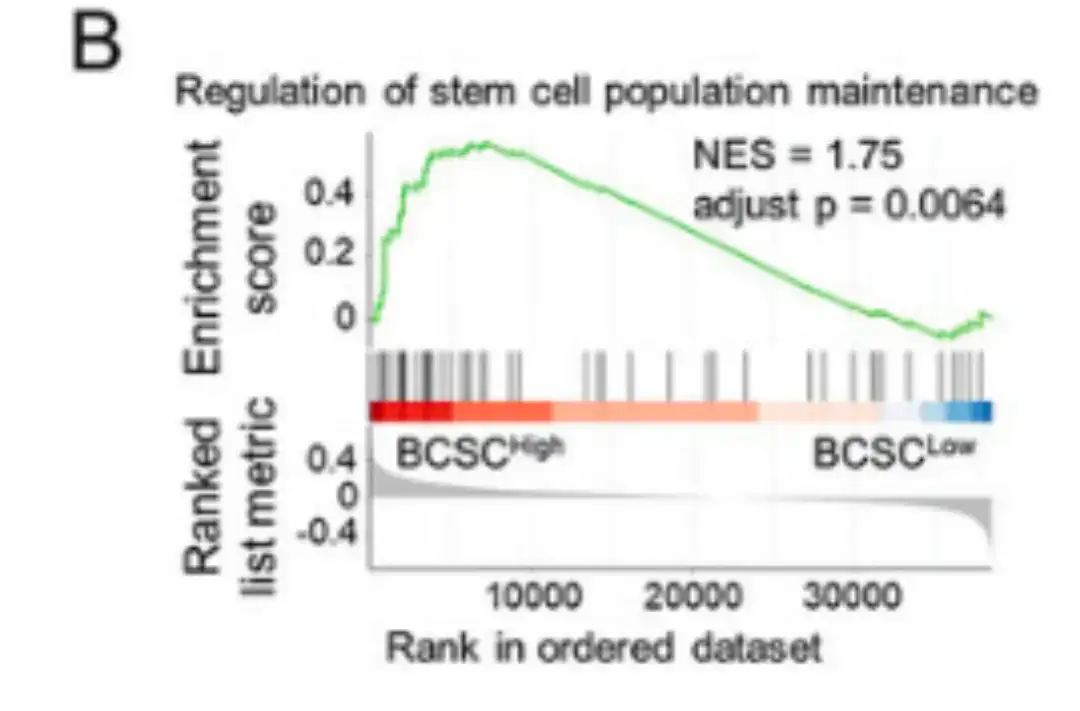
وبعد ذلك، كما هو موضح في الشكل ب أدناه، أجرت الدراسة تحليل إثراء مجموعة الجينات القائم على الترتيب (GSEA) من خلال مقارنة مجموعات البيانات BCSChigh وBCSClow وتقسيم المجموعات على أساس التعبير عن توقيع BCSC.
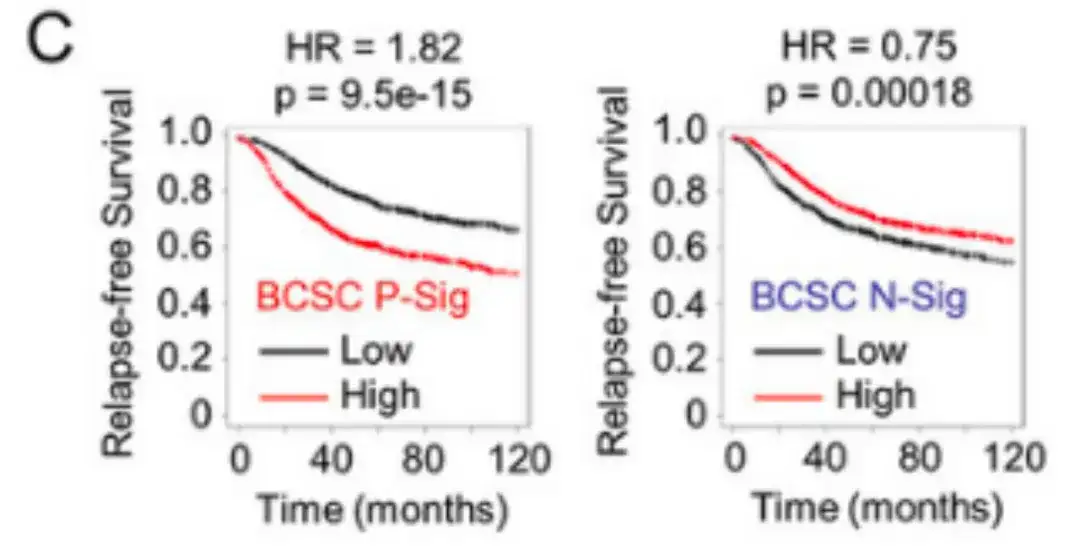
بعد تحليل الارتباط بين التعبير عن توقيع BCSC والبقاء على قيد الحياة الخالي من الانتكاس (RFS) في 2032 مريضًا، وجد الباحثون أن المرضى الذين لديهم التعبير عن BCSC P-Sig أعلى من المتوسط لديهم انخفاض كبير في RFS، في حين أن المرضى الذين لديهم التعبير عن BCSC N-Sig أعلى من المتوسط لديهم زيادة في RFS، كما هو موضح في الشكل C أدناه.
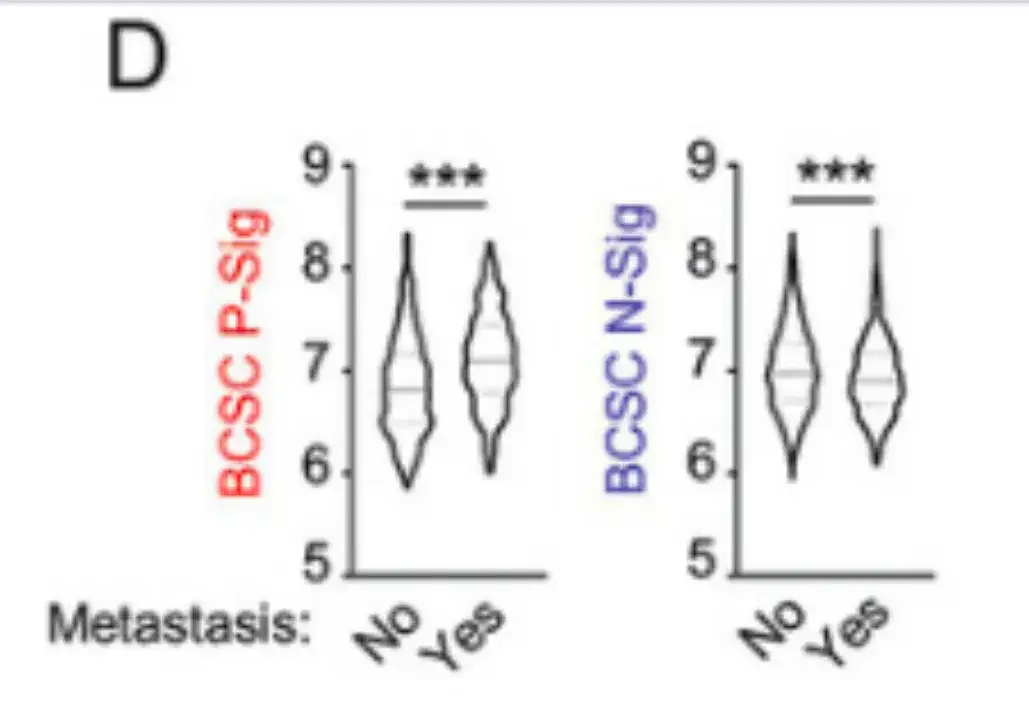
كما قامت الدراسة بتحليل البيانات من 1979 مريضة بسرطان الثدي في قاعدة بيانات التصنيف الجزيئي للاتحاد الدولي لسرطان الثدي (METABRIC).وتظهر النتائج في الشكل د أدناه. كان لدى المرضى الذين أصيبوا بالنقائل في غضون 5 سنوات تعبير أعلى عن BCSC P-Sig وتعبير أقل عن BCSC N-Sig في أورامهم الأولية مقارنة بالمرضى الذين لم يصابوا بالنقائل.
بالإضافة إلى ذلك، في الشكل E أدناه،وتحققت الدراسة أيضًا من خصائص الخلايا الجذعية السرطانية في العديد من خطوط خلايا سرطان الثدي.أظهرت خلايا سرطان الثدي المزروعة في وسط زراعة الماموسفير تعبيرًا أعلى عن BCSC P-Sig وتعبيرًا أقل عن BCSC N-Sig مقارنة بالخلايا المزروعة في أطباق زراعة الأنسجة البوليسترين القياسية.
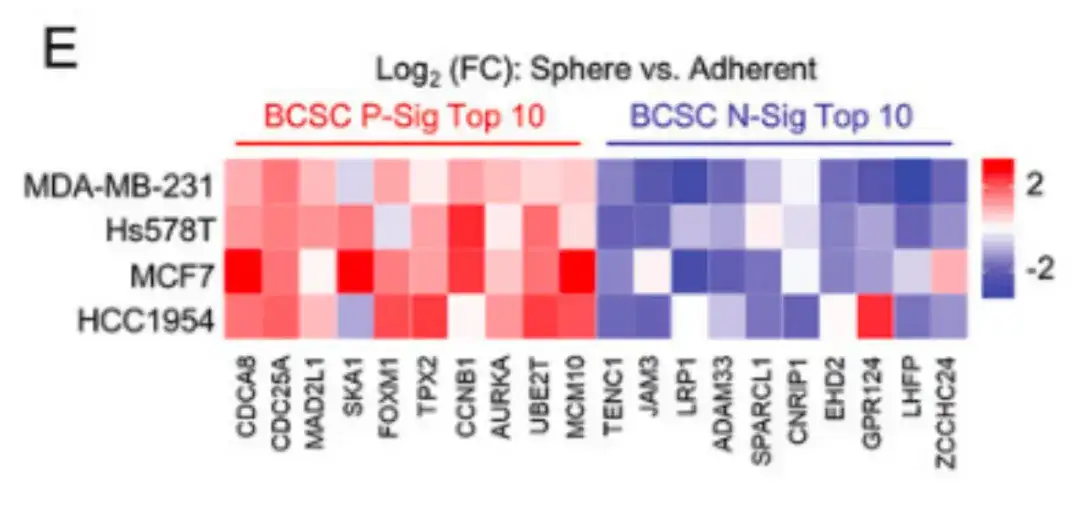
لتقييم كيفية تأثير أدوية العلاج الكيميائي على سكان BCSC،وتضمنت الدراسة حقن خلايا سرطان الثدي البشري، MDA-MB-231، في وسادة الدهون الثديية (MFP) لفئران أنثى تعاني من نقص المناعة المشترك الشديد (SCID) وعولجت الفئران بالباكليتاكسيل. كما هو موضح في الأشكال F وG وH، أدى عقار باكليتاكسيل إلى زيادة كبيرة في نسبة خلايا ALDH+ وعدد الخلايا المكونة للثدييات.
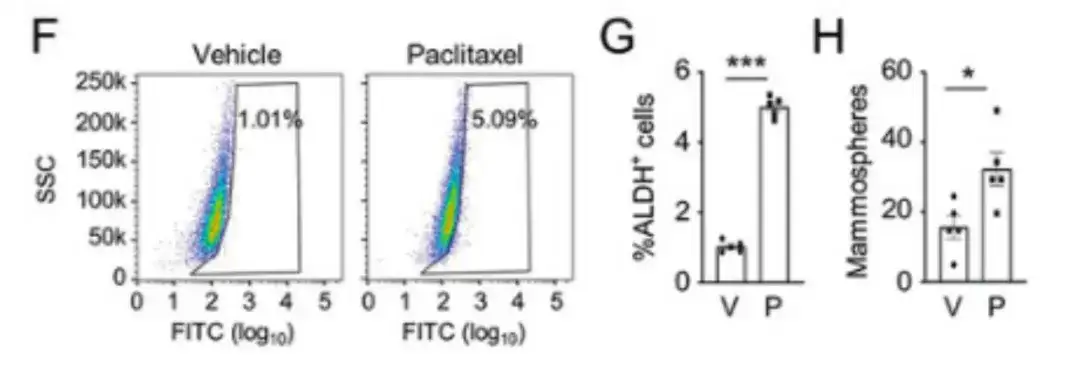
وفي الوقت نفسه، أظهر تحليل RNA-seq في الشكل الأول أدناه أن علاج باكليتاكسيل زاد من التعبير عن معظم جينات BCSC P-Sig وخفض من التعبير عن معظم جينات BCSC N-Sig.
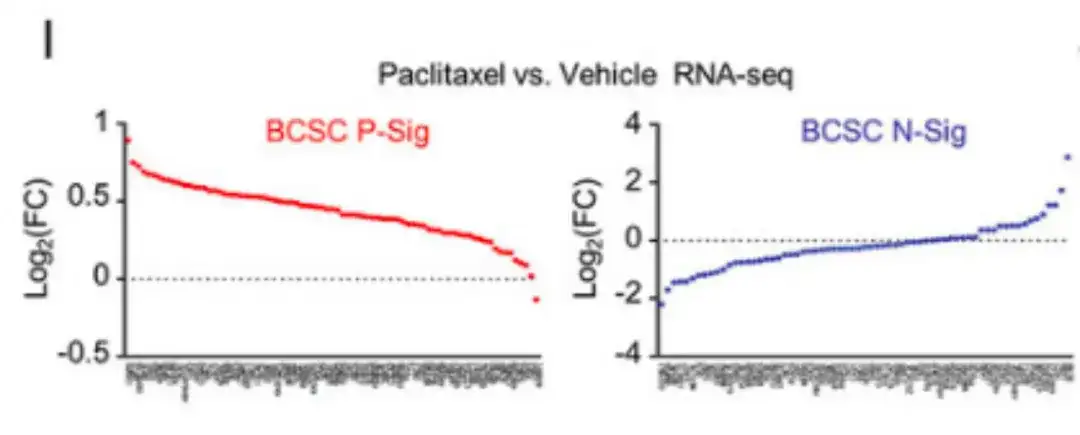
بالإضافة إلى عقار باكليتاكسيل، في الشكل J أدناه، عالجت الدراسة أيضًا خلايا سرطان الثدي باستخدام أدوية العلاج الكيميائي المعتمدة من إدارة الغذاء والدواء الأمريكية جيمسيتابين وكاربوبلاتين.وقد أدت هذه الأدوية إلى زيادة التعبير عن جين BCSC P-Sig وخفض التعبير عن جين BCSC N-Sig.وكما هو موضح في الشكل K أدناه، أظهرت العينات المأخوذة من مرضى METABRIC أيضًا أنه في المرضى الذين يتلقون العلاج الكيميائي المساعد، كان التعبير عن جين BCSC P-Sig في أنسجة الورم الأولية أعلى، بينما كان التعبير عن جين BCSC N-Sig أقل.
يرتبط استقلاب البوليامين بشكل إيجابي بإثراء BCSC، ويمكن لمثبط HIF-1 Britannin تقليل تخليق البوليامين والقضاء على BCSC
من أجل استكشاف آلية إثراء الخلايا الجذعية السرطانية المستحثة بالعلاج الكيميائي من منظور التمثيل الغذائي للخلايا،قامت هذه الدراسة بتقسيم 21 مريضًا في TCGA BRCA إلى مجموعتين BCSChigh وBCSClow بناءً على التعبير عن توقيعات BCSC، وقارنت مستويات 399 مستقلِبًا بين المجموعتين، كما هو موضح في الشكل أ أدناه.
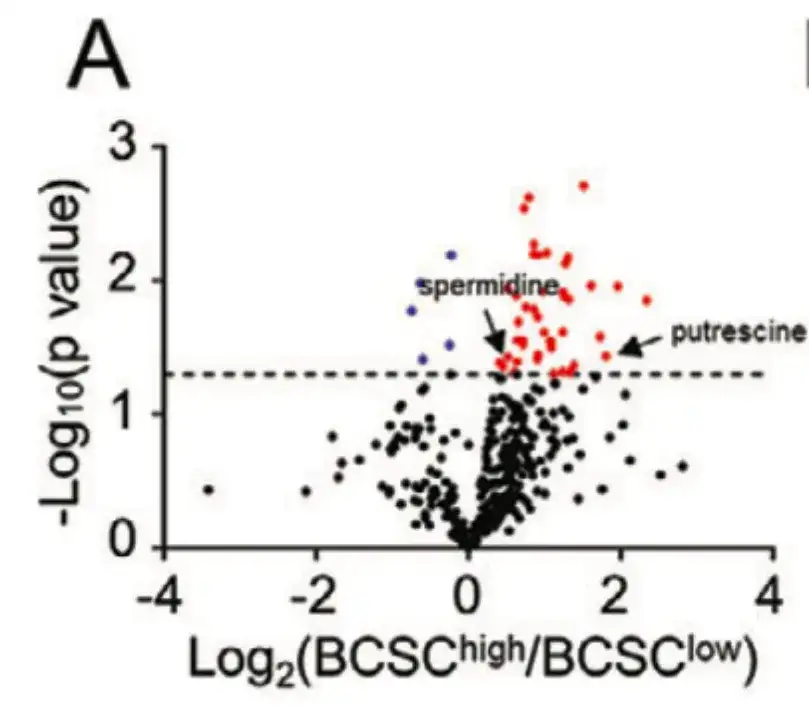
كما هو موضح في الشكل ب أدناه، أثبتت هذه الدراسة من خلال تحليل إثراء المسار الأيضي أن المستقلبات ذات مستويات مختلفة من الإثراء تشكلت في مسارات مرتبطة بعملية التمثيل الغذائي الابتنائي للبوليامين.
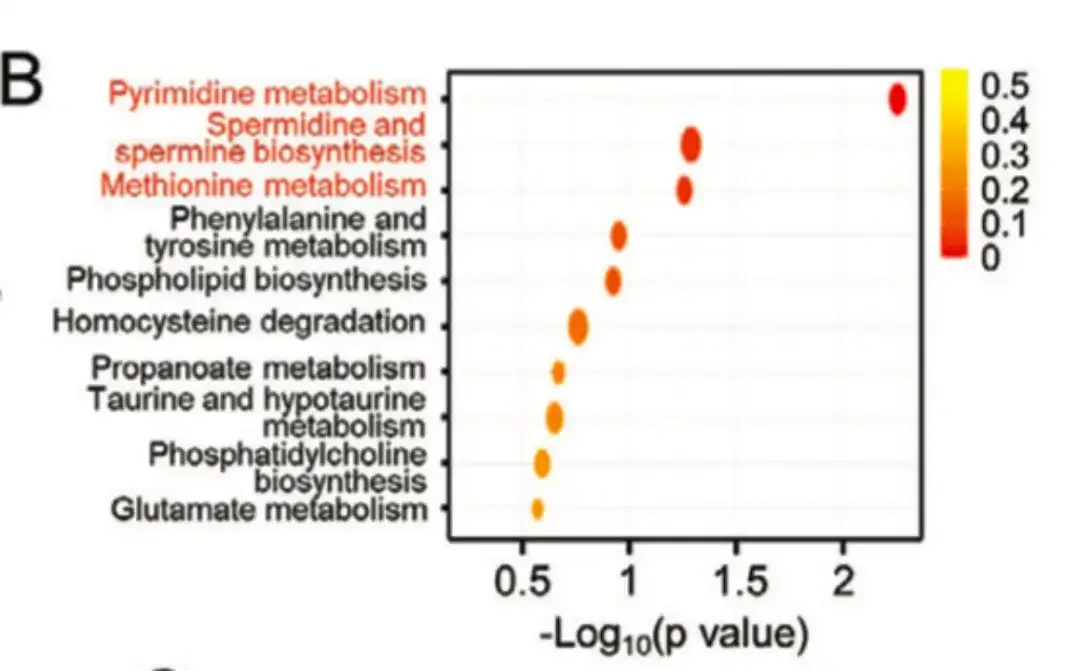
في الشكل التالي ج، د،وجدت الدراسة أن الإنزيمات الرئيسية لمسار تخليق البوليامين، مثل أورنيثين ديكاربوكسيلاز 1 (ODC1)، وسبيرميدين سينثاز البشري (SRM)، وسبيرمين سينثاز (SMS)، تم التعبير عنها بشكل أكبر في مجموعة BCSChigh مقارنة بمجموعة BCSClow.وكان التعبير في الثقافات الكروية المزروعة على خطوط خلايا سرطان الثدي غير الملتصقة أعلى من التعبير في الثقافات أحادية الطبقة، مما يشير إلى أن التخليق الحيوي للبولي أمين له دور مهم في تنظيم النمط الظاهري لخلايا سرطان الثدي. وفي الوقت نفسه، وكما هو موضح في الشكل E أدناه، أدى علاج الباكليتاكسيل إلى زيادة التعبير عن ODC1 وSRM في خطوط خلايا سرطان الثدي.
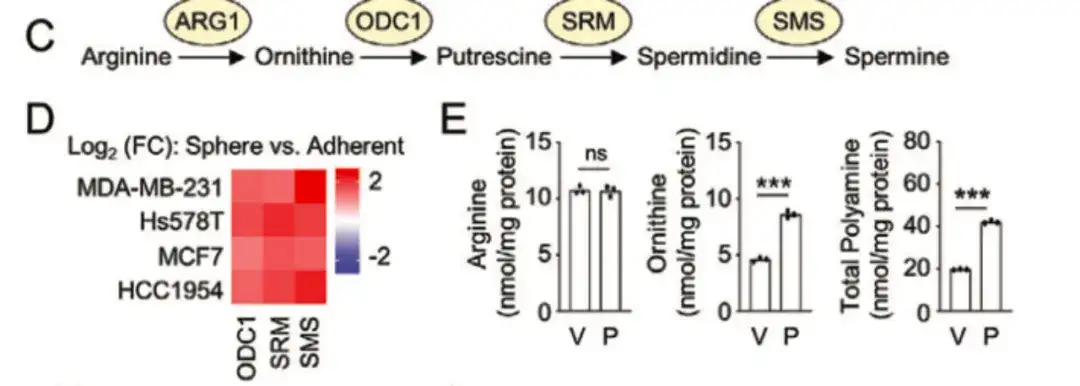
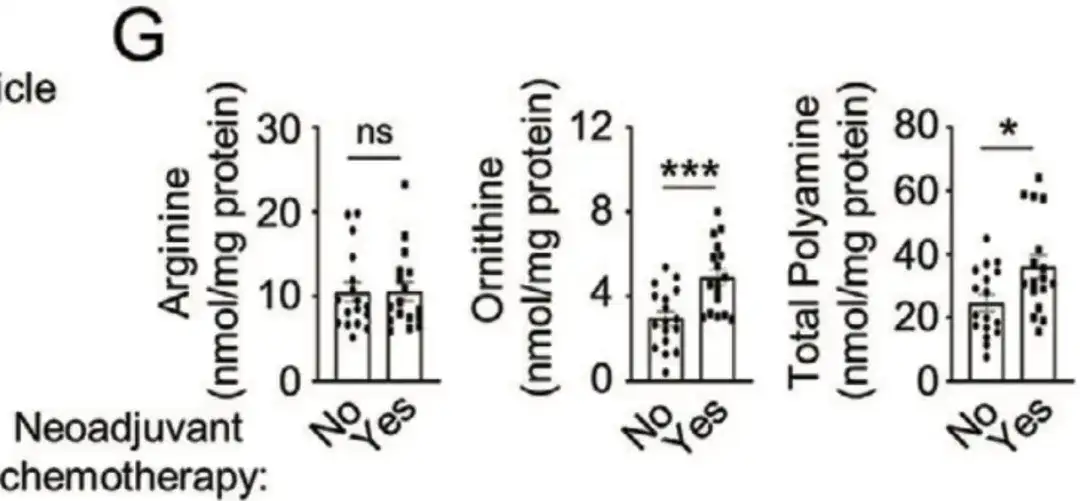
بالإضافة إلى ذلك، في الشكل G أدناه،كما جمعت الدراسة 34 عينة من مرضى سرطان الثدي غير الحساسين من مستشفى تشيلو بجامعة شاندونغ.وأظهر تحليل الخلايا أن المرضى الذين يتلقون العلاج الكيميائي المساعد لديهم مستويات مرتفعة بشكل ملحوظ من الأورنيثين والبوليامينات. تشير كل هذه الدراسات إلى أن تعزيز عملية بناء البوليامين يعزز إثراء الخلايا الجذعية السرطانية المستحثة بالعلاج الكيميائي.
من أجل تحليل الآلية الجزيئية التي يعمل بها العلاج الكيميائي على تعزيز عملية بناء البوليامين في سرطان الثدي، وجدت الدراسة أنأدى تثبيط عامل نقص الأكسجين القابل للتحريض (HIF-1α) إلى التخفيف من الزيادة التي يسببها الباكليتاكسيل في ALDH+ وتكوين الكرات.وقد أدى ذلك إلى انخفاض التعبير عن معظم جينات BCSC P-Sig وزيادة التعبير عن معظم جينات BCSC N-Sig، مما يشير إلى أن HIF-1 يلعب دورًا رئيسيًا في تنظيم إثراء BCSC المستحث بواسطة باكليتاكسيل، كما هو موضح في الشكل AC أدناه.
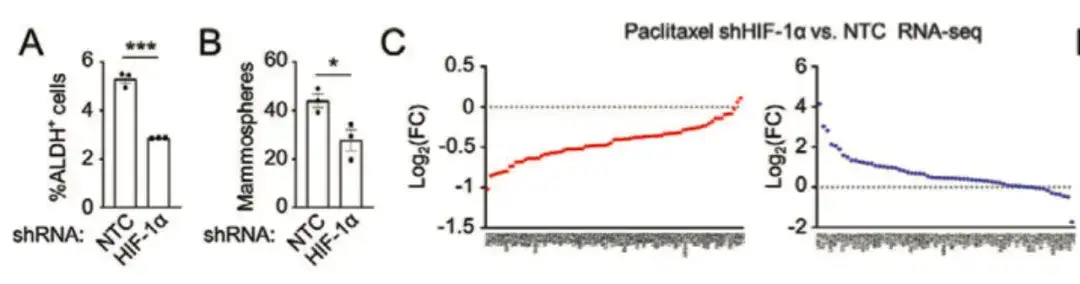
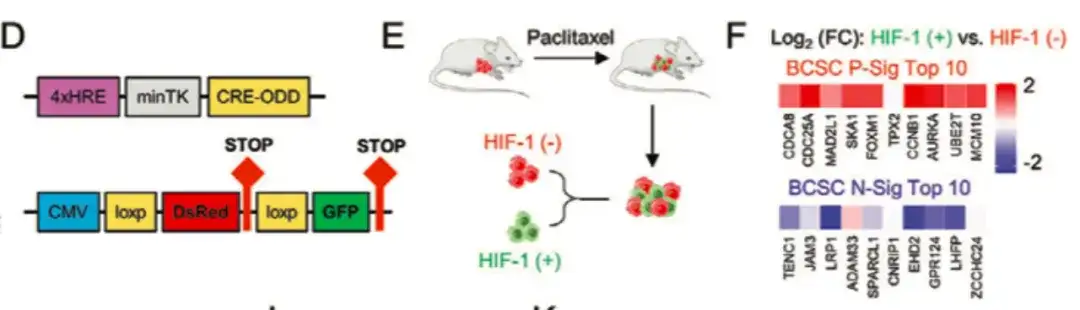
وللتحقق بشكل أعمق من دور HIF-1 في تنظيم النمط الظاهري لـ BCSC، كما هو موضح في الشكل DG أدناه، قامت الدراسة أيضًا بتحويل MDA-MB-231 باستخدام نظام تتبع التعبير الفلوري لـ HIF-1. من خلال جمع أنسجة الورم من الفئران المعالجة بالباكليتاكسيل، تم تقسيم الخلايا إلى مجموعات خلايا DsRed+/GFP− (HIF-1−) وGFP+ (HIF-1+).بالمقارنة مع مجموعة خلايا DsRed+/GFP−، فإن مجموعة خلايا GFP+ ذات التعبير العالي عن HIF-1 والنشاط النسخي أظهرت زيادة في التعبير عن جين BCSC P-Sig وانخفاض في التعبير عن جين BCSC N-Sig. وفي الوقت نفسه، كانت القدرة المسببة للورم لخلايا GFP+ أعلى بشكل ملحوظ من تلك الموجودة في المجموعة غير المعالجة أو خلايا DsRed+/GFP−.
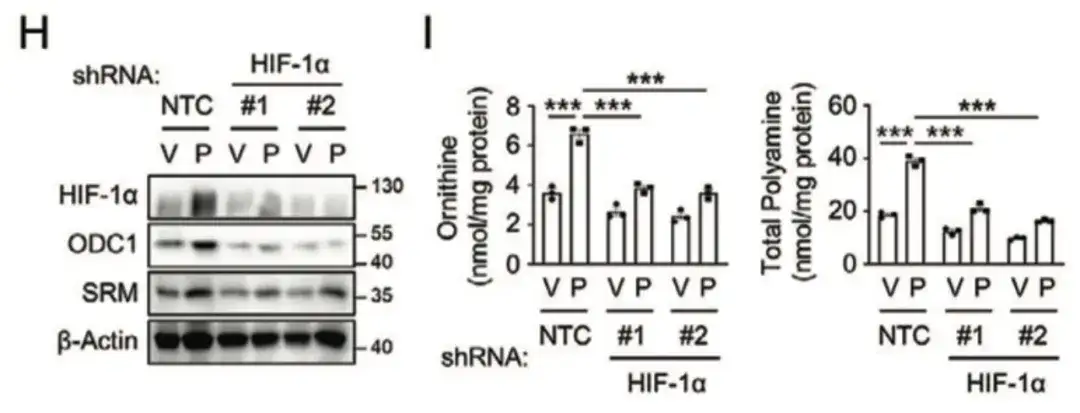
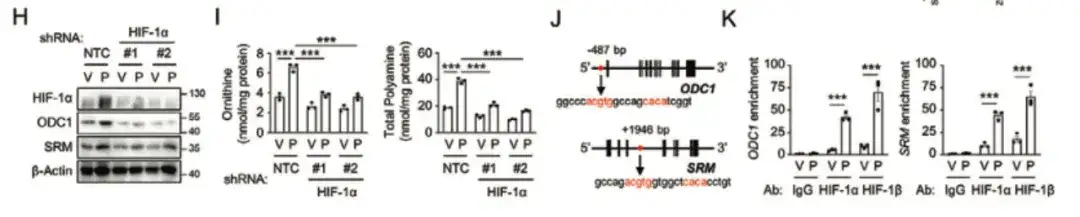
وفي الشكلين H وI أدناه، وجدت الدراسة أن تثبيط HIF-1α منع التعبير عن ODC1 وSRM المستحث بواسطة باكليتاكسيل، مما يشير إلى أن باكليتاكسيل يعزز عملية بناء البوليامين بطريقة تعتمد على HIF-1.
وأخيرا، وجدت الدراسة أن HIF-1 ينشط الجينات ODC1 وSRM من خلال النسخ، مما يعزز عملية بناء البوليامينات، مما يؤدي بدوره إلى إثراء الخلايا الجذعية المكونة للدم المستحثة بالعلاج الكيميائي، كما هو موضح في الشكل LQ أدناه.

كما هو موضح في الشكل أ أدناه، استخدمت هذه الدراسة نظام المراسل للنشاط النسخي HIF-1 لتحويل خلايا SUM159 وفحصت مثبطات HIF-1 الجديدة في مكتبة المنتجات الطبيعية التي تحتوي على 4320 مركبًا طبيعيًا. وتوصلت الدراسة إلى أننجح البريطانيتانين من Inula aucheriana في تثبيط النشاط النسخي لـ HIF-1 بشكل فعال بطريقة تعتمد على الجرعة. إن الاستخدام المشترك لبريتانين وباكليتاكسيل قد يمنع بشكل يعتمد على الجرعة الزيادة في مستويات الأرجينين والبوليامين داخل الخلايا الناجمة عن باكليتاكسيل.كما هو موضح في الشكل BF أدناه.
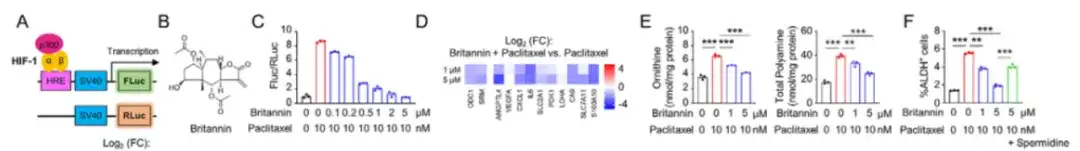
للتحقق من الآلية التي يثبط بها البريطانيتان النشاط النسخي لـ HIF-1، في الشكل HK أدناه، قامت الدراسة بتعديل خلايا MDA-MB-231 باستخدام نظام المراسل للنشاط النسخي لـ HIF-1.أظهرت النتائج أن البريطانيتانين يمكن أن يضعف نظام المراسل لنشاط HIF-1α TAD المستحث بواسطة باكليتاكسيل بطريقة تعتمد على الجرعة، وأن البريطانيتانين يمكن أن يثبط النشاط النسخي لـ HIF-1 عن طريق منع المنشط النسخي p300.
في الشكل LQ أدناه، قامت الدراسة بحقن 2×106 خلية MDA-MB-231 في فئران SCID وعولجت الفئران بالباكليتاكسيل وحده أو بالاشتراك مع بريتانين. وأظهرت النتائج أن العلاج المشترك يمكن أن يمنع بشكل كبير نمو الأورام الأولية دون التأثير على مظهر ووزن الفئران. وبالإضافة إلى ذلك، لم تظهر أي انتكاسة للورم لدى 3 من أصل 10 فئران بعد 100 يوم من توقف العلاج الدوائي.ويشير هذا إلى أن العلاج المشترك بالباكليتاكسيل والبريتانين في الفئران يمكن أن يقضي على الخلايا الجذعية المكونة للدم بشكل كامل.

يساعد الذكاء الاصطناعي في التشخيص المرضي، وقد يكون العلاج الموجه لـ HER2 هو الحل
في الوقت الحاضر، لا يعتمد تشخيص سرطان الثدي على نتائج التصوير فحسب، بل يلعب التشخيص المرضي أيضًا دورًا لا يمكن الاستغناء عنه. تشكل حالة التعبير عن HER2 (مستقبل عامل نمو البشرة البشري 2) اعتبارًا مهمًا في علاج سرطان الثدي. يمكن أن يساعد الذكاء الاصطناعي في تحديد مستوى التعبير عن HER2 في تحليل الأقسام المرضية وتوفير مرجع للعلاج المستهدف اللاحق.
رغم أن المبدأ يبدو بسيطا، إلا أنه ليس من السهل تحقيقه. على سبيل المثال، من أجل استخدام تقنية الذكاء الاصطناعي لتحسين دقة وتكرار تفسير HER2 في سرطان الثدي، هناك حاجة إلى الكثير من التدريب، ويجب تصحيح أخطاء نظام الذكاء الاصطناعي باستمرار ومقارنته بتشخيص الطاقم الطبي. وعلى هذا الأساس، ركز الباحثون على التمييز بين HER2 السلبي والإيجابي، مع التركيز على الذكاء الاصطناعي على الحد الأدنى لتعبير HER2، وبالتالي تقييم قيمة الذكاء الاصطناعي في تشخيص سرطانات الثدي المختلفة غير المتجانسة منخفضة التعبير عن HER2.
في الحقيقة،في وقت مبكر من عام 2022، نشر البروفيسور Lv Haiquan من جامعة شاندونغ مقالاً في مجلة Theranostics الطبية الحيوية، كشف فيه أن استهداف A2BR مع العلاج الكيميائي قد يمنع إثراء الخلايا الجذعية لسرطان الثدي ويحسن معدل بقاء مرضى سرطان الثدي بعد العلاج الكيميائي.
رابط الورقة:
https://www.thno.org/v12p2598.htm

هذه المرة، كشف البروفيسور لوف هايكوان مرة أخرى أن الاستخدام المشترك لبريتانين يمكن أن يمنع استقلاب البوليامين لـ HIF-1 ويقضي على BCSC، مما يوفر بلا شك فكرة جديدة لعلاج سرطان الثدي.في المستقبل، سوف تلعب الذكاء الاصطناعي دورًا مهمًا غير مسبوق في علاج سرطان الثدي، ويظهر تطبيقه في المجال الطبي والصحي إمكانات كبيرة بشكل متزايد. مع التقدم المستمر للتكنولوجيا والتطبيق المتعمق، سيصبح الذكاء الاصطناعي شريكًا لا غنى عنه في علاج سرطان الثدي وحتى السرطان، مما يجلب المزيد من القوة والأمل للمرضى.








