Command Palette
Search for a command to run...
نُشرت في مجلة الطبيعة! اقترحت جامعة وسط الصين العادية برنامج DigFrag، الذي يستخدم الذكاء الاصطناعي لتقسيم الأجزاء الجزيئية بدقة وتوليد 44 جزيئًا من الأدوية/المبيدات الحشرية

على مدى العقود القليلة الماضية، لعب اكتشاف الأدوية القائم على الشظايا (FBDD) دورًا مهمًا في أبحاث وتطوير الأدوية الجديدة من خلال تحديد شظايا الجزيئات الصغيرة التي لها تفاعلات ضعيفة مع البروتينات المستهدفة وتحسين المعلومات البنيوية لهذه الشظايا لتطوير مركبات الرصاص الأكثر نشاطًا.
على الرغم من أن FBDD يلعب دورًا رئيسيًا في اكتشاف الأدوية وتطويرها، إلا أن إنشاء وفحص مكتبات الأجزاء الجزيئية الفعالة كان دائمًا تحديًا كبيرًا في هذا المجال. تعتمد طرق FBDD التقليدية على الحدس التجريبي، مما يحد من قدرتها على تطوير هياكل متنوعة. ولحسن الحظ، فإن ظهور الذكاء الاصطناعي يوفر حلاً تحويليًا لهذا التحدي.
في الآونة الأخيرة، قام فريق البروفيسور يانغ جوانجفو والأستاذ المساعد وانغ فان من جامعة وسط الصين العادية بتطوير طريقة تقسيم رقمية تسمى DigFrag.تركز الطريقة محليًا على الرسم البياني الجزيئي، وتسلط الضوء على البنى الفرعية الرئيسية، وتقسم هذه البنى الفرعية إلى أجزاء. تظهر النتائج التجريبية أن الأجزاء المقسمة بواسطة DigFrag تتميز بتنوع هيكلي أعلى، وأن المركبات الناتجة على أساس هذه الأجزاء تتوافق بشكل أكبر مع الخصائص الكيميائية المتوقعة. ويشير هذا إلى أن البيانات التي تم إنشاؤها باستخدام أساليب الذكاء الاصطناعي قد تكون أكثر ملاءمة لتدريب نماذج الذكاء الاصطناعي وتطبيقها.
نُشر البحث، الذي يحمل عنوان "DigFrag كطريقة تجزئة رقمية تستخدم لتصميم الأدوية القائمة على الذكاء الاصطناعي"، في المجلة الأكاديمية الدولية Nature Communications Chemistry.
أبرز الأبحاث:
* وجدت الدراسة أنه عندما يتم دمج الأجزاء المستندة إلى DigFrag مع نماذج الذكاء الاصطناعي، فإنها يمكن أن تولد جزيئات ذات خصائص مرغوبة بشكل فعال
* من خلال الفحص الدقيق، حددت الدراسة في النهاية 24 جزيئًا من الأدوية و20 جزيئًا من المبيدات الحشرية
* قام الفريق بتطوير منصة سهلة الاستخدام، MolFrag، والتي تدمج تقنيات التجزئة المتعددة لدعم مجموعة أوسع من أعمال التحليل والتصميم الجزيئي
عنوان الورقة:
https://doi.org/10.1038/s42004-024-01346-5
يجمع المشروع المفتوح المصدر "awesome-ai4s" أكثر من مائة تفسير ورقي لـ AI4S ويوفر مجموعات وأدوات ضخمة من البيانات:
https://github.com/hyperai/awesome-ai4s
مجموعة البيانات: قاعدة بيانات PADFrag التي تم إنشاؤها ذاتيًا، والتي تحتوي على ما يقرب من 3000 نوع من بيانات الأدوية
تأتي مجموعة البيانات النموذجية المستخدمة في هذه الدراسة بشكل أساسي من قاعدة البيانات PADFrag التي تم إنشاؤها ذاتيًا. على وجه التحديد، تتضمن قاعدة بيانات PADFrag بشكل أساسي كتالوج الأدوية المعتمدة من قبل إدارة الغذاء والدواء في قاعدة بيانات DrugBank، والتي تضم 1652 دواءً، والمبيدات الحشرية التجارية المدرجة بواسطة آلان وود، والتي يبلغ مجموعها 1259.
*PADFrag، قاعدة بيانات تم إنشاؤها لاستكشاف مساحة الأجزاء النشطة بيولوجيًا لاكتشاف الأدوية
https://pubs.acs.org/doi/10.1021/acs.jcim.8b00285
ولضمان اتساق البيانات وموثوقيتها، استبعد فريق البحث المركبات ذات البنية غير القياسية. وبعد ذلك، تم تقسيم مجموعة البيانات بالكامل إلى مجموعة تدريب ومجموعة تحقق ومجموعة اختبار بنسبة 8:1:1 لتسهيل تدريب النموذج وتقييمه واختباره.
DigFrag: سير عمل مكون من ثلاث خطوات للحصول على أجزاء ذات تنوع هيكلي أكبر
DigFrag هي طريقة تقسيم رقمية مبتكرة تستخدم آلية انتباه الرسم البياني لتحديد وتقسيم أجزاء الأدوية/المبيدات الحشرية. ميزتها الأساسية هي أنها يمكن أن تحصل على أجزاء ذات تنوع هيكلي أعلى من منظور الذكاء الآلي بدلاً من الاعتماد فقط على الخبرة البشرية.
بالإضافة إلى ذلك، قامت الدراسة بدمج الأجزاء المقسمة بأربع طرق، BRICS، وRECAP، وMacFrag، وDigFrag، ودمجها في إطار نموذج DeepFMPO لتوليد جزيئات الدواء وتقييم أدائها على مؤشرات مختلفة.
وأخيرًا، استنادًا إلى تقنيات التجزئة الجزيئية المتعددة، قام الباحثون بتطوير منصة سهلة الاستخدام MolFrag لدعم أعمال التجزئة الجزيئية.
وعلى وجه التحديد، ينقسم سير العمل في هذه الدراسة إلى ثلاثة أجزاء:
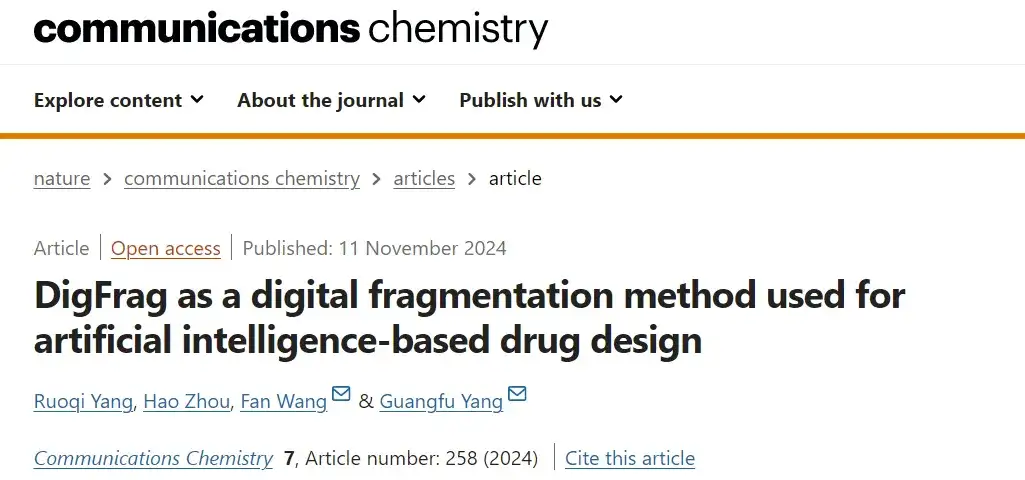
أولاً، نهج التجزئة المبني على الذكاء الاصطناعي:تعتمد هذه الدراسة على بنية الشبكة العصبية الرسومية (GNN) وتستخدم طريقة DigFrag لتفتيت الجزيئات.
وكما هو موضح في الشكل أ أعلاه، قام الباحثون بتعريف الرسم البياني الجزيئي على أنه G=(V, E)، حيث يمثل V العقد، المقابلة للذرات في الجزيء، ويمثل E الحواف المتصلة، المقابلة للروابط الكيميائية بين الذرات. في هذه العملية، استنادًا إلى شبكة استخراج الميزات (مصفوفة الميزات) لآلية انتباه الرسم البياني، يتم إدخال الرسم البياني الجزيئي الأصلي أولاً في سلسلة من طبقات الانتباه للحصول على تمثيل تضمين منفصل لكل ذرة. يتم بعد ذلك تجميع هذه التضمينات الذرية لتشكيل متجه موحد، يُسمى أيضًا بالعقدة الفائقة. أخيرًا، من خلال معالجة طبقة الانتباه الإضافية، يتم الحصول على التمثيل المضمن للجزء بأكمله.
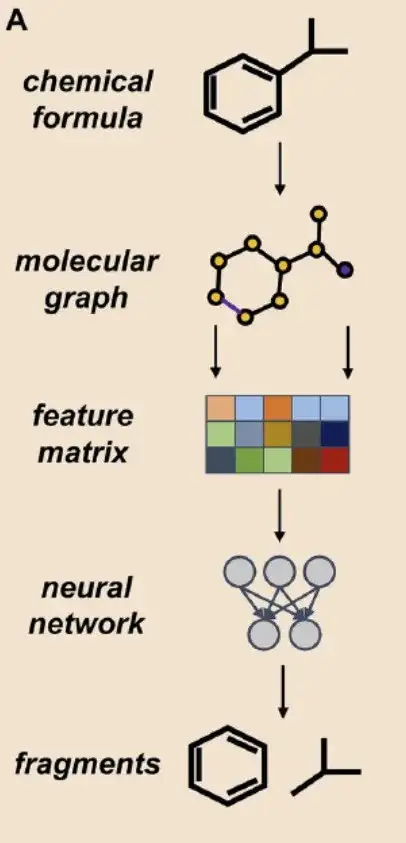
ثانيًا، إطار نموذج الممثل والناقدكما هو موضح في الشكل ب أدناه، من أجل توضيح تأثير التجزئة الرقمية على نماذج التوليد العميقة القائمة على الأجزاء، قام الباحثون بدمج الأجزاء المجزأة بأربع طرق: BRICS، وRECAP، وMacFrag، وDigFrag، واستخدموا أداة توليد الجزيئات ثنائية الأبعاد القائمة على الأجزاء مفتوحة المصدر DeepFMPO للبحث.
*DeepFMPO هو نموذج تعزيز التعلم الفاعل-الناقد والذي يحصل على المركب المطلوب عن طريق استبدال الأجزاء في المركب.
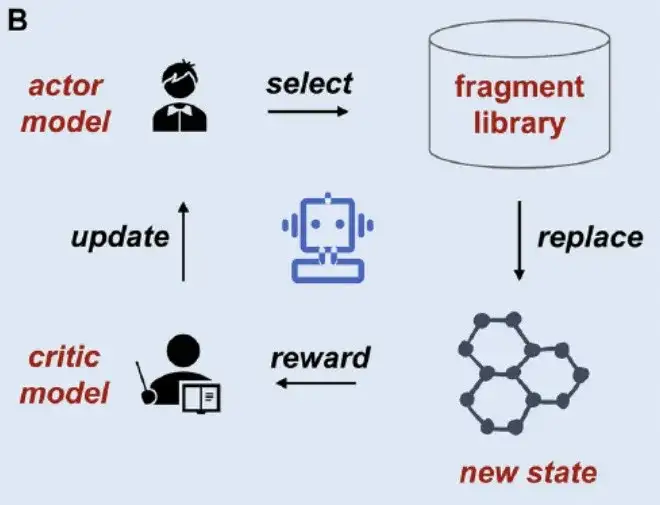
ثالثا، إنشاء منصة على الإنترنت:على الرغم من تطوير مجموعة متنوعة من طرق التفتيت الجزيئي، إلا أن هناك نقصًا في الخوادم عبر الإنترنت سهلة الاستخدام. لذلك، وكما هو موضح في الشكل ج أعلاه، طورت هذه الدراسة منصة سهلة الاستخدام MolFrag تعتمد على تقنيات التجزئة المختلفة. تجمع المنصة بسلاسة بين أربع طرق للتجزئة الجزيئية: BRICS، وRECAP، وMacFrag، وDigFrag، مما يضمن أن الباحثين من مختلف مستويات الخبرة يمكنهم استخدامها.
عنوان منصة MolFrag:
https://dpai.ccnu.edu.cn/MolFrag
نتائج البحث: تتمتع الأجزاء الجزيئية المجزأة من DigFrag بتنوع أعلى
تحتوي شظايا DigFrag على عدد كبير من الروابط القابلة للدوران
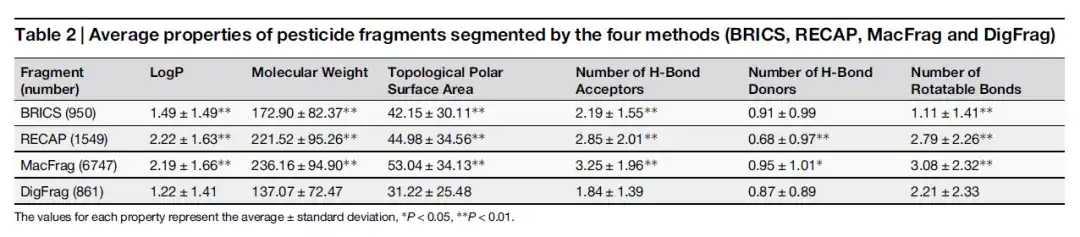
قامت الدراسة في البداية بتدريب النموذج على تقسيم أجزاء الأدوية والمبيدات الحشرية بدقة. بعد ذلك، أجرى الباحثون مقارنة معمقة لمؤشرات الأداء الرئيسية الثلاثة لـ DigFrag، وهي دقة النموذج، والمساحة تحت المنحنى (AUC)، ومعامل ارتباط ماثيوز (MCC) للأجزاء التي تم الحصول عليها باستخدام الطرق التقليدية (RECAP، BRICS) والطرق الحديثة (MacFrag) من خلال التحقق المتبادل الخماسي. كما هو موضح في الجدول أدناه، فإن توزيع خصائص شظايا الدواء أكثر تشابهًا بين الشظايا المقسمة بواسطة DigFrag وتلك المقسمة بواسطة BRICS.
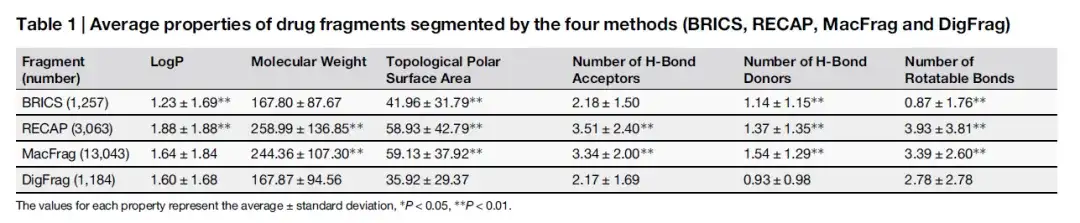
كما هو موضح في الجدول أدناه، على الرغم من أن الوزن الجزيئي وعدد مستقبلات الرابطة الهيدروجينية لشظايا الدواء التي يقسمها DigFrag مماثلة لتلك التي يقسمها BRICS، فإن عدد الروابط الدوارة أكبر، وقد يكون ذلك مرتبطًا بطريقة كسر بنية الحلقة الفريدة الخاصة بها. فيما يتعلق بشظايا المبيدات، فإن الوزن الجزيئي المتوسط للأجزاء المقسمة بواسطة DigFrag أقل.
تتمتع شظايا DigFrag المجزأة بتنوع هيكلي أعلى
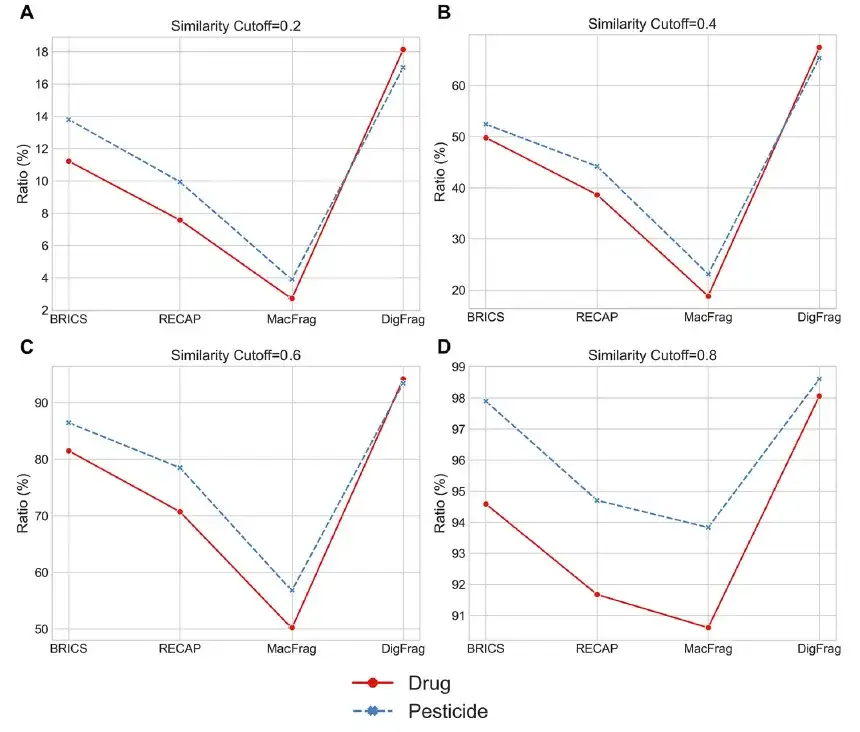
ركزت الدراسة على تقييم التنوع البنيوي للقطع المجزأة مع مقارنة طريقة DigFrag بالطرق التقليدية (RECAP و BRICS) وطريقة حديثة (MacFrag). وأظهرت النتائج أن القطع المجزأة بواسطة DigFrag في الأدوية والمبيدات الحشرية كان معدل تكرارها أقل من الطرق الثلاث الأخرى، والتي كانت 9.97%-21.37% و8.94%-15.20%، على التوالي، مما يشير إلى أنها يمكن أن تولد قطعًا فريدة. يغطي كتاب MacFrag معظم أجزاء BRICS وRECAP، مما يشير إلى أنه ليس مبتكرًا تمامًا بل هو امتداد للنهج التقليدية.

كما استخدم الباحثون أيضًا خوارزمية t-SNE لتوضيح توزيع الفضاء الكيميائي. كما هو موضح في الشكل أدناه، يعمل DigFrag بشكل جيد من حيث نسبة تجميع الأجزاء، وخاصة عندما تكون عتبات التشابه عند 0.4 و0.6، مما يدل على تنوع هيكلي أعلى.
تنتج النماذج القائمة على DigFrag جزيئات ذات جودة أعلى
على منصة MOSES المعيارية، قامت هذه الدراسة بمقارنة أداء النماذج التوليدية المختلفة. كما هو موضح في الجدولين أدناه، حقق النموذج القائم على DigFrag درجة مرشحات قدرها 0.828، مما يدل على مستوى أعلى من الأمان، والذي يمكن أن يعزى إلى الاعتبار الشامل للسمية والاستقرار في عملية تجزئة التعلم العميق.
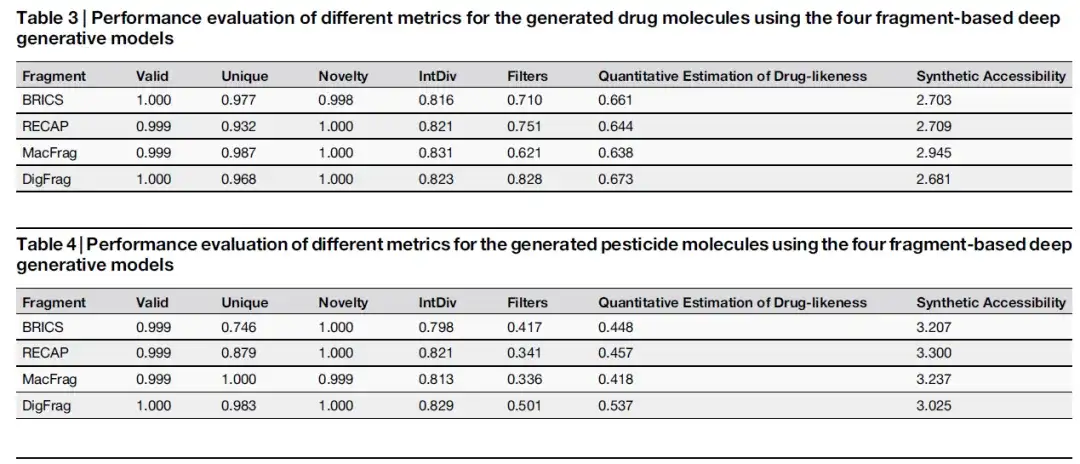
كما هو موضح في الشكل أدناه، من حيث جزيئات المبيدات، فإن الأجزاء الجزيئية التي تم إنشاؤها بواسطة النموذج القائم على DigFrag حققت أداءً جيدًا من حيث صحة SMILES، والجديد، وتنوع الهيكل، وتنبيهات البنية. بالإضافة إلى ذلك، تفوقت أجزاء الجزيئات الدوائية والمبيدات الحشرية التي تم إنشاؤها بواسطة نموذج DigFrag على النماذج الأخرى في تحليل القيمة المتوسطة للتقدير الكمي (QED) وإمكانية الوصول الاصطناعي (SA).
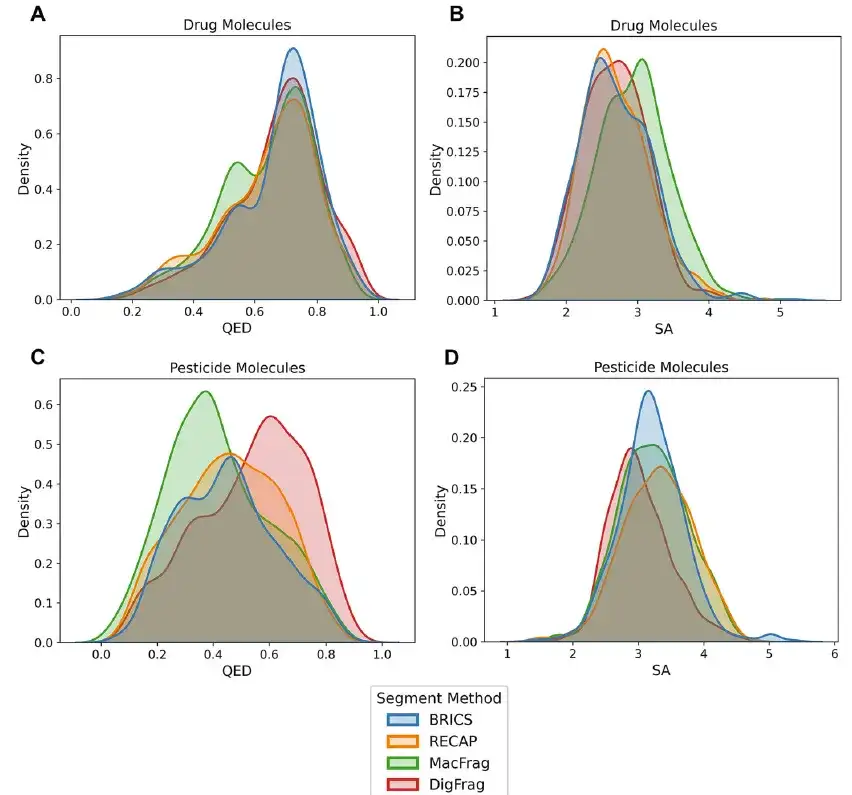
بالإضافة إلى ذلك، فإن الأجزاء الجزيئية التي تم تقسيمها بواسطة DigFrag لها أعلى مستوى من التشابه مع مجموعة بيانات MOSES من حيث الوزن الجزيئي وتوزيع خصائص QED وSA. وتشير هذه النتائج إلى أن نموذج DigFrag قادر على إنتاج جزيئات ذات جودة أعلى، مع التأكيد على تفضيل نموذج الذكاء الاصطناعي للبيانات المستمدة من الذكاء الاصطناعي في التصميم الجزيئي، مما يسلط الضوء على مزايا تطبيق تقنية الذكاء الاصطناعي في هذا المجال.
تم اختيار 44 جزيئًا من الأدوية والمبيدات الحشرية عالية الكفاءة ومنخفضة الطاقة
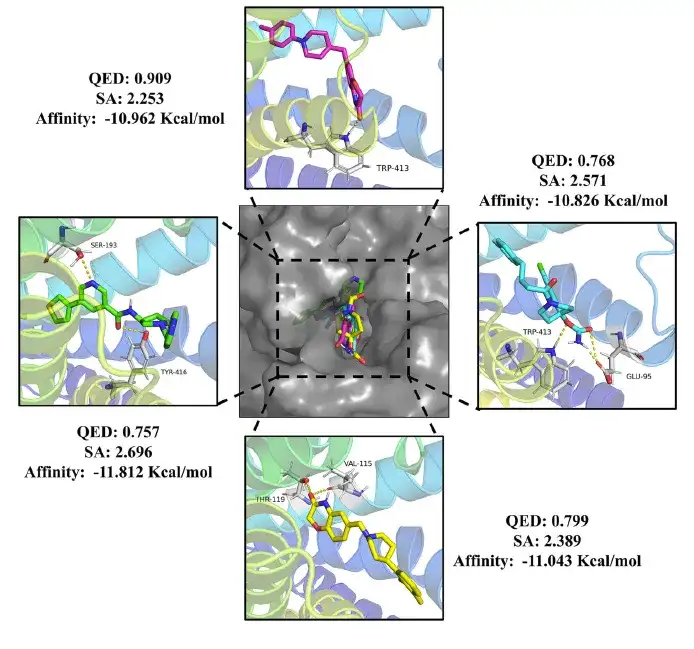
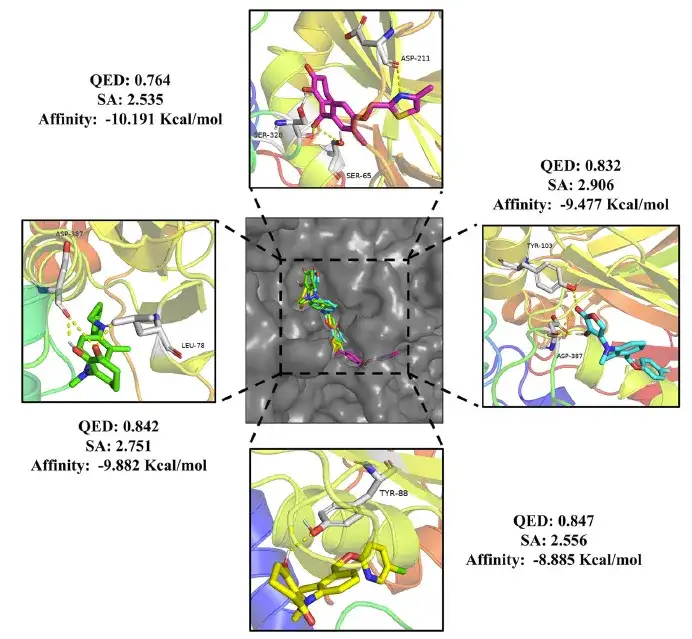
وأخيرًا، بعد الفحص الدقيق، حددت الدراسة 24 جزيئًا دوائيًا و20 جزيئًا مبيدًا، وكلها استوفت معايير قيم QED أكبر من 0.75، وقيم SA أقل من 3، والطاقة الحرة الملزمة أقل من دومبيريدون (-10.7 كيلو كالوري/مول) والميثوتريازين (-8.4 كيلو كالوري/مول).
وتناولت الدراسة تحليلًا أعمق لتفاعلات هذه الجزيئات مع أهدافها. وكما هو موضح في الشكل أدناه، وجدت الدراسة أن جزيء الدواء يمكنه الارتباط بشكل فعال بالجيب النشط في DRD2 وتشكيل روابط هيدروجينية مع بقايا الأحماض الأمينية الرئيسية.
وعلاوة على ذلك، وكما هو موضح في الشكل أدناه، ترتبط جزيئات المبيدات بشكل ثابت ببقايا الأحماض الأمينية في HPPD عن طريق تكوين روابط هيدروجينية. وبالمقارنة مع الأدوية الإيجابية، أظهرت المركبات الناتجة أيضًا أنماط ارتباط مختلفة، مما يشير إلى إمكانية وجود آليات دوائية مختلفة، مما يوفر اتجاهات جديدة للأبحاث المستقبلية.
تطبيق الذكاء الاصطناعي في أبحاث الأدوية يعيد تشكيل قواعد اللعبة
في هذه المرحلة، أصبح تطبيق الذكاء الاصطناعي في أبحاث الأدوية أكثر عمقًا. من خلال شبكات التعلم العميق، تتمكن نماذج الذكاء الاصطناعي من تحليل البيانات البيولوجية المعقدة والهياكل الكيميائية للتنبؤ بنشاط وانتقائية جزيئات الدواء.
كما قام الفريق المكون من البروفيسور يانغ جوانجفو والأستاذ المساعد وانغ فان المذكور في هذه الدراسة بتطوير نموذج معماري متعدد الوسائط للتعلم العميق Pesti-DGI-Net للتنبؤ بخصائص تشبه خصائص المبيدات الحشرية في وقت سابق من هذا العام. يمكنه التنبؤ بخصائص المركبات المشابهة لمبيدات الآفات من خلال دمج ثلاثة أشكال للتمثيل الجزيئي: الوصافات الجزيئية، والصور الجزيئية، والرسوم البيانية الجزيئية. وتظهر النتائج أن Pesti-DGI-Net يظهر أداءً متفوقًا في مؤشرات متعددة.
رابط الورقة:
https://doi.org/10.1016/j.compag.2024.108660
علاوة على ذلك، حققت الذكاء الاصطناعي مؤخرًا نتائج مثمرة في مجال أبحاث الأدوية. منذ وقت ليس ببعيد، قام معهد شنغهاي للتغذية والصحة، التابع للأكاديمية الصينية للعلوم، ببناء نموذج التعلم العميق ثنائي الرؤية JointSyn للتنبؤ بالتأثيرات التآزرية لمجموعات الأدوية. تظهر النتائج أن JointSyn يتفوق على الطرق الحديثة الموجودة من حيث دقة التنبؤ والمتانة على معايير مختلفة.
رابط الورقة:
https://doi.org/10.1093/bioinformatics/btae604
بالإضافة إلى تطبيقها في التنبؤ بخصائص الأدوية، حققت تقنية الذكاء الاصطناعي أيضًا نتائج بحثية ملحوظة في العديد من المجالات مثل تحسين تصميم الأدوية، وتقييم السموم والسلامة، وتصميم التجارب السريرية، واختيار المريض. ومن المتوقع أن يؤدي تطبيق الذكاء الاصطناعي في أبحاث الأدوية إلى إعادة تشكيل قواعد اللعبة في تطوير الأدوية. مع التقدم المستمر للتكنولوجيا، فإنها قد توفر خيارات علاجية أكثر أمانًا وفعالية للمرضى من خلال تحسين دقة التوقعات، وتحسين تصميم الأدوية، وتقليل تكاليف التطوير والوقت.








