Command Palette
Search for a command to run...
استنادًا إلى 8 ملايين بيانات حقيقية، استخدم فريق جامعة كورنيل الشبكات العصبية الرسومية للتنبؤ بدقة ببقاء مرضى سرطان الرئة واكتشفوا 3 أنواع فرعية مميتة
قبل عشر سنوات، صدمت نتائج تجربة CheckMate 017 مجتمع علم الأورام. وقد أشارت مجلة نيو إنجلاند الطبية ومجلة الجمعية الطبية الأمريكية ومجلات أخرى عدة مرات إلى أن بيانات البقاء على قيد الحياة للمرضى المصابين بسرطان الخلايا الحرشفية المتقدم في الرئة الذين عولجوا باستخدام مثبط PD-1 Nivolumab قد تحسنت بشكل كبير: حيث ارتفع متوسط وقت البقاء على قيد الحياة الإجمالي من 6 أشهر مع العلاج الكيميائي إلى 9.2 شهرًا، وكان معدل البقاء على قيد الحياة لمدة 18 شهرًا ضعف معدل مجموعة العلاج الكيميائي. تمثل هذه الدراسة بداية عصر مثبطات نقاط التفتيش المناعية (ICI)، ولكنها تكشف أيضًا عن المشكلة المتمثلة في أن المرضى المصابين بسرطان الرئة ذو الخلايا غير الصغيرة المتقدم (aNSCLC) لديهم استجابات مختلفة للعلاج المناعي:وفي التجربة، استمرت أورام بعض المرضى في التحسن لمدة تزيد على ثلاث سنوات، في حين شهد آخرون تطور المرض في غضون بضعة أشهر. لقد أصبح هذا التباين في الاستجابة للعلاج مشكلة في عصر الطب الدقيق.
تنبع تعقيدات سرطان الرئة من تنوعها الكبير. يشكل سرطان الرئة ذو الخلايا غير الصغيرة (NSCLC) ما نسبته 80%-85% من سرطان الرئة.يتم تشخيص حوالي 75% من مرضى السرطان في المرحلة المتقدمة، ومعدل البقاء على قيد الحياة لمدة 5 سنوات هو 26.4% فقط.إن التعبير التفاضلي عن العلامات الحيوية لبيئة الورم، والحالات الوظيفية المختلفة للخلايا المناعية، والأمراض المصاحبة المتنوعة للمرضى تجعل الوضع المرضي معقدًا. قد يستفيد المرضى الذين يتلقون علاج ICI بسبب ارتفاع التعبير عن PD-L1، ولكن قد يعانون أيضًا من ضعف الفعالية بسبب انخفاض حمولة طفرة الورم، وقد تؤثر الأمراض المصاحبة أيضًا على خيارات العلاج والتشخيص.
ولمواجهة التحديات، تتحول خطط التشخيص والعلاج من "مقاس واحد يناسب الجميع" إلى "التقسيم الطبقي الدقيق". وفي عملية التحول هذه، برز الطب التنبئي تدريجيا. الهدف الأساسي منه هو دمج البيانات متعددة الأبعاد بما في ذلك السجلات الصحية الإلكترونية ومعلومات الجينوم، وذلك لوضع خطة العلاج الأكثر ملاءمة لكل مريض. في السنوات الأخيرة، مع التراكم المستمر للبيانات الطبية الحيوية واسعة النطاق والتطور السريع لتكنولوجيا التعلم الآلي، بدأ الباحثون في محاولة استخدام أساليب التعلم الآلي غير الخاضعة للإشراف لتجميع مجموعات المرضى ذات الخصائص المتشابهة من أجل التنبؤ باستجابات العلاج. ولكن لسوء الحظ، فإن الأساليب التقليدية غالباً ما تكون لها حدود في التطبيقات العملية.ومن الصعب ضمان الاتساق في نتائج البقاء على قيد الحياة بين المرضى داخل المجموعة، مما يحد من قيمة تطبيق النتائج الطبقية في الممارسة السريرية.
ولحل المشاكل المذكورة أعلاه، اقترحت جامعة كورنيل وشركة ريجينيرون للأدوية نموذج البقاء المختلط المشفر بالرسوم البيانية (GEMS).تم ترميز العلاقات المعقدة في السجلات الصحية الإلكترونية للمرضى من خلال الشبكات العصبية البيانية ودمجها مع نماذج تحليل البقاء على قيد الحياة لتحديد النمط الظاهري الفرعي مع الخصائص المتسقة ونتائج البقاء على قيد الحياة.ووجدت الدراسة أنها متفوقة على الطرق التقليدية في التنبؤ بالبقاء على قيد الحياة بشكل عام، وتحديد ثلاثة أنماط فرعية ذات خصائص سريرية مختلفة وأنماط بقاء مختلفة، مما يفتح طريقًا جديدًا للطب الدقيق لسرطان الرئة.
وقد تم نشر نتائج البحث ذات الصلة في مجلة Nature Communication تحت عنوان "تحديد النمط الظاهري الفرعي التنبؤي للنتائج السريرية باستخدام بيانات العالم الحقيقي والتعلم الآلي".

عنوان الورقة:
https://doi.org/10.1038/s41467-025-59092-8
يجمع مشروع المصدر المفتوح "awesome-ai4s" أكثر من 100 تفسير لورقة AI4S ويوفر أيضًا مجموعات بيانات وأدوات ضخمة:
https://github.com/hyperai/awesome-ai4s
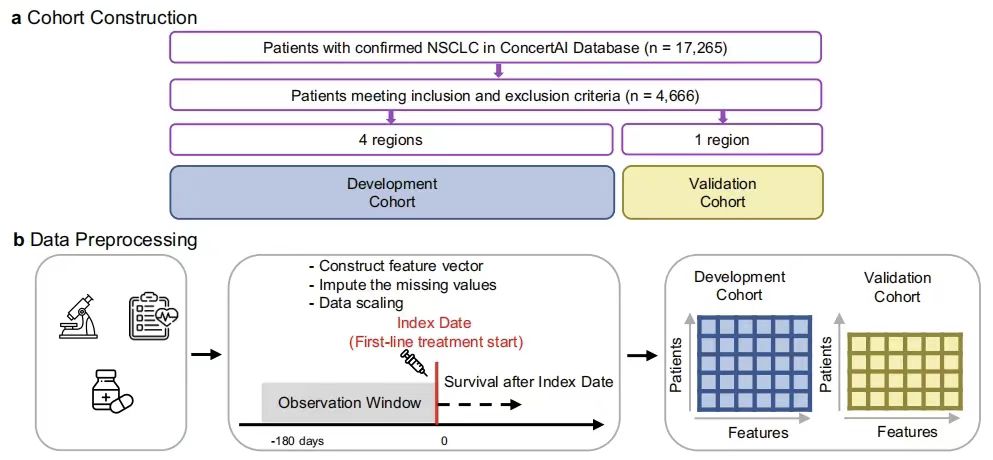
إنشاء مجموعة من المرضى المصابين بسرطان الرئة المتقدم ذي الخلايا غير الصغيرة استنادًا إلى مجموعة بيانات ConcertAI الواقعية واسعة النطاق
استخدمت الدراسة مجموعة بيانات ConcertAI Patient360™ NSCLC من قاعدة بيانات السجلات الصحية الإلكترونية لعلم الأورام في الولايات المتحدة (EHR) لبناء مجموعة من المرضى المصابين بسرطان الرئة ذو الخلايا غير الصغيرة المتقدم (aNSCLC) الذين يتلقون علاجًا مثبطًا لنقطة التفتيش المناعي (ICI) من الخط الأول (1 لتر).هذه المجموعة من البيانات هي مجموعة بيانات على مستوى المريض، غير محددة الهوية، ومقرها الولايات المتحدة، تم استخراجها من شبكة ConcertAI، وتغطي أكثر من 8 ملايين مريض فريد.تم استخراج البيانات من أكثر من 900 عيادة لعلم الأورام وأمراض الدم، تمثل المرضى الذين عولجوا في الممارسات المجتمعية والأكاديمية في جميع الولايات الخمسين، بما في ذلك البيانات حول تاريخ تكرار المرض ونوعه، وعلم الأنسجة، ومعلومات اختبار PD-L1، واستجابة الورم، وECOG-PS، والأمراض المصاحبة.
كما هو موضح في الشكل أدناه، اختارت هذه الدراسة المرضى الذين تم تأكيد إصابتهم بسرطان الرئة ذي الخلايا غير الصغيرة (NSCLC) نسيجيًا من يناير 2015 إلى يناير 2023 (ن = 17265) لبناء مجموعة مراقبة بأثر رجعي. بعد معايير الإدراج/الاستبعاد واستبعاد المرضى الذين لا يملكون سجلات بقاء إجمالية صالحة،تم تضمين 4666 مريضًا في الدراسة، وتم تمثيل المرضى بواسطة متجه مكون من 104 أبعاد، مع أبعاد تشمل المعلومات الديموغرافية والاختبارات المعملية ومتغيرات أخرى.
استنادًا إلى المناطق الجغرافية للمرافق السريرية التي حددها مكتب الإحصاء الأمريكي، قام الباحثون بتقسيم المجموعة إلى نموذج تطوير (مناطق الشمال الشرقي والجنوب والغرب، عدد الأفراد = 3225) ومجموعة فرعية للتحقق (منطقة الغرب الأوسط، عدد الأفراد = 1441)، والتي كانت لها التركيبة السكانية المماثلة، مع وجود نسبة أعلى من المرضى البيض والمرضى من المؤسسات الطبية المجتمعية في المجموعة الفرعية للتحقق. كانت فترة مراقبة الدراسة 180 يومًا قبل تاريخ المؤشر. تم تعريف البقاء على قيد الحياة بشكل عام (OS) على أنه الوقت من تاريخ المؤشر حتى الوفاة بسبب أي سبب، وتم تعريف البقاء على قيد الحياة بدون تقدم (PFS) على أنه الوقت من تاريخ المؤشر حتى أول حدث تقدم حقيقي في العالم الحقيقي أو الوفاة بسبب أي سبب. تهدف الدراسة إلى حل مشاكل مثل التنبؤ ببقاء المرضى المصابين بسرطان الرئة المتقدم ذي الخلايا غير الصغيرة من خلال التحليل المناسب لهذه المجموعة من البيانات.
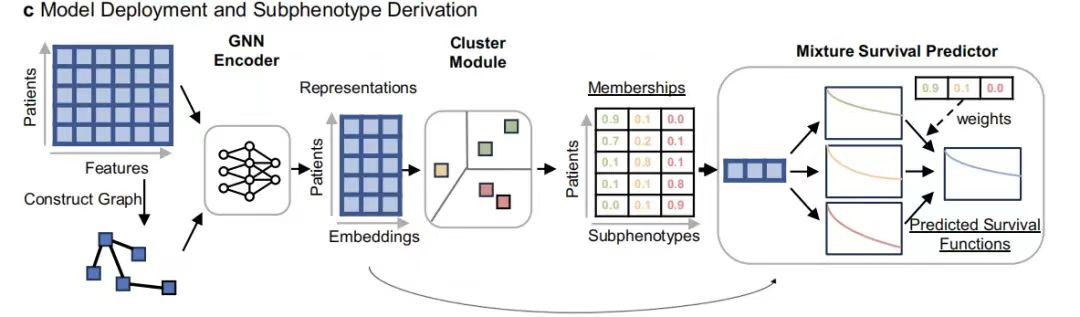
بناء نموذج GEMS: تحديد الأنماط الفرعية للبقاء على قيد الحياة استنادًا إلى GNN والتحقق من صحة أداء التنبؤ بسرطان الرئة المتقدم ذي الخلايا غير الصغيرة
في هذه الدراسة، تم تصميم نموذج GEMS لتحديد النمط الظاهري التنبؤي المرتبط بخصائص البقاء على قيد الحياة الشاملة (OS) في العالم الحقيقي لدى المرضى المصابين بسرطان الرئة ذو الخلايا غير الصغيرة المتقدم (aNSCLC).يتضمن هيكلها الأساسي GNN Encoder وCluster Module وMixture Survival Predictor.
ومن بينها، يستخرج مُشفِّر GNN بفعالية تمثيلات المرضى عالية المستوى من خلال التقاط علاقة بنية الرسم البياني لمتجه الميزات المكون من 104 أبعاد للمريض (يغطي متغيرات مثل التركيبة السكانية والاختبارات المعملية وحالة النقائل)؛ يتم إدخال التمثيلات المشفرة في وحدة التجميع لتوليد الأنماط الظاهرية الفرعية مع قيمة التنبؤ بالبقاء كمكونات أساسية للنموذج الهجين.
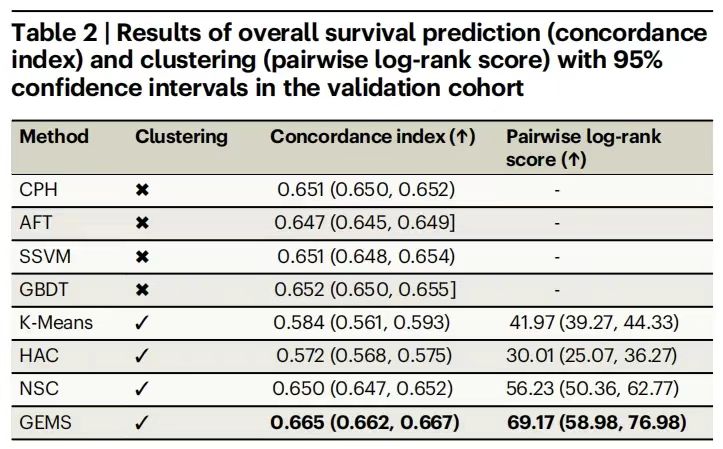
استخدم تدريب النموذج في البداية مجموعة التطوير (n=3,225) كدعم للبيانات، واستخدم مؤشر الاتساق (c-index) ونتيجة الرتبة السجلية الزوجية كمؤشرات للتقييم، وقارنها بنماذج الأساس التقليدية مثل الانحدار النسبي للمخاطر لكوكس (CPH)، وشجرة القرار المعززة بالتدرج (GBDT)، وتجميع البقاء العصبي (NSC)، والطرق غير الخاضعة للإشراف مثل K-means والتجميع الهرمي.
وتظهر النتائج التجريبية في الجدول التالي.وقد أظهر نظام GEMS أداءً جيدًا في التنبؤ بالبقاء على قيد الحياة بشكل عام.وصل متوسط مؤشر c إلى 0.665 (95% CI: 0.662-0.667)، وهو أعلى بشكل ملحوظ من أفضل نموذج أساسي لـ GBDT وهو 0.652؛ بلغت درجة تصنيف السجل 69.17 (95% CI: 58.98-76.98)، وهو ما يتجاوز بكثير درجة NSC البالغة 56.23، مما يؤكد الاستخدام الفعال لميزات البيانات بواسطة إطار التعلم الخاضع للإشراف.
ثم،وقد تناولت هذه الدراسة أيضًا تأثير مُشفِّر GNN على GEMS من خلال تصور التمثيلات المستمدة من المرضى ومُشفِّرات GNN الخاصة بهم.يتم استخدام التقريب والإسقاط المتعدد الموحد (UMAP). كما هو موضح في الشكل أدناه، من خلال تصور إسقاط التقريب المتعدد الموحد (UMAP)، وجد أنه في إخراج مساحة تمثيل المريض بواسطة مشفر GNN، يتم فصل مجموعات المرضى ذات أوقات البقاء الإجمالية المختلفة بشكل واضح، بينما يتم توزيع أنواع مختلفة من المرضى بشكل مختلط في مساحة الميزة الأصلية، مما يعكس بشكل حدسي قدرة الشبكة العصبية للرسم البياني على نمذجة علاقات الميزات المعقدة.
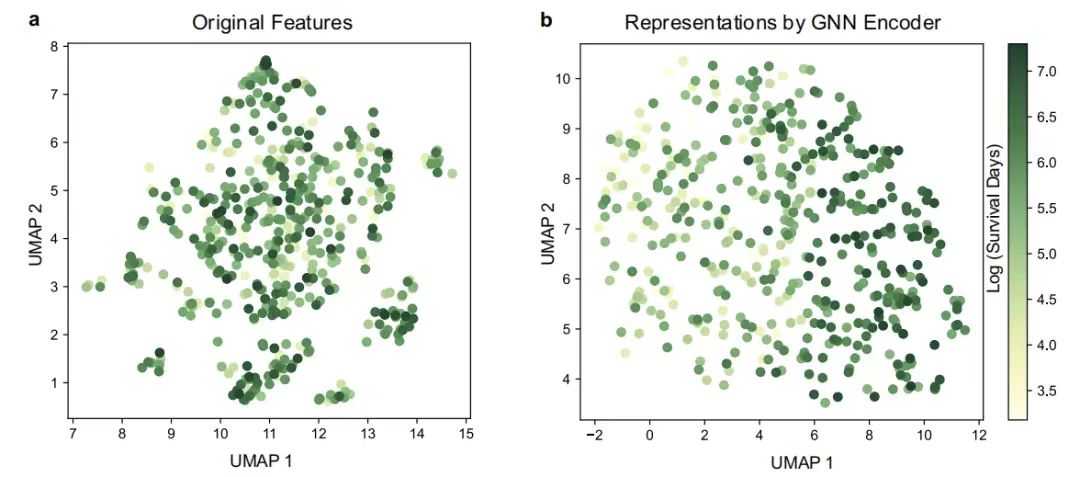
تصور UMAP للمرضى
الشكل أ: تصور UMAP للميزات الأصلية؛ الشكل ب: تصور UMAP للميزات التي تم الحصول عليها بواسطة مُرمِّز GNN
كما هو موضح في الشكل أدناه،واستخدم الباحثون النموذج أيضًا لتحديد ثلاثة أنماط فرعية تنبؤية ذات اختلافات كبيرة في البقاء على قيد الحياة:تميز النمط الفرعي 1 (ن = 1335) بنسبة عالية من الإناث (55.50%)، وأمراض مصاحبة خفيفة، وعبء نقائل منخفض، مع متوسط بقاء إجمالي لمدة 688 يومًا، وأدنى معدلات استخدام مثبطات السعال، وحاصرات بيتا، وحدوث نقائل العظام / الدماغ / الغدة الكظرية. أظهر منحنى البقاء للنمط الفرعي 2 (ن = 420) زيادة في المخاطر على المدى المتوسط، مع أمراض مصاحبة متوسطة وعبء خبيث. النمط الفرعي 3 (ن = 1420) كان لديه نسبة إناث 35.21% ومتوسط البقاء على قيد الحياة الإجمالي 321 يومًا فقط، وتميز بالأدوية المتعددة ومعدل النقائل المرتفع (نقائل الكبد 31.20%، ونقائل العظام 51.48%) والأمراض المصاحبة الشديدة (اضطرابات الماء والكهارل 8.31%، وتشوهات الكلى 21.43%)، ونمط التواجد الأكثر تعقيدًا للنقائل والأمراض المصاحبة والتشوهات المخبرية.
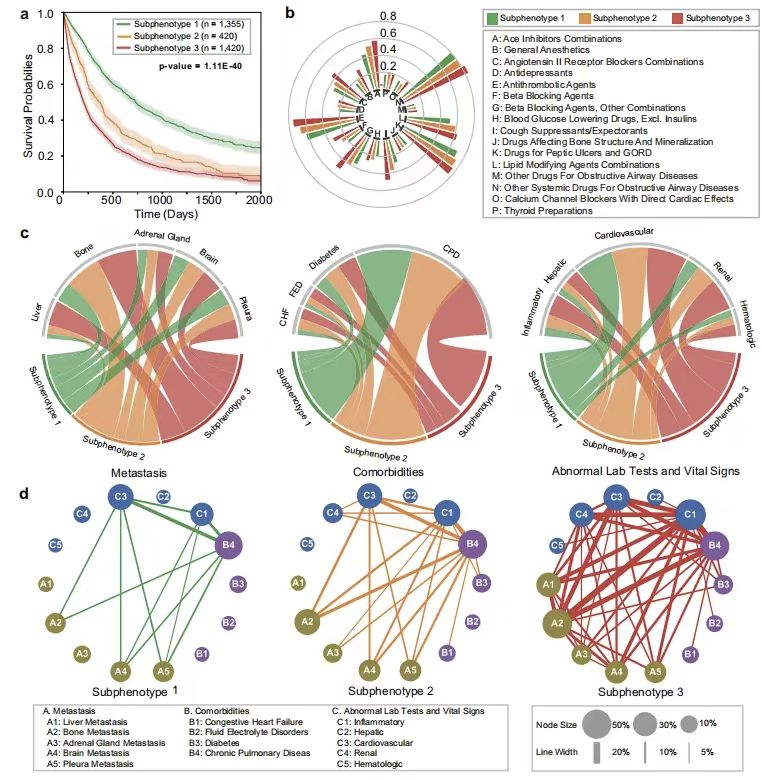
* الشكل أ: منحنيات كابلان-ماير للبقاء الإجمالي لكل نمط فرعي
* الشكل ب: مخطط أشعة الشمس لمعدل إعطاء الدواء لكل نوع فرعي
* الشكل ج: مخطط وتر يوضح الاختلافات في تصنيف النقائل (يسار)، والأمراض المصاحبة (وسط)، والسمات السريرية غير الطبيعية
* الشكل د: معدل حدوث الأنماط الفرعية المختلفة
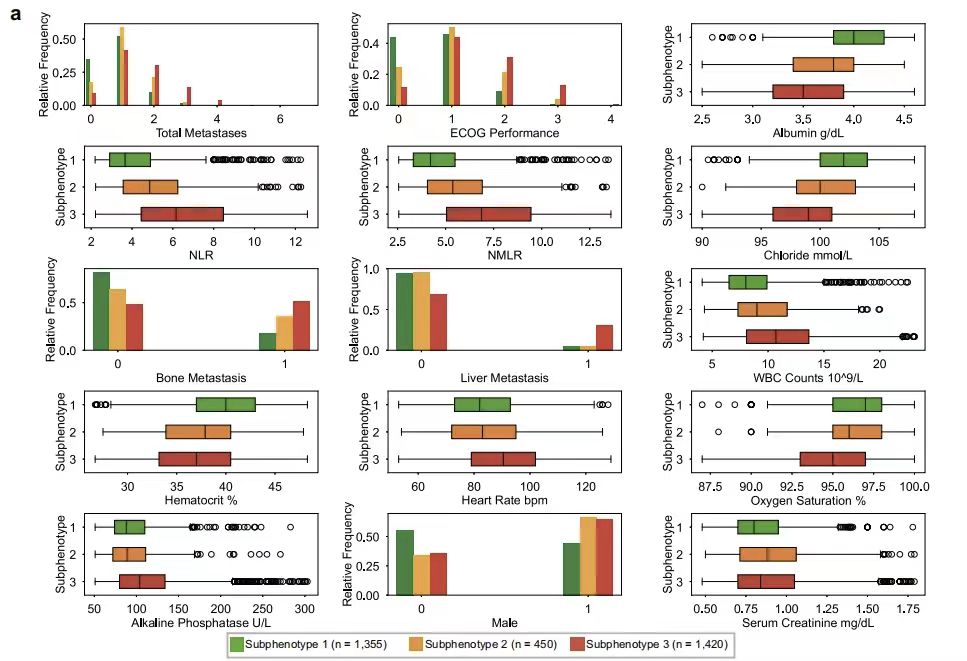
لفهم الخصائص المختلفة بين الأنماط الفرعية المختلفة بشكل أعمق، اختبرت هذه الدراسة الاختلافات في كل متغير بين الأنماط الفرعية. كما هو موضح في الشكل أدناه، أظهر تحليل العوامل التنبؤية الرئيسية أن حالة أداء مجموعة الأورام التعاونية الشرقية (أداء ECOG) والعدد الإجمالي للمواقع النقيلية (إجمالي النقائل) هي المؤشرات الأساسية للتمييز بين النمط الظاهري الفرعي. من حيث المؤشرات المعملية، فإن نسبة العدلات إلى الخلايا الليمفاوية (NLR) ونسبة العدلات إلى الخلايا الوحيدة إلى الخلايا الليمفاوية (NMLR) هي معايير مميزة للنمط الظاهري الفرعي 2، في حين يرتبط النمط الظاهري الفرعي 1 بمستويات الألبومين الطبيعية (عدد خلايا الدم البيضاء) والهيماتوكريت المرتفع (الهيماتوكريت)، ويرتبط النمط الظاهري الفرعي 3 ارتباطًا وثيقًا بمؤشرات مثل زيادة معدل ضربات القلب (معدل ضربات القلب نبضة في الدقيقة)، وانخفاض تشبع الأكسجين (تشبع الأكسجين)، وزيادة الفوسفاتيز القلوي (الفوسفاتيز القلوي).
وتظهر النتائج أعلاه أنلا يحقق نموذج GEMS تصنيفًا دقيقًا لتوقعات البقاء على قيد الحياة لمرضى سرطان الرئة غير صغير الخلايا فحسب،وعلاوة على ذلك، من خلال تحليل خصائص النمط الظاهري الفرعي، فإنه يوفر أساسًا لاتخاذ القرارات السريرية استنادًا إلى بيانات العالم الحقيقي لصياغة استراتيجيات العلاج الفردية.
الثورة العالمية في التشخيص الدقيق وعلاج سرطان الرئة: كيف تغير تقنيات الذكاء الاصطناعي والتعدد الجيني مشهد البقاء على قيد الحياة؟
في مجال تشخيص وعلاج سرطان الرئة، يعمل التحول الذي تقوده الذكاء الاصطناعي والطب الدقيق على إعادة تشكيل الممارسة السريرية. قام فريق بحثي من جامعة تورنتو في كندا بتطوير تقنية فحص الدم بمساعدة الذكاء الاصطناعي والتي تقوم بتحليل طفرات EGFR في الحمض النووي للورم المتداول.يؤدي الجمع بين التعلم الآلي والبيانات السريرية إلى تحسين معدل التعرف على الأشخاص الذين يستفيدون من العلاج المستهدف بشكل فعال.إنه يتيح للمرضى الذين يحملون طفرات حساسة لمستقبلات عامل نمو البشرة (EGFR) تلقي علاج مثبط تيروزين كيناز (TKI) لمستقبلات عامل نمو البشرة (EGFR) بدقة، مما يؤدي إلى إطالة متوسط البقاء على قيد الحياة الخالي من التقدم بشكل كبير.
رابط الورقة:https://pubmed.ncbi.nlm.nih.gov/35624472/
يستخدم نظام "evA.I." في جامعة كلية لندن بيانات سريرية مكونة من 27 بُعدًا.التنبؤ بدقة باستجابات مثبطات نقاط التفتيش المناعية (ICI) والمساعدة في تحديد السكان المقاومين للأدوية.ومن ثم تحسين فعالية العلاج المناعي وإطالة متوسط البقاء على قيد الحياة بشكل عام.
رابط الورقة:https://pmc.ncbi.nlm.nih.gov/articles/PMC10957591/
وفي الصين، تستمر النتائج المبتكرة في الظهور من قبل الجامعات والمؤسسات في مجال أبحاث التشخيص الدقيق وعلاج سرطان الرئة المتقدم ذي الخلايا غير الصغيرة. على سبيل المثال،أكمل فريق البروفيسور تشانغ بينج من جامعة تونغجي وفريق الأكاديمية الصينية للعلوم أول دراسة دولية لخريطة جينوم بروتين سرطان الرئة ذي الخلايا الصغيرة،من خلال دمج بيانات الجينومات متعددة الأبعاد لـ 112 عينة، وجدنا أن التعبير العالي عن بروتين HMGB3 كان مرتبطًا بسوء التشخيص، وأنشأنا نموذجًا للتنبؤ بفوائد العلاج المناعي يعتمد على حالة طفرة ZFHX3، مما يفتح مسارًا جديدًا للعلاج الدقيق الموجه بالكتابة الجزيئية.
رابط الورقة:https://doi.org/10.1016/j.cell.2023.12.004
قامت كلية الدراسات العليا الدولية بجامعة تسينغهوا في شنتشن ومستشفى الشعب في شنتشن بتطوير نظام "الذكاء الاصطناعي + علم الأمراض الذكي".بعد التعلم العميق لأكثر من 3000 حالة صعبة، يمكنه تحديد الأنواع النسيجية لسرطان الرئة ضعيف التمايز بدقة بمعدل دقة 97%.تقصير دورة اتخاذ القرار بشأن العلاج المستهدف. يمكن لنموذج التنبؤ بالذكاء الاصطناعي الذي طوره فريقه على أساس علامات جليكوبروتين الدم أن يحذر من خطر الإصابة بسرطان الرئة قبل ثلاث سنوات، مع معدل دقة تم التحقق منه سريريًا يتجاوز 92%، مما يوفر حلاً غير جراحي للفحص المبكر للغاية.
رابط الورقة:https://www.nature.com/articles/s41598-025-98731-4
المقالات المرجعية:
1.https://mp.weixin.qq.com/s/LBcVbQUpTYRnKZ5I1KY_VA








