Command Palette
Search for a command to run...
استخدامات جديدة للأدوية القديمة: أصدر فريق جامعة سنترال ساوث برنامج AdaDR لإعادة تموضع الأدوية استنادًا إلى شبكات التفافية بيانية تكيفية

في المجتمع الحديث، يحتاج البشر إلى مواصلة مكافحة الأمراض المعقدة المتزايدة الانتشار مثل السرطان والسكري وأمراض القلب والأوعية الدموية. لم تعد الأدوية الحالية قادرة على تلبية الطلب في السوق بشكل كامل، وأصبح تطوير أدوية جديدة أمرا ضروريا. ومع ذلك، فإن عملية اكتشاف الأدوية التقليدية تستغرق وقتا طويلا وتتطلب استثمارات مكثفة. إذا تمكنا من فحص الأدوية الجديدة والأهداف العلاجية بشكل استباقي من الأدوية السابقة والمركبات المهجورة، فمن الواضح أننا نستطيع توفير تكاليف البحث والتطوير بشكل كبير وتحسين كفاءة البحث والتطوير.
إعادة تنظيم الأدوية، أو "استخدامات جديدة للأدوية القديمة"، هو نهج تطوير الأدوية المعتمد من إدارة الغذاء والدواء والذي يطبق العلاجات الحالية على عمليات المرض الجديدة. على سبيل المثال، تم استخدام السيلدينافيل في الأصل لعلاج آلام الصدر، ولكن تبين لاحقًا أنه مثبط PDE5 (فوسفوديستيراز النوع 5)، مما جعل السيلدينافيل شائعًا جدًا في السوق.
بفضل مزاياها مثل تقليل مخاطر الأدوية، وتقصير دورات التقييم السريري، والتكلفة المنخفضة والكفاءة العالية، أصبحت إعادة تموضع الأدوية الحالية موضوعًا ساخنًا في أبحاث الصناعة الحالية.مع التطور السريع للتعلم العميق، تم استخدام الشبكات التلافيفية البيانية (GCNs) على نطاق واسع في مهام إعادة توطين الأدوية. ومع ذلك، فإن الطرق الحالية القائمة على GCN لها قيود في التكامل العميق لميزات العقدة والهياكل الطوبولوجية. ردًا على ذلك، نشر باحثون من جامعة سنترال ساوث ورقة بحثية بعنوان "إعادة تموضع الأدوية باستخدام شبكات التفافية بيانية تكيفية" في مجلة Bioinformatics.
اقترحت هذه الدراسة طريقة GCN التكيفية المسماة AdaDR لإجراء إعادة تموضع الدواء من خلال دمج ميزات العقدة والهياكل الطوبولوجية بشكل عميق.على عكس شبكات الالتفاف البياني التقليدية، يحاكي AdaDR المعلومات التفاعلية بينها من خلال عمليات الالتفاف البياني التكيفية، وبالتالي تعزيز القوة التعبيرية للنموذج.
على وجه التحديد، يستخرج AdaDR التضمينات من كل من ميزات العقدة والهياكل الطوبولوجية، ويستخدم آلية الانتباه لتعلم أوزان الأهمية التكيفية للتضمينات.
تظهر النتائج التجريبية أن AdaDR يتفوق على العديد من الطرق الأساسية في إعادة تموضع الدواء. بالإضافة إلى ذلك، يتم في دراسات الحالة توفير تحليلات استكشافية لاكتشاف ارتباطات جديدة بين الأدوية والأمراض.
أبرز الأبحاث:
* تقترح هذه الدراسة إطار عمل لشبكة التفافية بيانية متكيفة لمهام إعادة توطين الأدوية، وإجراء عمليات التفاف بيانية على الهياكل الطوبولوجية ومساحات الميزات.
* مع الأخذ في الاعتبار الاختلافات بين الهياكل والميزات الطوبولوجية، تستخدم هذه الدراسة آلية الانتباه لدمجها بالكامل لتمييز مساهماتها في نتائج النموذج
* النموذج المقترح في هذه الدراسة عملي في مهام إعادة تموضع الأدوية ويساعد في تقليل مخاطر فشل تطوير الأدوية
عنوان الورقة:
https://academic.oup.com/bioinformatics/article/40/1/btad748/7467059
عنوان تنزيل مجموعة البيانات:
قم بمتابعة الحساب الرسمي ورد بـ "نقل" للحصول على ملف PDF كامل
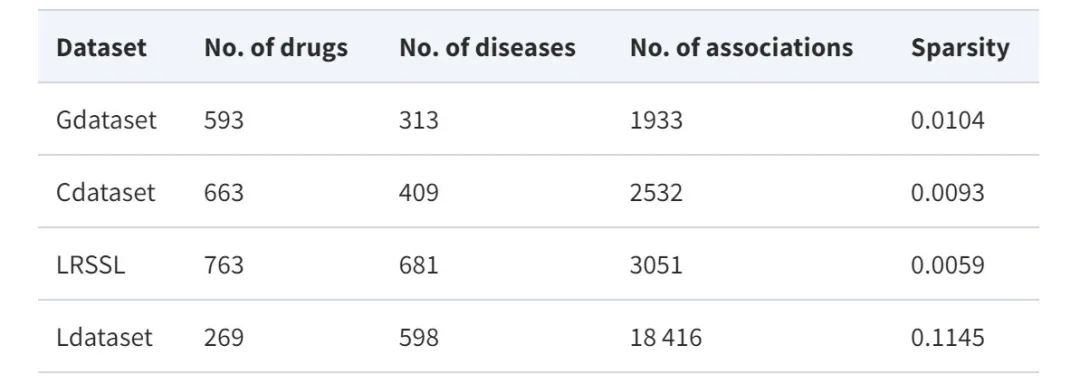
مجموعة البيانات: استخدام أربع مجموعات بيانات مرجعية رئيسية
من أجل تقييم أداء النموذج المقترح بشكل شامل،استخدمت هذه الدراسة أربع مجموعات بيانات مرجعية تستخدم على نطاق واسع في مهام إعادة تموضع الأدوية، وهي Gdataset وCdataset وLdataset وLRSSL.
* مجموعة البيانات:وتعتبر مجموعة البيانات المعيارية الذهبية، حيث تتضمن 593 دواءً من DrugBank و1933 ارتباطًا مؤكدًا بين الأدوية والأمراض بين 313 مرضًا مدرجًا في قاعدة بيانات OMIM.
* مجموعة البيانات:يحتوي على 663 دواءً، و409 مرضًا، و2352 ارتباطًا متفاعلًا بين الدواء والمرض.
* مجموعة البيانات:تم تجميعها من مجموعة بيانات CTD، وهي تتضمن 18416 ارتباطًا بين 269 دواءً و598 مرضًا.
*LRSSL:تم تضمين ما مجموعه 3051 ارتباطًا معتمدًا بين الأدوية والأمراض، شملت 763 دواءً و681 مرضًا.
وفي الوقت نفسه، من أجل بناء خريطة خصائص الدواء/المرض، استفادت الدراسة أيضًا من خصائص التشابه بين الأدوية والأمراض. تظهر إحصائيات مجموعة البيانات في الجدول التالي:
هندسة النموذج: إطار عمل GCNs التكيفي الجديد AdaDR
يتضمن إطار نموذج AdaDR المقترح في هذه الدراسة ثلاثة مكونات بشكل أساسي. كما هو موضح في الشكل التالي:
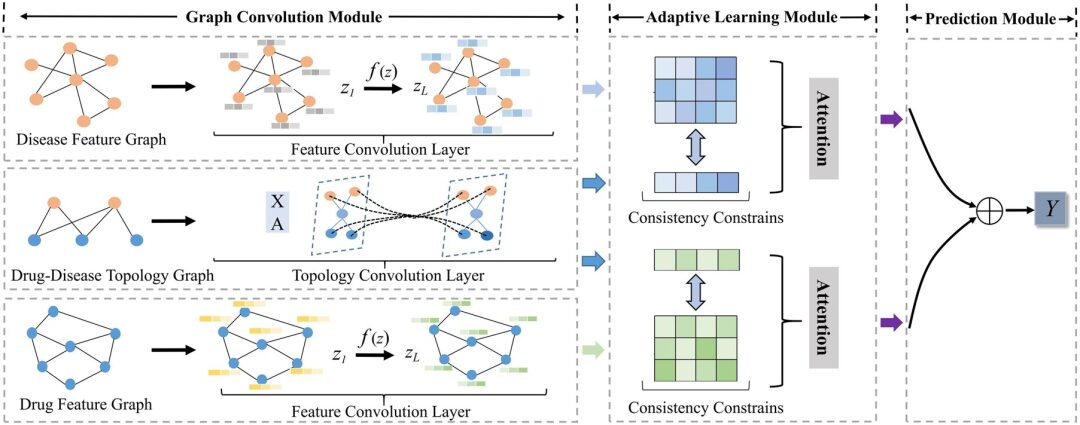
* وحدة التفاف الرسم البياني:تحتوي على طبقات التفافية مميزة وطبقات التفافية طوبولوجية لتمثيل تضمينات الأدوية/الأمراض في مساحة الميزة والفضاء الطوبولوجي.
* وحدة التعلم التكيفي:يتم استخدام آلية الانتباه للتمييز بين أهمية التضمينات المكتسبة. في هذه الوحدة، يتم استخدام قيود الاتساق لاستخراج المعلومات الدلالية المشتركة بين ميزات الفضاءات والطوبولوجيات.
* وحدة التنبؤ:يتم ربط التضمينات معًا كمخرجات للتنبؤ بالنتيجة.
نتائج البحث: يتفوق AdaDR على العديد من الطرق الأساسية في إعادة تنظيم الأدوية
بشكل عام، يمكن لـ AdaDR، باعتباره نموذجًا جديدًا، أن يحسن بشكل كبير أداء مهام إعادة تموضع الأدوية.
أولاً، الأداء في التحقق المتبادل:أجرت هذه الدراسة التحقق المتبادل عشر مرات على AdaDR والنماذج الأخرى، وحسبت المتوسط والانحراف المعياري للنتائج.
وفقًا للنتائج، وبفضل قدرة AdaDR على تكامل الميزات، فإن متوسط نتائجها النهائية على أربع مجموعات بيانات تم الحصول عليها في 10 عمليات تحقق متبادلة 10 أضعاف تفوقت على جميع الطرق المقارنة.
على سبيل المثال، في مجموعات البيانات المرجعية الأربعة Gdataset وCdataset وLRSSL وLdataset،كانت نتائج هذه الدراسة أعلى بمقدار 9.8%، و9.1%، و9.1%، و7.1% من AUPRC (المنطقة تحت التذكير الدقيق) لطريقة DRHGCN الأفضل ثانيًا، على التوالي، مما يوضح تمامًا فعالية الطريقة الجديدة.
والأمر التالي هو القدرة على التنبؤ بالمؤشرات المحتملة للأدوية الجديدة:أجرت هذه الدراسة تجربة جديدة لتقييم قدرة AdaDR على التنبؤ بالمؤشرات المحتملة للأدوية الجديدة.
بالمقارنة مع الطرق السبعة الأخرى، يحقق AdaDR أفضل أداء (يمثل الشريط الأزرق في الشكل أدناه AdaDR). من حيث AUROC (المساحة تحت منحنى التشغيل الخاص بالمستقبل)، كما هو موضح في الشكل (أ) أدناه، يحقق AdaDR قيمة AUROC تبلغ 0.948، وهو أفضل من الطرق الأخرى. وفي الوقت نفسه، كما هو موضح في الشكل (ب) أدناه، يحقق AdaDR AUPRC بقيمة 0.393، وهو أعلى من جميع الطرق الأخرى.
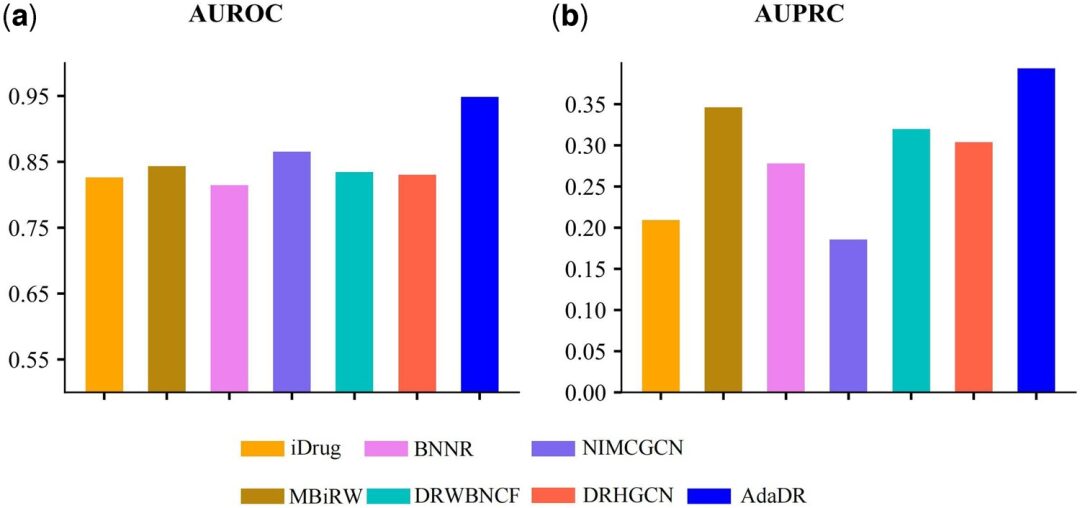
(أ) AUROC لنتائج التنبؤ التي تم الحصول عليها باستخدام AdaDR والطرق المنافسة الأخرى.
(ب) AUPRC لنتائج التنبؤ التي تم الحصول عليها من خلال تطبيق AdaDR والطرق المنافسة الأخرى.
ومن الجدير بالذكر أنه من أجل التحقق بشكل أكبر من أداء AdaDR، قام فريق البحث أيضًا بتطبيق AdaDR للتنبؤ بالأدوية المرشحة لمرض الزهايمر (AD) وسرطان الثدي (BRCA).
ومن بينها مرض الزهايمر، وهو مرض عصبي تنكسي يتطور تدريجياً ولا يوجد له دواء فعال حتى الآن. سرطان الثدي هو ظاهرة تتكاثر فيها الخلايا الظهارية الثديية بشكل لا يمكن السيطرة عليه تحت تأثير عوامل مسرطنة متعددة. على الرغم من وجود مجموعة متنوعة من الأدوية لعلاج سرطان الثدي، مثل باكليتاكسيل، وكاربوبلاتين، وما إلى ذلك، إلا أن المزيد من خيارات الأدوية قد توفر خيارات علاج أفضل. يوضح الجدول أدناه مرشحي الأدوية مع الأدلة الداعمة:
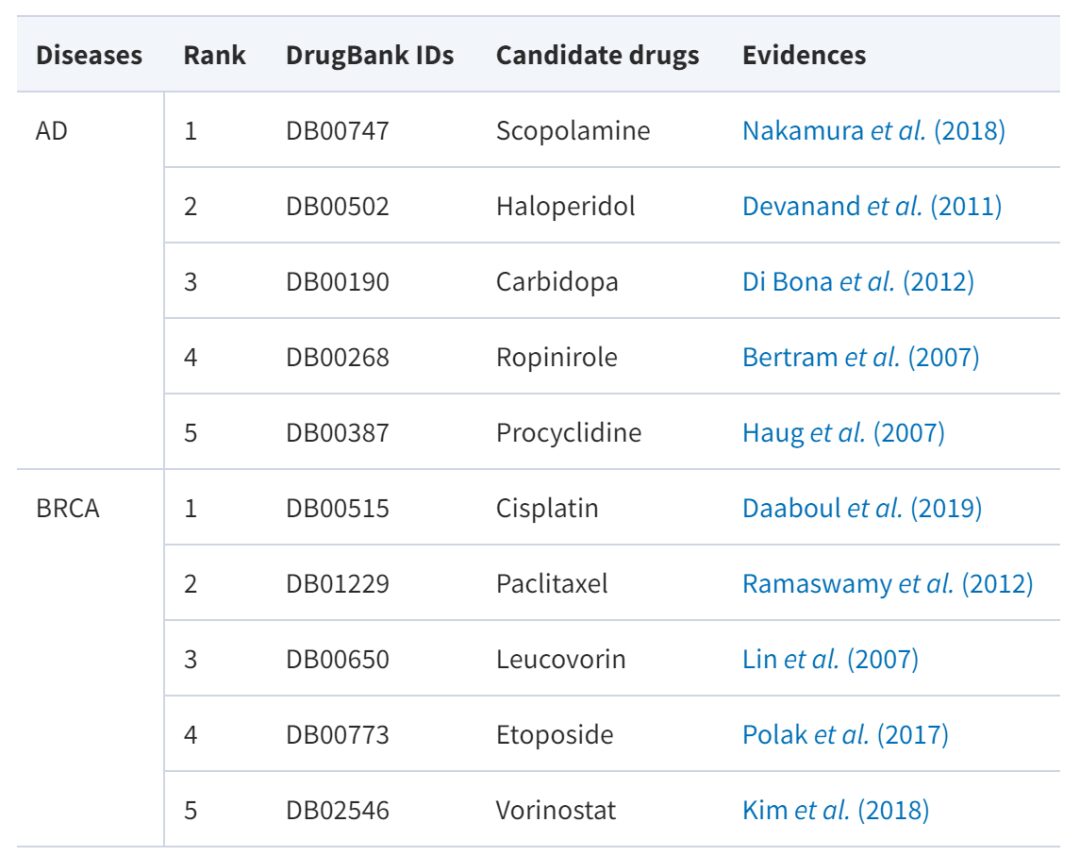
يمكن ملاحظة أنه من بين الأدوية الخمسة الأولى في درجات التنبؤ بـ AdaDR، تم التحقق من العديد منها من خلال مصادر ومراجع موثوقة (معدل النجاح 100%). علاوة على ذلك، فإن نموذج الدراسة قادر على إنتاج نتائج قابلة للتفسير. وباستخدام عقار باكليتاكسيل كمثال، يتوقع النموذج أن يتمكن هذا العقار من علاج سرطان الثدي. وهذا ما تؤكده بالفعل المصادر والأدبيات الموثوقة.
ومن المثير للاهتمام أن الباحثين وجدوا أن الدوسيتاكسيل ظهر في مجموعة التدريب الخاصة بهم. في حين أن الباكليتاكسيل والدوسيتاكسيل عبارة عن جزيئات متشابهة لها نفس جوهر الباكليتاكسيل.ويعكس هذا أن النموذج الجديد يمكنه الاستفادة من معلومات تشابه الأدوية للتوصل إلى تنبؤات ذات معنى.
يستمر العائد على الاستثمار في البحث والتطوير الدوائي في الانخفاض، وقد يكون إعادة تموضع الأدوية هو المفتاح لكسر الجمود
تشهد شركات الأدوية اليوم تغيرات غير مسبوقة. لقد فرضت جائحة كوفيد-19 والركود الاقتصادي الذي أعقبها سلسلة من التحديات وعدم اليقين على شركات الأدوية، حيث أصبحت العائدات من الابتكار أولوية قصوى لكل شركة أدوية.
على الرغم من أن شركات الأدوية الحيوية استثمرت بكثافة في البحث والتطوير من أجل الابتكار على مدى العقد الماضي، إلا أن العائدات انخفضت بشكل كبير خلال نفس الفترة. وأظهر "تقييم معدل عائد الابتكار الصيدلاني لعام 2019" الذي أصدره مركز ديلويت للحلول الصحية أن العائد على الاستثمار في البحث والتطوير في صناعة الأدوية في عام 2019 كان عند أدنى مستوى له منذ عام 2010، عند 1.8% فقط. وبحسب البيانات الواردة في التقارير العشرة، فإن العائد على الاستثمار في البحث والتطوير لشركات الأدوية كان في اتجاه تنازلي على مدى العقد الماضي.
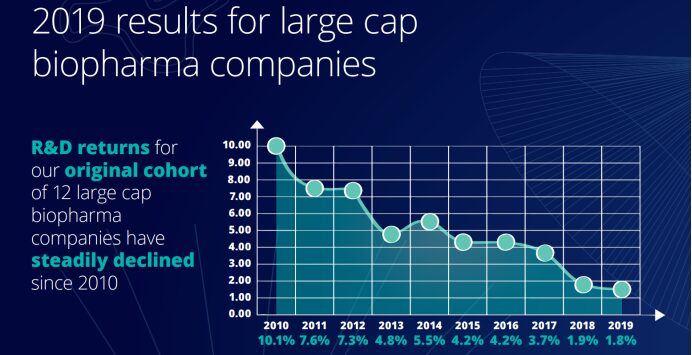
ولم يقتصر الأمر على ذلك، بل انخفضت مبيعات كل دواء جديد بعد إطلاقه من 407 ملايين دولار أمريكي في عام 2018 إلى 376 مليون دولار أمريكي في عام 2019، أي أقل من 400 مليون دولار أمريكي لأول مرة، وأقل من نصف 816 مليون دولار أمريكي في عام 2010. وارتفعت تكلفة إطلاق دواء جديد بمقدار 67% مقارنة بعام 2010، من 1.188 مليار دولار أمريكي في عام 2010 إلى 1.981 مليار دولار أمريكي في عام 2019.ويمثل الانخفاض في ذروة المبيعات تناقضاً صارخاً مع الزيادة في متوسط تكلفة طرح دواء جديد في السوق، مما يشير إلى أن شركات الأدوية تنفق وقتاً أطول من أي وقت مضى في عملية البحث والتطوير.
إن إعادة تنظيم الأدوية يمكن أن يوفر التكاليف المبكرة والوقت اللازم لطرح الدواء في السوق، وبالتالي تسريع الانتقال من العمل البحثي الأساسي إلى العلاج السريري. وبحسب المطلعين على الصناعة، يجب أن يخضع أي دواء جديد لسلسلة من الدراسات، بما في ذلك الدراسات المختبرية، والدراسات ما قبل السريرية على الحيوانات، والمراحل السريرية الأولى والثانية والثالثة، من بداية البحث والتطوير حتى الموافقة على التسويق. من عشر إلى خمس عشرة سنة هي فترة طبيعية، وهي تتكلف ما لا يقل عن مليار دولار. وبالمقارنة، تشير بعض الدراسات إلى أن إعادة تموضع الدواء يكلف في المتوسط 300 مليون دولار ويستغرق حوالي 6.5 سنوات للوصول إلى السوق.
تتضمن إعادة تموضع الدواء بشكل أساسي أساليب تعتمد على التعلم الآلي، وأساليب تعتمد على استخراج البيانات الضخمة وتحديد المواقع، وأساليب تعتمد على تحديد المواقع داخل الجسم الحي.وبالمقارنة بالطرق الحيوية، فإن تقنية إعادة تموضع الأدوية القائمة على التعلم الآلي واستخراج البيانات الضخمة تتمتع بمزايا السرعة العالية والتكلفة المنخفضة، وأصبحت تقنية قوية محتملة.
تقدم المقالة "مراجعة خوارزميات إعادة تموضع الأدوية القائمة على التعلم الآلي واستخراج البيانات الضخمة" تقدم الأبحاث في مجال إعادة تموضع الأدوية الحسابية في السنوات الأخيرة.
في،استنادًا إلى طريقة خوارزمية التعلم الآلي التقليدية،أولاً، يتم دمج معلومات الدواء والآثار الجانبية، ومعلومات التركيب الكيميائي للدواء، ومعلومات الأمراض والجينات، ثم يتم الحصول على بيانات التدريب من خلال استخراج الميزات واختيار الميزات، ثم يتم اختيار خوارزمية التعلم الآلي ذات الصلة للتدريب، وأخيرًا يتم استخدام نموذج الخوارزمية المدربة للحصول على نتائج إعادة وضع الدواء.
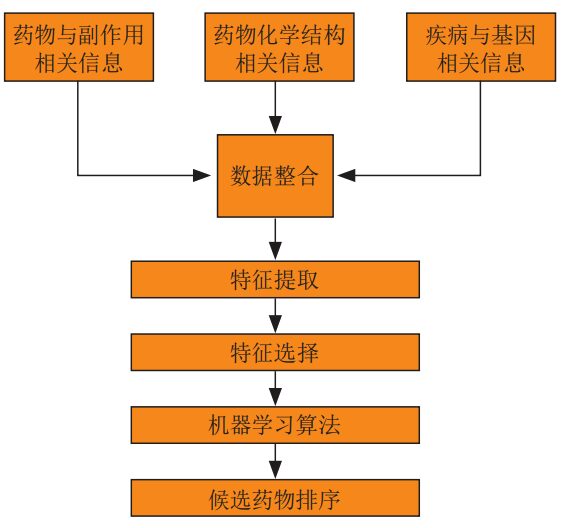
في أساليب التعلم العميق،قام بعض الباحثين بمقارنة الشبكات العصبية العميقة بشكل منهجي مع مجموعة متنوعة من أساليب التعلم الآلي الأخرى في جوانب متعددة من تطوير الأدوية. وتظهر النتائج أن التعلم العميق يؤدي أداءً أفضل من خوارزميات التعلم الآلي التقليدية.
في طريقة استدلال تشابه الشبكة،اقترح فريق بحثي من جامعة شرق الصين للعلوم والتكنولوجيا طريقة استدلال تعتمد على الشبكة (NBI) تستنتج أهدافًا جديدة للأدوية المعروفة باستخدام التشابه الطوبولوجي فقط للشبكات ثنائية الأجزاء للأدوية المستهدفة.
مع تطور تكنولوجيا التعدين في البيانات الضخمة، فإن إعادة تموضع الأدوية على أساس التعلم الآلي وخوارزميات التعدين في البيانات الضخمة سوف توفر طرقًا أكثر فعالية لعلاج الأمراض وأصبحت محور البحث الطبي الحيوي. هناك سبب للاعتقاد بأن التفكير العقلاني والنمذجة الحسابية سوف تلعب دوراً هاماً في عمليات إعادة تموضع الأدوية في المستقبل.
مراجع:
1.https://www.cn-healthcare.com/article/20191224/content-527902.html
2.https://pps.cpu.edu.cn/cn/article/pdf/preview/b286f85e-a37a-4007-ab94-918629aef556.pdf
3.https://mp.weixin.qq.com/s/lD-HyfwUHiX4f-llS6lykQ








