Command Palette
Search for a command to run...
تستخدم جامعة فلوريدا الشبكات العصبية لفك شفرة انتقائية اقتران بروتين GPCR-G
نظرة عامة على المحتويات:مستقبلات البروتين المقترنة (GPCRs) هي بروتينات عبر الغشاء تنقل المنبهات خارج غشاء الخلية إلى غشاء الخلية وتشارك على نطاق واسع في الأنشطة الفسيولوجية البشرية. في الآونة الأخيرة، قام باحثون في جامعة فلوريدا بتحديد انتقائية الارتباط بين مستقبلات البروتين G والبروتينات G، وقاموا بتطوير خوارزمية للتنبؤ بانتقائية الاثنين، ودرسوا الأساس البنيوي لهذه الانتقائية.
الكلمات الرئيسية:تطوير الأدوية باستخدام الشبكة العصبية GPCR
المؤلف | شيويه تساي
المحرر | سانيانغ
مستقبلات البروتين G المقترنة (GPCRs) هي بروتينات عبر الغشاء تنقل المحفزات خارج غشاء الخلية إلى داخل غشاء الخلية. من خلال تنشيط البروتينات G في غشاء الخلية ومسارات الإشارة اللاحقة لها، يمكن لمستقبلات GPCR أن تشارك على نطاق واسع في الأنشطة الفسيولوجية المهمة مثل التطور والمناعة وتنظيم الهرمونات والنشاط العصبي.
تتكون البروتينات G من وحدات فرعية Gα وGβ وGγ، ويحدد تنوعها تنوع استجابات إشارات مستقبلات البروتين G. يحتوي الجينوم البشري على 16 وحدة فرعية من Gα، والتي تنقسم إلى أربع عائلات فرعية:إدخال/إخراج ، جαس ، جαس و Gα12/13 . تحدد البروتينات G مسارات الإشارة اللاحقة، والتي تحدد بدورها الاستجابات الخلوية. لذلك، فإن الارتباط الانتقائي بين مستقبلات البروتين G والبروتينات G هو المفتاح لفهم نظام الإشارات في الكائنات الحية.
كان المجتمع الأكاديمي يعتقد في السابق أن مستقبلات البروتين G سوف ترتبط فقط ببروتين G واحد، وبالتالي تم تقسيم مستقبلات البروتين G إلى أربعة أنواع بناءً على وظائفها. ومع ذلك، اكتشف الباحثون مؤخرًا أن معظم مستقبلات البروتين G ترتبط ببروتينات G متعددة لتنشيط الاستجابات الخلوية المعقدة. لم يعد نموذج التصنيف واحد لواحد كافياً لوصف العلاقة الاقترانية بين مستقبلات البروتين G وبروتينات G، ولكن آلية الانتقائية لمستقبلات البروتين G-G ليست واضحة بعد.
تحقيقا لهذه الغاية،استخدم الباحثون في جامعة فلوريدا القياسات الحركية وتكنولوجيا نقل طاقة الرنين الحيوي (BRET) لقياس عوامل تبادل النوكليوتيدات الجوانينية لمستقبلات البروتين G لتحليل الارتباط الانتقائي بين الاثنين. وبناءً على ذلك، قام الباحثون بتصنيف مستقبلات البروتين ج وفقًا لتفضيلهم لبروتينات ج، وأنشأوا نموذجًا خشن الحبيبات لـ 124 مستقبلًا للبروتين ج من ثدييات مختلفة. وبعد ذلك، تم تطوير خوارزمية للتنبؤ بانتقائية بروتين GPCRs-G، وتم التحقيق في الأساس البنيوي للانتقائية.وقد تم نشر النتائج ذات الصلة فيتقارير الخلايا".

وقد تم نشر هذه النتيجة في "تقارير الخلية"
رابط الورقة:
https://doi.org/10.1016/j.celrep.2023.113173
01 BRET: تقدير انتقائي لمستقبلات GPCRs-G البروتينية
ولقياس انتقائية مستقبلات البروتين G-G، استخدم الباحثون تقنية BRET لقياس نشاط البروتين G في الخلايا الحية.

تقنية BRET للكشف في الوقت الفعلي عن نشاط البروتين G
ثم قام الباحثون بالتحقق من هذه النتيجة على مستقبل الكوليسيستوكينين من النوع الثاني (CCKBR). أظهرت نتائج سعة الاستجابة أن CCKBR يمكنه تنشيط Gαإدخال/إخراج ، جαس ، جα15 و Gα12/13 تتمتع بروتينات G من العائلة بمستويات تنشيط مماثلة، لكنها لا تستطيع تنشيط Gαس عائلة البروتينات.
تظهر النتائج المبنية على معدل التنشيط بوضوح أن CCKBR له تأثير مهم على Gαس إن تأثير التنشيط للعائلة هو الأفضل، يليه Gαإدخال/إخراج ، جα15 و Gα12/13، مما يوضح أن تقنية BRET القائمة على معدل التنشيط يمكنها التقاط الاختلافات الدقيقة بين أنشطة بروتينات G المختلفة.

نتائج BRET المستندة إلى السعة (ج) ونتائج BRET المستندة إلى معدل التنشيط (د)
وفقاً لذلك،قام الباحثون بقياس انتقائية 124 من مستقبلات البروتين G والبروتينات G باعتبارها مجموعة البيانات لهذه الدراسة.

قياسات الانتقائية لمستقبلات البروتين ج من الفئة ب والبروتينات ج
02 بناء النموذج: الشبكة العصبية للتصنيف الثنائي
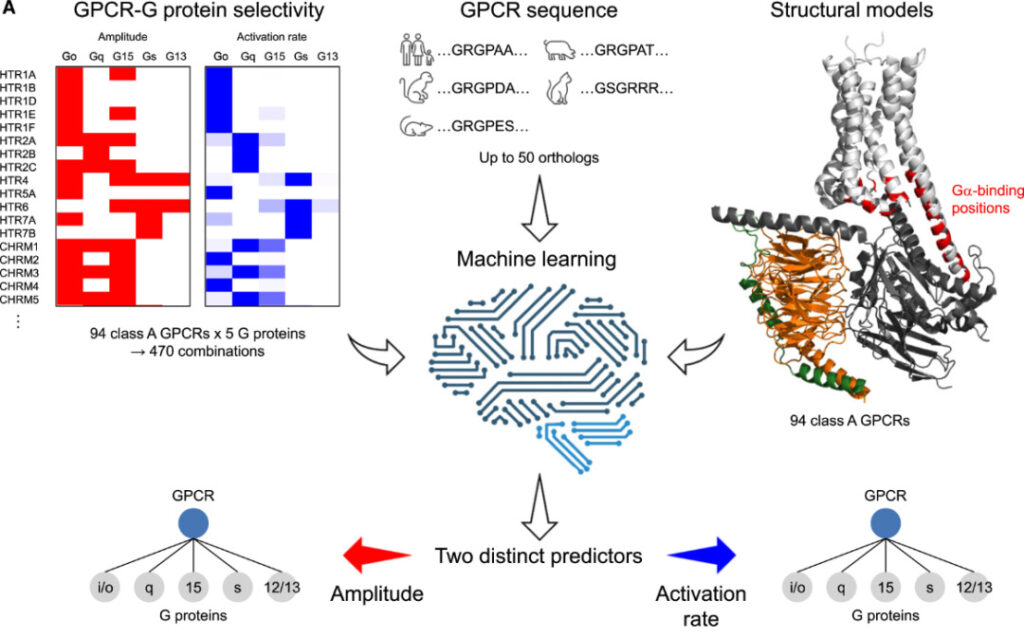
تشير النتائج المذكورة أعلاه إلى أن تقنية BRET القائمة على معدل التنشيط يمكنها التمييز بين الانتقائية بين مئات من مستقبلات البروتين G وبروتينات G. وبناء على هذه النتيجة،قام الباحثون بتطوير خوارزمية تعتمد على التعلم الآلي للتنبؤ بانتقائية بروتين GPCRs-G من الفئة A.
تحتوي الخوارزمية على مهمتين:
1. فيما يتعلق بربط مستقبلات البروتين ج، حدد ما إذا كان مستقبل البروتين ج معين يمكنه الاقتران ببروتين ج، أي السعة > 0%؛
2. فيما يتعلق بانتقائية مستقبلات البروتين GPCR، فقد تم تحديد أنه يمكن تنشيط زوج معين من بروتين GPCR-G بسرعة، أي أن معدل التنشيط هو >30%.
مخطط مفهومي لخوارزميات التعلم الآلي
إن الاقتران بين كل مستقبل GPCR وبروتين G من عائلة مختلفة يمثل مشكلة تصنيفية، لذا يمكن تصميم كل مهمة على شكل 5 تصنيفات ثنائية. وبناءً على ذلك، قام الباحثون بتصميم 10 مصنفات للشبكات العصبية للتعامل مع هذه المهام. تتكون الشبكة العصبية من طبقتين متصلتين بالكامل (تحتويان على 128 و16 خلية عصبية على التوالي)، وطبقة تسطيح، وثلاث طبقات متصلة بالكامل (تحتوي على 128 و32 و4 خلايا عصبية على التوالي)، وطبقة إخراج (خلية عصبية واحدة). يتم تنشيط الطبقات الداخلية بواسطة وحدات خطية مصححة (ReLU) وأخيرًا يتم إجراء تطبيع الدفعة. يتم تنشيط طبقة الإخراج بواسطة وظيفة سيجمايد.
ونظرًا للكمية المحدودة من البيانات، تمت إضافة 50 تسلسلًا متماثلًا إلى كل مستقبل بروتين G لتوسيع البيانات، على افتراض أن التسلسلات التي تحدد انتقائية بروتين G محفوظة نسبيًا أثناء التطور. يتم نشر بروتوكول تضمين التسلسل في النموذج لوصف خصائص بقايا البروتين في بيئة محددة باستخدام نموذج التعلم العميق غير الخاضع للإشراف.
المدخل إلى الشبكة العصبية هو موتر بحجم B*30*1024. البعد الأول هو حجم الدفعة (ب=32)، والبعد الثاني هو عدد البقايا (30)، والبعد الثالث لكلبقايا الأحماض الأمينيةحجم تضمينات التسلسل المدربة مسبقًا (1024).
متوسط تنبؤات النموذج للسعة ومعدل التنشيط أوروك كلاهما 0.85، مما يشير إلى أن النموذج يتمتع بأداء جيد في التنبؤ بكلا المؤشرين.ومن بينهم، بالنسبة لـ Gس تم التنبؤ بالبروتينات العائلية بشكل أفضل، مع قيم AUROC البالغة 0.89 و 0.95 على التوالي. ومع ذلك، بالنسبة لـ Gα15 و Gα12/13 عائلة من البروتينات، لم يظهر النموذج أي قدرة واضحة على التعلم.

منحنيات ROC للتنبؤ بالسعة (C) ومعدل التنشيط (D)
03 فك شفرة آلية انتقائية بروتين GPCRs-Gα
توفر تجارب BRET والتعلم الآلي حلاً لفك شفرة الأساس البنيوي لانتقائية بروتين GPCRs-G. وبناءً على ذلك، قام الباحثون بفحص مجمعات البروتين GPCRs-G المتاحة وقاموا بتحليل 33 مستقبلًا من الفئة A للعثور على البنية التي تحدد انتقائية بروتين GPCRs-Gα من الفئة A.
قام الباحثون بالتحقيق في شبكة بقايا بروتينات GPCRs-Gα ووجدوا أن جميع هياكل GPCRs التي تواجه السيتوبلازم كانت تشارك في الارتباط ببروتينات Gα بدرجات متفاوتة. على نحو مماثل، هناك 13 بنية في بروتين Gα مرتبطة بربط مستقبلات GPCR ببروتين Gα، ومن بينها الحلزون الطرفي C (H5) هو الأكثر تورطًا.

التفاعلات بين العناصر البنيوية المختلفة لمستقبلات البروتين G وبروتينات Gα
بالنسبة لربط GPCRs-Gα العالمي، تستخدم GPCRs ICL2 وH8 ومعظم بقايا TM للارتباط ببروتينات Gα. ومن بينها، كانت الغالبية العظمى من الهياكل مرتبطة في المقام الأول بـ H5، في حين كان ICL2 مرتبطًا على نطاق أوسع.
مستقبلات البروتين ج و Gαإدخال/إخراج و Gαس أنماط اقتران البروتين للعائلات متشابهة، مع وجود فرق وحيد وهو أن ارتباط مستقبلات البروتين G بالأولى يعتمد بشكل كبير على TM6، في حين أن الارتباط بالأخير لا يعتمد على ذلك. مستقبلات البروتين ج و Gαس ومن بين الاتصالات، تم تقليص حصة ICL2 وICL3 بشكل كبير، وتم الاعتماد بشكل أكبر على TM3 وTM5. تشير النتائج المذكورة أعلاه إلى أن ارتباط عائلات مختلفة من بروتينات Gα بمستقبلات GPCR يعتمد على هياكل مختلفة.
علاوة على ذلك، تم التحقيق في تأثيرات الهياكل المحددة على بروتينات Gα من عائلات مختلفة من خلال الجمع بين التسلسلات الانتقائية لبروتينات GPCRs-G. أولاً، القاضي و Gαإدخال/إخراج هل يمكن لمستقبلات GPCR المرتبطة أن ترتبط بـ Gα؟15 قم بدمج ومقارنة الاختلافات بين شبكتي البقايا. وبالمقارنة مع السابق، أدى ربط مستقبلات البروتين G إلى الأخير إلى قطع الارتباط بين ICL3 وH4، وإضعاف التفاعل بين ICL2-H5، وتعزيز الارتباط بين TM4-HN وICL2-s2s3. يشير هذا إلى أن الارتباط بين ICL2 والبقايا الأخرى قد يكون مرتبطًا بـ Gαإدخال/إخراج أو Gα15 الاختلافات الرئيسية في مستقبلات البروتين G المرتبطة.

تتفاعل مستقبلات GPCR فقط مع Gαإدخال/إخراج شبكة البقايا المتصلة بمستقبلات GPCR وGα15/Gαإدخال/إخراج شبكة البقايا المتصلة (ك)
على نحو مماثل، مستقبلات البروتين G و Gαس و Gαإدخال/إخراج بعد الجمع بين شبكات البقايا، أظهرت النتائج أن الارتباط بين ICL1 وTM5 كان الاختلاف الرئيسي بين الاثنين.
وتظهر النتائج أعلاه أنيمكن لتقنية BRET والتعلم الآلي تحليل شبكة بقايا البروتين الخاصة بربط مستقبلات GPCR ببروتين G وإيجاد الأساس البنيوي لانتقائيتها، مما يوفر طريقة جديدة لدراسة مستقبلات GPCR.
04 AI-GPCR: مناطق غير مستكشفة من 96.4%
على مدى العقد الماضي، زادت نسبة تطبيقات الذكاء الاصطناعي والتعلم الآلي في مجال مستقبلات البروتين G بشكل مطرد. في عام 2022، ذكرت 3.6% من الأوراق البحثية المتعلقة بـ GPCR طرقًا متعلقة بالذكاء الاصطناعي.
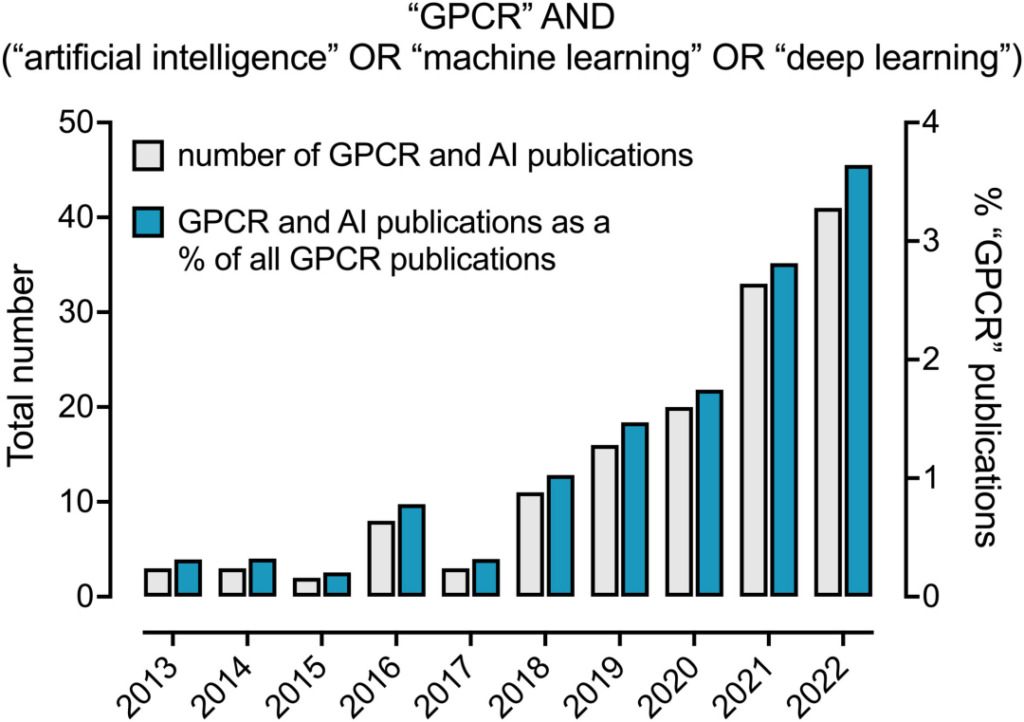
نسبة الذكاء الاصطناعي المذكورة في الأوراق المتعلقة بمستقبلات البروتين G
ونظراً للتطبيق المتزايد للذكاء الاصطناعي في أبحاث الأدوية المرتبطة بمستقبلات البروتين G، يجري حالياً تطوير الخوارزميات المقابلة. بالنسبة لمشاكل التصنيف، فإن الخوارزميات الأكثر استخدامًا هي تلك الموجودة في التعلم الآلي التقليدي، مثل تلك الموجودة في مكتبة scikit-learn، بما في ذلك آلات الدعم المتجهة (SVMs)، وأشجار القرار، وآلات تعزيز التدرج، وخوارزميات أقرب جار k.
بالنسبة للنتائج الرقمية، مثل تقارب ربط البروتين بالربيط، غالبًا ما يتم استخدام خوارزميات الانحدار لحلها، مثل الانحدار الخطي المتعدد المتغيرات، وآلات الدعم المتجه، وشبكات التعلم العميق.
تستخدم النتائج الأخيرة في الغالب خوارزميات التعلم العميق مثل الإدراك متعدد الطبقات والشبكة العصبية التلافيفية (CNN) للتنبؤ. مع تطور خوارزميات التعلم العميق التوليدية، أصبح تصميم ربيطة البروتين وبنيته أكثر كفاءة ودقة. يمكن للخوارزميات مثل الشبكة التنافسية التوليدية، والشبكة العصبية المتكررة، والتعلم التعزيزي استخدام البناء التلقائي والقياس التكيفي لمساحة المتجه لاستكشاف مساحات جيل أكبر.

دور الذكاء الاصطناعي في كل مرحلة من مراحل تطوير عقار GPCR
لذلك، يمكن لهذه الخوارزميات توليد المزيد من الربيطة ذات الوظائف المرغوبة أو التنبؤ بشكل أكثر دقة بهياكل البروتينات غير المعروفة، على سبيل المثال ألفا فولد 2 . على الرغم من أن النماذج مثل AlphaFold2 ليست مصممة خصيصًا للتنبؤ ببنية مستقبلات البروتين G، إلا أنها لا تزال قادرة على التنبؤ ببنية مستقبلات البروتين G بكفاءة ودقة. بالإضافة إلى ذلك، فإن التعلم العميق غير الخاضع للإشراف أو الخاضع للإشراف الذاتي ينشأ أيضًا في مجال اكتشاف الأدوية.
يمكننا أن نرى أن AI-GPCR قد يكون اتجاهًا جديدًا لتطوير الأدوية في المستقبل، لكنه يتركنا أيضًا مع منطقة غير معروفة من 96.4%. وبمساعدة التصنيف الفعال وخوارزميات التنبؤ الدقيقة، يمكن للناس أن يكون لديهم فهم أكثر وضوحًا لآلية اقتران مستقبلات البروتين G، مما يعطي زخمًا جديدًا لتطوير الطب الحيوي.
