Command Palette
Search for a command to run...
David Baker チームからの新たな成果! RF拡散は原子レベルの精密な抗体の新規設計を実現するために進化しました
19 世紀後半、ドイツの細菌学者エミール・アドルフ・フォン・ベーリングはジフテリア毒素に関する広範な研究を行いました。当時、ジフテリアは死神の大鎌のように、多くの子供たちの命を容赦なく奪っていました。実験では、ベーリング氏はウサギに微量のジフテリア毒素を注射し、その反応を観察して毒素と戦う方法を見つけようとした。数日後、ウサギが死ななかっただけでなく、その後のジフテリア毒素の注射に対して耐性を発達させたことに彼は驚きました。さらに研究を進めると、ウサギの血清の中にジフテリア毒素を中和できる物質が存在することが判明した。人類が抗体の存在を発見したのはこれが初めてでした。この偶然の発見は抗体研究の応用への扉を開き、病気と闘うために体自身の力を利用する大きな可能性を実証しました。
1 世紀以上にわたる徹底的な探究を経て、科学者たちは抗体研究の分野で努力を続けてきましたが、特定のエピトープに対する新しい抗体を生成するためにコンピューター設計に完全に依存した効率的な方法はまだ開発されていません。今日、治療用抗体の発見は、依然として主に動物免疫またはランダムライブラリスクリーニングという2つの従来の方法にとどまっています。ますます複雑化する疾患の課題に直面して、これらの従来の方法の限界がますます顕著になってきており、特定の標的に対する抗体のより効率的かつ正確な設計を実現し、抗体研究に新たな希望をもたらすための新たなブレークスルーが緊急に必要とされています。
従来の方法に頼った抗体発見の問題を解決するために、ワシントン大学の生化学教授であるデビッド・ベイカー氏とその協力者のチームは、微調整された RF 拡散ネットワーク計算タンパク質設計と酵母ディスプレイスクリーニングを組み合わせました。私たちは、原子レベルの精度で特定のエピトープに結合できる抗体可変重鎖 VHH と単鎖可変フラグメント scFv の生成に成功しました。抗体ドメインの de novo 設計の実現可能性が実証されました。このアプローチは、新たに設計された抗体の計算設計、スクリーニング、分離、および特性評価のための合理的なフレームワークを提供し、構造とエピトープの標的化において原子レベルの精度を実現します。
関連する研究結果は、「RF拡散による抗体の原子的に正確なde novo設計」というタイトルでbioRxivにプレプリントとして公開されています。

用紙のアドレス:
https://doi.org/10.1101/2024.03.14.585103
オープンソース プロジェクト「awesome-ai4s」は、200 を超える AI4S 論文の解釈をまとめ、膨大なデータ セットとツールを提供します。
https://github.com/hyperai/awesome-ai4s
抗体研究における技術革新:AIのブレークスルーと課題
抗体はタンパク質治療薬の主流であり、その高い特異性と低い副作用により、腫瘍、自己免疫疾患などの分野で中核的な治療法となっています。 2025年現在、世界中で160種類以上の抗体医薬品が規制当局に承認されており、その市場規模は過去10年間で年平均15%の割合で成長しています。今後5年間で4,450億ドルに達すると予想されています。
しかし、従来の抗体開発技術は、長い間、動物の免疫化とランダムライブラリスクリーニングに依存してきました。重大なボトルネックに直面しています。動物の免疫化には、動物の免疫系を刺激して抗体を生成するために複数回の抗原注射が必要です。このプロセスには通常 6 ~ 12 か月かかります。さらに、動物の免疫反応は個体差があるため、膜タンパク質などの複雑な抗原に対して、効果の高い抗体を得ることは困難です。ランダムライブラリスクリーニング法(ファージディスプレイ技術など)はスクリーニング範囲を広げることができますが、折り畳まれていないタンパク質や糖鎖エピトープなどの抗原に対する免疫反応を刺激することが難しく、スクリーニングされた抗体の親和性は一般的に低いです。
従来の技術の限界を打破するために、計算設計と人工知能は徐々に抗体の研究開発における新たな方向性となってきました。初期の研究では、既存の抗体フレームワークに残基を埋め込み、相補性決定領域 (CDR ループ) のコンフォメーションを最適化し、Rosetta アルゴリズムを組み合わせて相互作用インターフェースを変換することで、抗体のパフォーマンスを向上させることに成功しました。例えば、2018年の研究では、計算設計により抗PD-1抗体の親和性が20倍に増加しました。
近年、ディープラーニング技術は抗体配列の生成をさらに促進している。2023年、スタンフォード大学の研究チームはニューラルネットワークを使用して、新型コロナウイルスの変異株に対する広範囲の中和抗体を設計し、そのin vitro活性は従来の方法の3倍に上った。 2024年には、David Baker 氏のチームが開発した RFdiffusion モデルにより、事前に設定されたバックボーン構造を必要とせずに結合タンパク質を新規に設計できるようになります。この技術は、タンパク質の折り畳みの物理的プロセスをシミュレートして、標的エピトープの形状と高度に補完的な結合インターフェースを生成し、インフルエンザウイルスのヘマグルチニンに対する新しい阻害剤の設計に成功しました。しかし、この研究は、αヘリックスやβフォールドなどの規則的な二次構造を持つエピトープにのみ適用可能であり、抗体は通常、結合を達成するために複雑なリング構造(CDR-H3など)に依存しているため、抗体設計への直接適用は依然として困難です。
既知の抗体と相同性のない、構造的に正確な抗体をゼロから設計することは、不十分な動的構造シミュレーション、高品質データの欠如、長い実験検証サイクルなどの主な課題があり、未解決の問題のままです。
抗体の結合プロセスには柔軟な CDR ループの構造変化が伴い、既存のアルゴリズムではこのような動的な相互作用を正確にシミュレートすることが困難です。同時に、抗体抗原複合体の構造データが不足しているため、ディープラーニング モデルの一般化能力が制限されます。計算設計により初期の研究開発時間を大幅に短縮できますが、発現精製と活性試験には依然として数週間かかり、技術のクローズドループのボトルネックとなっています。将来のブレークスルーは、物理モデルと生成 AI ツールを統合するハイブリッド アルゴリズムの開発に依存する可能性があります。単一細胞シーケンシングとクライオ電子顕微鏡データは、クロススケールデータベースの構築に基づいて統合され、「ドライおよびウェットクローズドループ」R&Dモデルに基づくロボット自動化によってリアルタイムの反復が実現されます。
動物免疫から計算設計まで、抗体技術の革新はバイオメディカル分野におけるパラダイムシフトであるだけでなく、多分野にわたる国境を越えた可能性も反映しています。AIと合成生物学の発展により、抗体を完全にゼロから設計するというビジョンが徐々に実現され、精密医療の新たな章が開かれる可能性があります。
計算による抗体設計の分野が最近重要な進歩を達成したことは注目に値します。 2025年3月、David Baker氏のチームは、RFdiffusion(呼称:新RFdiffusion)と呼ばれる新しいAIタンパク質生成ツールを開発しました。CDR ループなどの抗体可変領域に特化して最適化されたモデルの新しいバージョンがリリースされました。研究チームは2024年3月の研究でナノボディなどの短鎖機能性抗体フラグメントの生成を達成していましたが、抗体構造の複雑さのため、当時のバージョン(通常のRF拡散と呼ばれていました)では、より複雑な抗体構造を設計するには依然として限界がありました。
1 年以上にわたるアルゴリズムの反復を経て、新しい RFdiffusion は、抗体抗原複合体構造データベースのトレーニングを導入することで、より自然なヒト抗体に近い、より完全な単鎖可変フラグメント scFv を生成できるようになりました。この進歩は、AI は、テンプレートを必要とせずに、完全な抗原結合ドメインを備えた抗体の重鎖と軽鎖の協調設計を実現しました。抗体設計に新たな希望をもたらす。
新しいRF拡散:原子レベルの精度による新規抗体設計
RF拡散を抗体設計に適応させるために、研究チームはそれに基づいていくつかの微調整を行いました。下の図に示すように、トレーニング プロセス中に、AlphaFold2/RF2 フレームワークを使用してタンパク質バックボーンを表現し、フレームワークが認識できなくなるまで、一連の「時間ステップ (T)」を通じてタンパク質フレームワークにノイズを追加します。各時間ステップで、RFdiffusion は、実際の構造 X₀ と予測された構造 pX₀ の間の平均二乗誤差 mse を最小化することによって最適化されたノイズ除去された構造を予測します。このユニークなトレーニング方法により、 RFdiffusion は、推論時にランダムな残基分布から始めて、新しいタンパク質構造を段階的に生成できます。
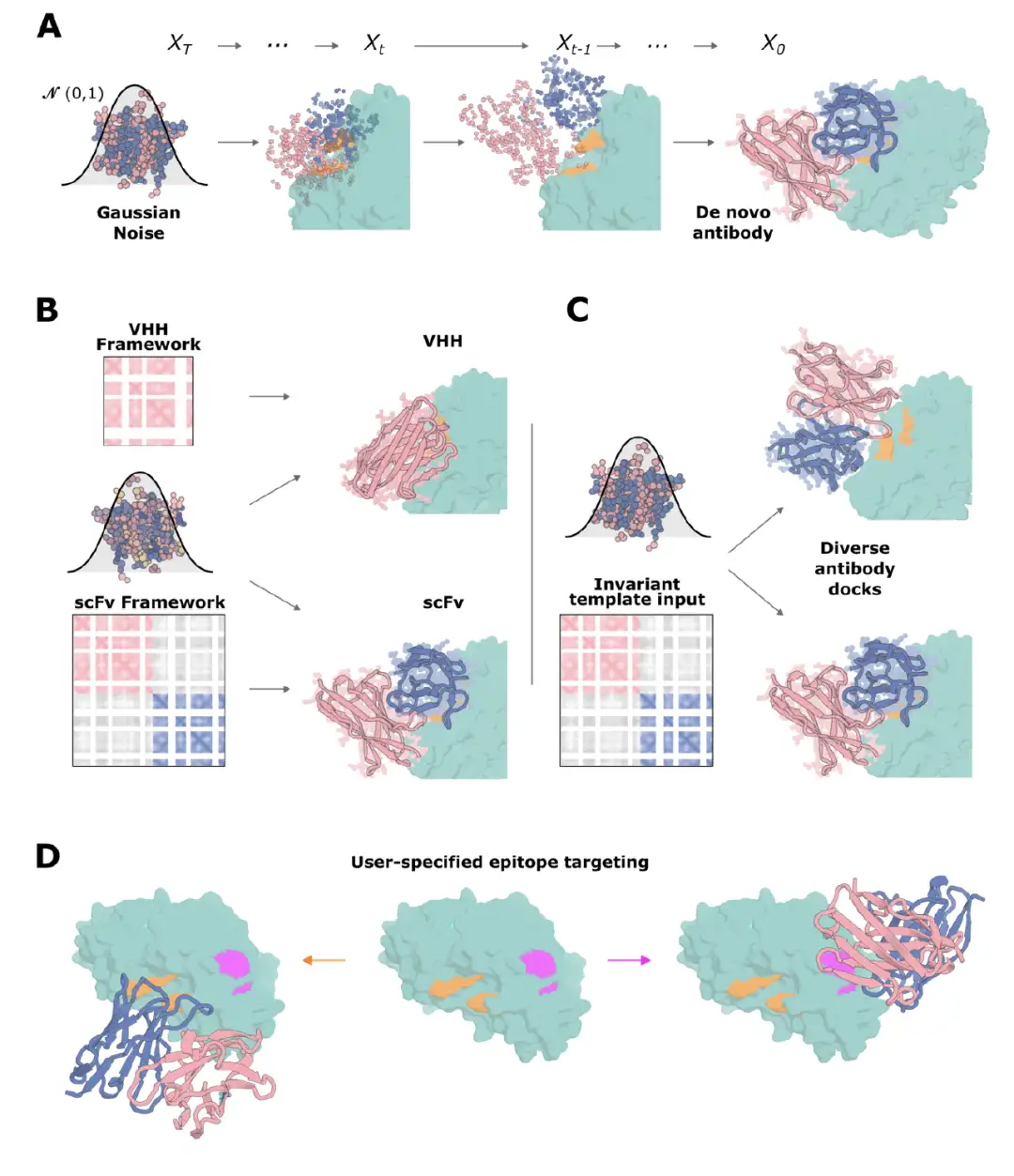
その後、この研究では新しい RF 拡散法を単一ドメイン抗体 VHH の設計に適用しました。 VHH はラクダ科動物の重鎖抗体の可変ドメインに基づいて設計されており、サイズが小さいため、単一鎖可変フラグメント scFv または抗原結合フラグメント Fab よりも設計をエンコードする遺伝子の組み立てが容易で、コストも低くなります。
VHH には CDR ループが 3 つしかなく、従来の抗体の 6 つの CDR ループよりも少ないですが、VHH の平均相互作用表面積は従来の抗体と非常に似ています。これは、VHH を設計するためのアプローチが抗体の設計にも適用できることを示唆しています。
VHHを設計するために、研究者らは、クロストリジウム・ディフィシル毒素B(TcdB)、インフルエンザH1ヘマグルチニンHAなど、一連の疾患関連ターゲットをターゲットとする、広く使用されているキメラVHHフレームワークを基礎として選択し、ProteinMPNNを介してターゲットコンテキストでCDRループ配列設計を実行し、その後、微調整されたRoseTTAFold2ネットワークを使用してスクリーニングしました。インフルエンザ HA の設計では、実験設計条件を計算パラメータと一致させるために、研究者らは昆虫細胞で発現した市販のモノマー HA 製品を使用して親和性を測定しました。
結果は次のことを示していますRF拡散により、標的エピトープと特異的に相互作用するVHHの設計が可能になります。RSV サイト III、インフルエンザ HA、RBD、および TcdB に対する最も親和性の高い結合剤をそれぞれ下の図に示します。 CDR ループは天然の VHH のものと大きく異なり、設計がトレーニング データセットの範囲外であったことを示しています。 TcdB の場合、ターゲット エピトープは Frizzled-7 インターフェイスであり、PDB にはこの部位をターゲットとする抗体や VHH は存在しません。さらに、TcdB VHH は CSPG4 ノックアウト細胞における TcdB の毒性を中和しました。
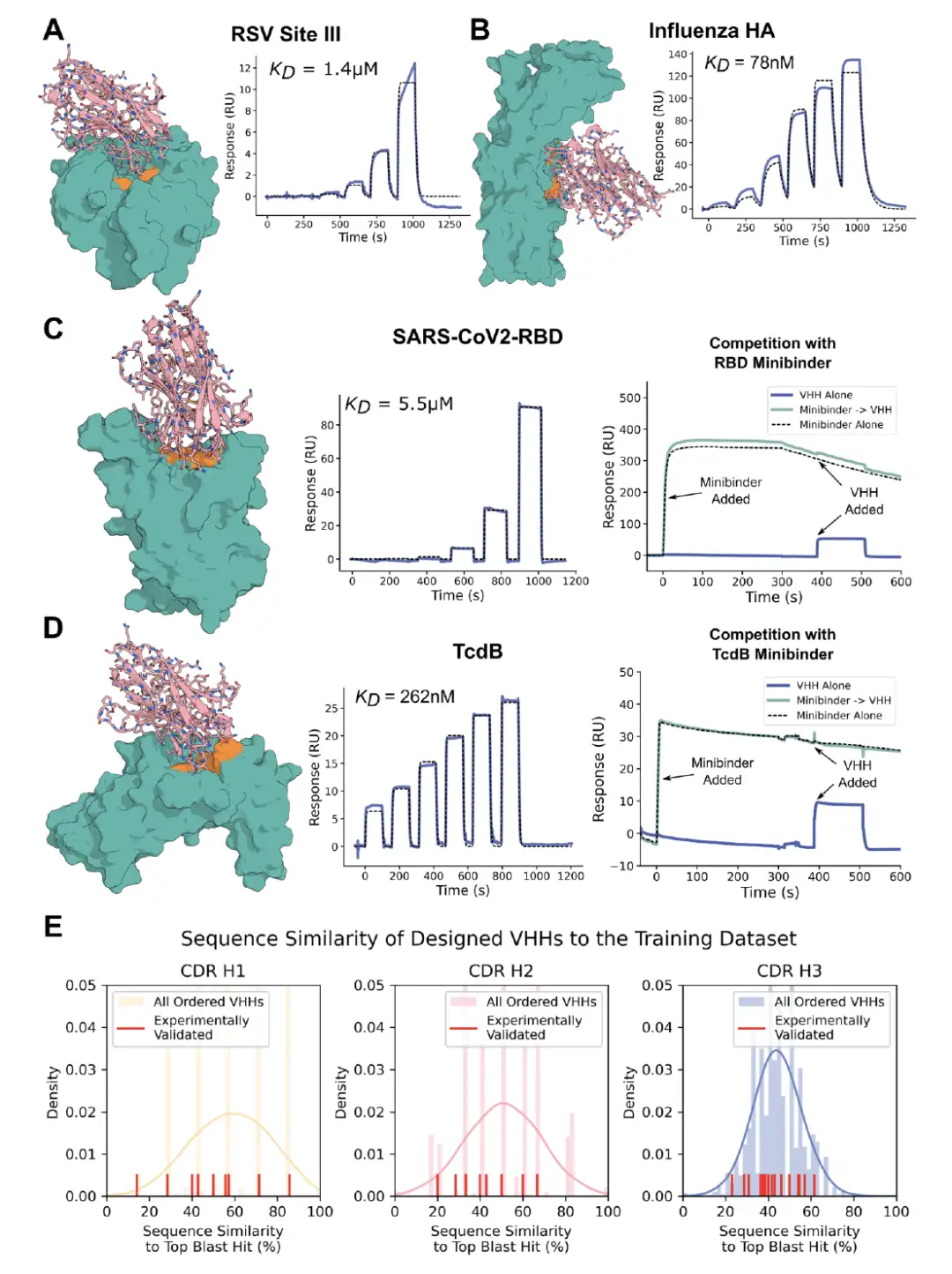
* 図AC: RSV III遺伝子座、インフルエンザHA、RBD、TcdBを標的としたVHH設計の試験結果
* 図E: VHH設計とトレーニングデータセットの違い
研究者らはさらに、RFdiffusion が単一鎖可変フラグメント scFv 形式で重鎖と軽鎖を設計する能力を調査しました。 VHH とは異なり、scFv の設計はより複雑で、重鎖と軽鎖の両方で 6 つの CDR すべてとそれらのドッキング パターンを構築する必要があります。しかし、scFv の遺伝子合成には課題があります。一方では、scFv 配列は長く、従来のオリゴヌクレオチドペアを使用して組み立てるのが困難です。他方では、scFv は配列相同性が高く、特定のペアリングが困難です。
この目的のために、研究者らは重鎖と軽鎖の構築を達成するための段階的な組み立てプロトコルを開発しました。これらは、設計モデルごとに具体的に組み合わせることも、同様のターゲット結合モードを持つ設計のサブセットで組み合わせて混合することもできます。実験結果では、異なる設計の重鎖と軽鎖のペアを組み合わせて生成された新しい scFv が、元の設計と同様の頻度で標的エピトープに結合できることが示されました。さらに、同じ結合方向を持つ設計されたアンサンブルでは、重鎖と軽鎖の CDR が異なる領域と相互作用し、構造精度を失うことなく組み合わせることができますが、ランダムなペアリングでは予測された結合剤が生成されることはほとんどありません。
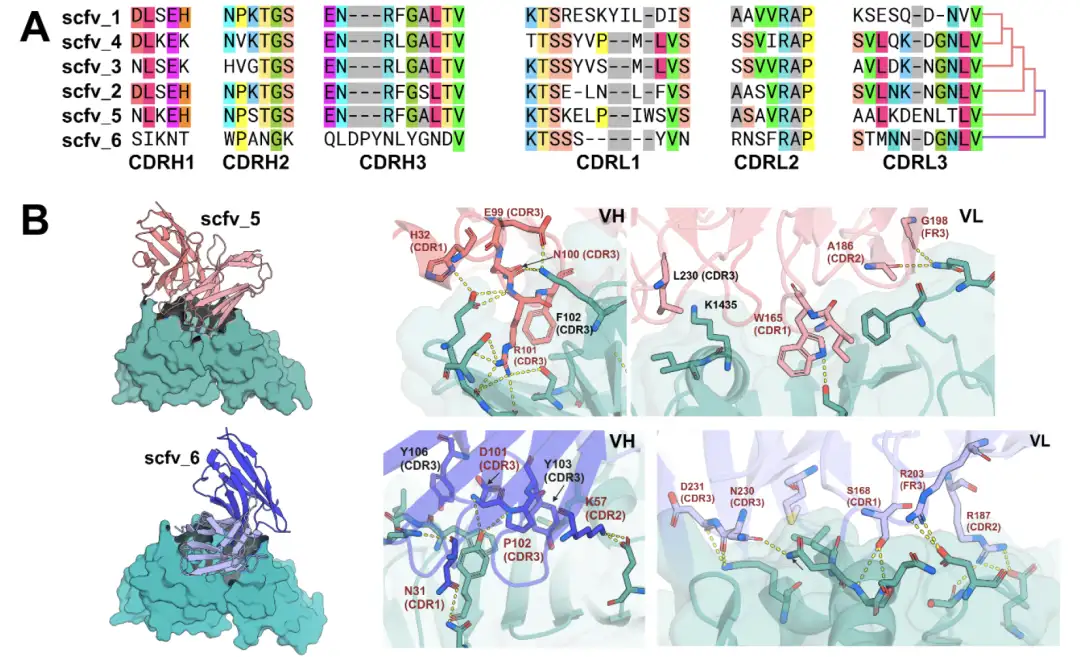
* 図A: TcdBに結合する6つのscFvの多重配列アライメント
* 図 B: AlphaFold3 による scFv5 と scFv6 の TcdB 受容体結合ドメインとの複合体構造の予測
デビッド・ベイカー: 抗体とRF拡散の進化
この研究は、実はデビッド・ベイカー氏の研究結果の氷山の一角に過ぎません。実際、計算生物学の最前線で、デビッド・ベイカー氏のチームは、人工知能主導のタンパク質設計を通じて、ウイルスの標的化から病気の治療まで、一連のブレークスルーを達成しました。

その中で、RF拡散モデルは抗体医薬品開発のパラダイムを変える重要な基盤となっています。 2021 年、David Baker 氏のチームは AlphaFold2 フレームワークに基づいて RosettaFold を開発しました。その中核的な機能は、既知のタンパク質の 3 次元構造を予測することに限られています。
* RoseTTAFoldオープンソースアドレス:
https://github.com/RosettaCommons/RoseTTAFold
研究チームはすぐに、本当の革命は「再生」ではなく「生成」にあることに気づきました。そこで彼らは拡散モデルとタンパク質折り畳みアルゴリズムを組み合わせ、2023年に第一世代のRFdiffusionを発売しました。このモデルはリバースエンジニアリングの鍵を得るようなものです。従来の方法では、アミノ酸配列から構造を推測する必要があります。RF拡散は、標的の機能要件に基づいて、逆に新しいタンパク質骨格を生成することができます。初期のテストでは、インフルエンザのヘマグルチニンに結合するナノボディの設計に成功しましたが、生成された抗体のCDRループ領域には依然として構造上の偏差があり、クライオ電子顕微鏡検査では結合界面で1.2Åの二乗平均平方根偏差が示されました。
* 紙のアドレス:
https://www.science.org/doi/10.1126/science.abj8754
この制限により、2024 年に重要なアップグレードである動的拘束システムが導入されました。研究チームは、抗原-抗体結合部位の物理的および化学的パラメータ制約をモデルに追加し、生成プロセスで構造安定性を考慮するだけでなく、分子間の動的相互作用もシミュレートできるようにしました。
アップグレードされたRF拡散は、新型コロナウイルスのスパイクタンパク質抗体の設計において非常に優れた性能を発揮しました。構築された柔軟なリング構造は、ウイルス表面の保存されたエピトープを正確に固定し、実験によって検証されました。その結合親和性は0.8nMに達し、これは天然抗体の15倍の強さです。さらに注目すべきは、このモデルが「創薬不可能な」標的への挑戦を開始していることです。IL-23 受容体用に設計された小型抗体には 58 個のアミノ酸しか含まれていませんが、80°C の高温とペプシン環境でも活性を維持できるため、初めて抗体の経口投与が実現しました。
* 紙のアドレス:
https://www.biorxiv.org/content/10.1101/2024.03.14.585103v2
2025年、RF拡散はマルチモーダル融合段階に入りました。研究チームは、単一細胞配列データとクライオ電子顕微鏡構造ライブラリを統合し、患者の免疫レパートリー特性に基づいてモデルが個別抗体を直接カスタマイズできるようにしました。最新の症例では、薬剤耐性肺がんの患者に腫瘍の新抗原が体内に注入された。RF拡散により36時間以内に12種類の候補抗体が生成され、そのうち3つはオルガノイドモデルで顕著な腫瘍殺傷効果を示しました。このモデルはもはや抗体の設計に限定されず、深海バライトスコピー細菌の機械感受性イオンチャネルをヒト抗体と融合して腫瘍微小環境の pH の変化を感知できるスマートドラッグを作成するなど、種間タンパク質要素の合成を研究しています。
* 紙のアドレス:
https://www.nature.com/articles/s41586-024-08393-x
RFdiffusion は「タンパク質 3D プリンター」から「生命機能設計者」へと変貌を遂げ、合成生物学の境界を再定義していることがわかります。さらに興味深いのは、この進化がまだ終わりに近づいておらず、抗体技術の革新がバイオメディカル分野を新たな高みへと押し上げていることです。








