Command Palette
Search for a command to run...
成功率は 100% に達する可能性があります。医薬品開発会社である Cellarity は、強化学習に基づいてターゲティング分子を最適化するために NVIDIA と提携しました。

古代から現在に至るまで、人類は病気との闘いをやめることはありません。新薬の登場により、何千人もの命が救われ、さらには人類の寿命が延びる可能性もあります。
1世紀にわたる医薬品の研究開発の歴史を振り返ると、興味深い話がたくさんあります。たとえば、19世紀初頭、ゼルティナという名前のドイツ人薬剤師助手は、アヘンを熱湯に浸し、アンモニアで抽出し、アヘンから大量の白い粉末を分離しました。彼はこの白い粉を犬に与えると、犬はそれを食べた後すぐに気を失い、地面に倒れました。そこで彼は、ギリシャの夢の神モルフェウスにちなんでモルヒネと名付けました。したがって、モルヒネは一般に植物から単離された世界初の有効成分であると考えられており、現代の医薬品革新の出発点とも考えられています。
その後、薬剤師は化学薬品を合成する技術を徐々に習得し、ドイツの薬剤師セルマンがアスピリンの前身であるアセチルサリチル酸を合成しました。 20世紀初頭、新薬に対する企業の需要により、ハイスループットのスクリーニング技術の開発が促進され、科学者が多数の化合物をより効率的にスクリーニングおよび試験できるようになりました。 21世紀初頭、研究者は、より正確で効果的な薬物治療法の探索を開始しており、その中でも標的薬物が注目の研究方向となっています。
今日、人工知能技術の急速な発展により、創薬に新たな可能性がもたらされています。 AI は、製薬科学者が薬物標的を検証し、薬物構造設計をより迅速に最適化するのに役立ち、さらには特定の物理化学的特性や生物学的活性を持つ分子を直接生成して創薬を大幅に加速することもできます。
この文脈では、ライフ サイエンス企業 Cellarity と NVIDIA の研究者は共同で、潜在強化学習に基づく新しい標的分子最適化手法 MOLRL を提案しました。この手法では、大規模な化学データセットで事前トレーニングされた強力な生成モデルと最先端の強化学習 (RL) アルゴリズムを組み合わせて、継続的な空間最適化を実現します。この手法を創薬関連のタスクに適用し、一般的なベンチマークを使用し、最先端の手法と比較することにより、研究者らは、MOLRL がさまざまなタスク、特に標的分子の生成や複数のタスクにおいて優れた、または競合するパフォーマンスを示したことを発見しました。最適化の側面。
関連する結果は、「潜在強化学習による標的分子生成」というタイトルで ChemRxiv に公開されました。
用紙のアドレス:
公式アカウントをフォローし、バックグラウンドで「Targeted Molecule Optimization」に返信すると完全な PDF が表示されます
オープンソース プロジェクト「awesome-ai4s」は、100 を超える AI4S 論文の解釈をまとめ、大規模なデータ セットとツールを提供します。
https://github.com/hyperai/awesome-ai4s
ルートの選択: 分子を直接変更するか、潜在空間で操作するか
医薬品開発は非常に複雑なプロセスです。臨床医薬品候補として選択される化合物は、生物学的に活性であることに加えて、その他の複数の特性を備えている必要があります。治療活性があると特定された化合物(しばしば「候補化合物」と呼ばれます)の構造は静的なものではなく、不十分な溶解性や不十分な活性などの問題を解決するために長い反復サイクルで変更されます。
反復プロセスでは、薬学者は多くの場合、直感または反応ベースのライブラリーによる列挙に基づいて、最初の分子を変換して類似体を設計します。しかし、化学空間は非常に大きいため、単一分子であっても設計は非常に難しく、化学空間全体を網羅的に評価する必要があります。標的分子を生成するための計算手法は、化学空間を効率的に探索し、これまで探索されていない構造を化学者に示唆することができます。
現在、標的分子の生成および最適化方法は、次の 2 つの大きなカテゴリに分類できます。1 つ目のタイプの方法は、分子構造に直接作用するものです。ターゲットの特性を改善する構造修飾を特定するため。2 番目のカテゴリのメソッドは、生成モデルの潜在空間で動作します。分子構造を、その基礎となる表現を通じて間接的に変更します。
方法 1 では、原子または化学結合を挿入または削除することで構造を変更できます。この業界はすでに大きな進歩を遂げています。
昨年11月、韓国科学技術院(KAIST)のユンス・パク教授率いるチームが革新的な単一原子編集技術を開発したと報じられた。この技術は光触媒を導入し、常温常圧下での薬物分子の単一原子編集に成功。同チームが開発した「分子ハサミ」技術は、五員環構造を正確に切断して接続し、酸素原子を窒素原子に置き換え、分子の性質を変化させ、薬の効果を高めることができる。関連する研究結果は、「光触媒によるフランからピロールへの変換」というタイトルで Science 誌に掲載されました。

しかし、気軽に分子を「操作」するのは簡単ではありません。一方で、構造修飾は化学規則に違反し、無効な分子構造を引き起こす可能性があります。一方で、分子構造は本質的に離散的であり、化学結合の追加または削除には離散的な操作が含まれるため、この離散性により最適化プロセスで不連続な勾配が生じ、勾配ベースの手法を効果的に適用することが困難になります。
方法1と比べて、方法 2 では、最適化タスクを連続最適化問題に変換し、生成されたモデルの潜在空間を利用し、勾配降下法などの連続空間最適化アルゴリズムを採用します。それにもかかわらず、潜在空間内の特定の点が有効な分子に対応するという保証がないため、化学的妥当性は依然として課題です。ただし、新しいアーキテクチャの使用とトレーニングの変更により、生成モデルは潜在空間の有効性と連続性の向上において大幅な進歩を遂げました。
Cellarity と NVIDIA の研究では、研究者らが提案した MOLRL は、近似ポリシー最適化 (PPO) 手法を使用して、事前学習済みの生成モデルの潜在空間で最適化します。
潜在強化学習に基づく標的分子最適化手法MOLRL
MOLRL フレームワークはどのように機能しますか?
MOLRL フレームワークは、潜在空間生成モデルと強化学習 (RL) エージェントの 2 つの部分に分かれています。
生成モデルは、事前にトレーニングされたエンコーダー デコーダー モデルであり、その潜在空間は RL エージェントが動作する化学空間をエンコードします。 RL エージェントは PPO メソッドを使用してトレーニングされます。潜在空間内を移動する; 報酬関数はエージェントにフィードバックを提供します。宇宙での移動方法を学ぶのを手助けし、目的の特性を持つ分子を特定します。
以下に示すように、入力分子の潜在表現「z」は、ポリシー ネットワーク出力から抽出されたアクション「a」によって摂動されます。摂動された潜在ベクトル「z'」は分子にデコードされ、報酬関数を介してスコア付けされます。状態「z」、アクション「a」、報酬「R」が収集され、ポリシー ネットワークの更新に使用されます。
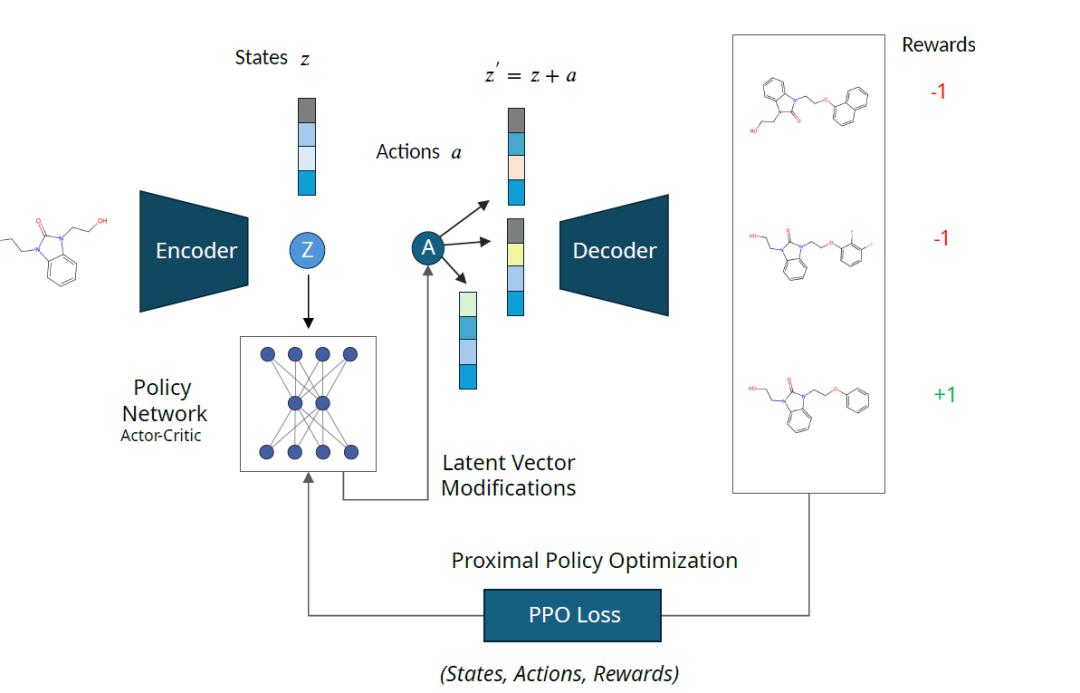
このフレームワークはエンコーダとデコーダのアーキテクチャには依存しませんが、潜在空間の特性は最適化パフォーマンスに大きく影響します。したがって、研究者らは、2 つの異なるエンコーダ/デコーダ アーキテクチャ、つまり変分オートエンコーダ (VAE) と相互情報機械学習 (MolMIM) に基づいてトレーニングされたオートエンコーダで MOLRL のパフォーマンスを評価しました。
強化学習 (RL) エージェントは、潜在空間内を移動して、目的の分子特性を持つ分子を特定する役割を果たします。研究者らは、PPO (近接ポリシー最適化アルゴリズム) を使用して RL エージェントを訓練しました。PPO アルゴリズムは、潜在空間で最適なパスを見つけるようにエージェントを導く戦略を最適化することで、長期的な累積報酬を最大化します。報酬関数は MOLRL フレームワークの中核であり、分子の標的特性 (薬物の類似性、合成の利用可能性、標的の結合など) に基づいてエージェントにフィードバックを提供します。
MOLRL フレームワークはどのように機能しますか?
MOLRL フレームワークのパフォーマンスを評価するために、研究者らは多目的最適化タスクを設計し、それを現在の最先端の最適化手法と比較しました。
具体的には、研究者らは MOLRL を適用して、薬物類似性 (QED) と合成アクセス可能性 (SA) を最適化しながら、2 つの標的を標的とする生物活性分子を生成しました。選択された生物学的標的は、アルツハイマー病に関連する 2 つのキナーゼ、GSK3β および JNK3 でした。 Jinらの評価戦略に従って、研究者らは最適化プロセス中に生成された最高の報酬値を持つ上位5,000分子を記録し、次の3つの指標を計算した。
次の表は、VAE-CYC 潜在空間でトレーニングされた MOLRL と MolMIM 空間でトレーニングされた MOLRL のパフォーマンス、および文献で報告されている現在の最先端の分子最適化手法のパフォーマンスの比較を示しています。
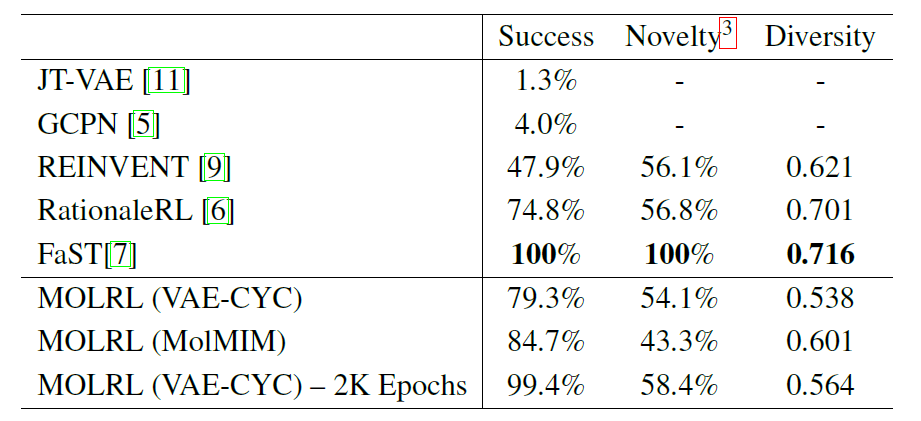
表のデータに示すように、FaST は強化学習 (RL) を使用して分子フラグメントを組み合わせて分子グラフを構築します。比較したすべての方法の中でより高い成功率を示しました。 FaST と RationaleRL には多様性と新規性という点で利点があり、どちらの方法も事前知識を活用しています。 REINVENT と MOLRL は両方とも、ML 分類器のトレーニング範囲から遠く離れている可能性があるランダムな分子から開始しますが、MOLRL は依然として RationaleRL に匹敵する新規性を達成しており、最高の成功率を達成しています。
出発点として事前の知識を使用すると、一定の利点がもたらされる可能性がありますが、新規性や新しい足場を発見するアルゴリズムの能力も制限される可能性があります。さらに、未踏のターゲットを研究する場合など、事前知識が利用できない場合、そのような方法の適用可能性は制限されます。
多目的最適化タスクに加えて、創薬における一般的な手法は、特定の標的または標的クラスに結合することが知られている化学足場を特定し、これを化学設計および最適化の開始点として使用することです。したがって、この論文では、特定の分子骨格を維持しながら多目的特性を最適化する MOLRL の能力をさらに検証しました。以下の表に示すように、MOLRL は、アミノピリミジン骨格を含む分子を最適化する際に 100% の成功率を達成しました。
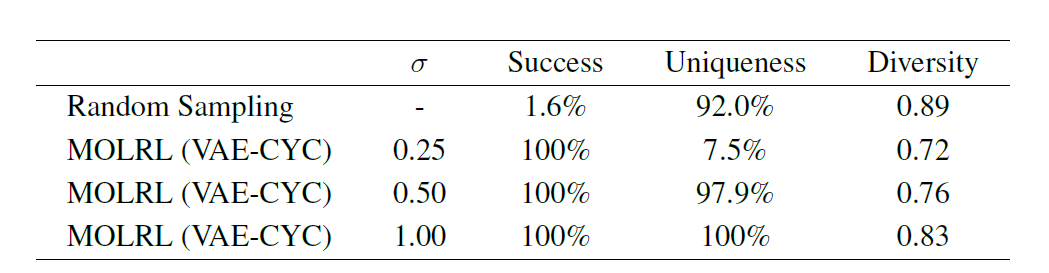
要約すると、MOLRL はさまざまなタスクにおいて既存の手法と比較して優れた、または競合するパフォーマンスを示します。特に標的分子の生成と複数パラメータの最適化に最適です。
AI は創薬の効率を向上させるための重要なステップです
新薬の開発にはどれくらいのリソースがかかりますか?製薬業界には有名な「ダブルテンの法則」があります。これは、新薬が発見されてから上市されるまでに10年と10億米ドルがかかることを意味します。デロイトが発表した最新のレポートによると、失敗した臨床試験のコストを含めると、世界トップの製薬会社が新薬の市場投入に成功するまでの平均コストは次のようになります。2010年の11億8,800万米ドルから2022年には22億8,400万米ドルに増加しました。
創薬における重要なステップは、計算研究または合成および特性評価のための候補分子のバッチを発見することです。これは、潜在的な分子の化学空間が膨大であり、非常に高い試行錯誤コストを必要とするため、困難な作業です。現在、人工知能と機械学習により、このステップの効率を効果的に向上させることができます。
2023年10月31日Novartis Institutes for BioMedical Research と Microsoft Research の科学インテリジェンスセンターの研究者間のコラボレーションにより、「嗜好機械学習による医薬品化学の直観の抽出」というタイトルの研究論文をNature Communications誌に掲載しました。
研究者らは、35人の医化学者にそれぞれ5,000組の分子から好みの分子を選ぶよう依頼し、その回答を使って機械学習モデルをトレーニングするためのランキングゲームを作成し、モデルに分子のスコアを付けるよう依頼した。このスコアは、業界内で長年にわたって蓄積された知識から得られるため、これまでにこの分野を特徴づけてきた他の特性の影響をほとんど受けません。
このモデルは、プロの化学者が仕事で蓄積した集合的な知識 (しばしば「化学の直観」と呼ばれます) を部分的に再現することができ、それによって将来の医薬品開発をより効率的にすることができます。
2024 年 3 月、大手 AI 製薬会社である Insilico は、Nature Biotechnology に科学研究論文を発表しました。この論文では、人工知能プラットフォームを使用して IPF 治療の新しい標的である TNIK を発見し、その後生成化学を使用するプロセス全体が詳しく説明されています。 ISM001-055分子を設計するためのプラットフォーム。
ISM001-055 は世界初の小分子阻害剤です。特発性肺線維症 (IPF) の治療のための TNIK (Traf2/NCK 相互作用キナーゼ) の標的化。インシリコン・インテリジェントは、生成AIは研究開発の効率を大幅に向上させ、研究開発コストを削減し、研究開発の初期段階での研究開発の成功率を向上させることができると述べた。特発性肺線維症に対する分子を例として、早期の標的発見から前臨床候補化合物の同定まで、所要時間はわずか 18 か月で、研究開発費として 260 万米ドルを投資しました。
Fortune Business Insights の調査レポートによると、創薬における人工知能の世界市場規模は 2022 年に 30 億米ドルとなり、年平均成長率で 2023 年の 35 億 4000 万米ドルから 2030 年には 79 億 4000 万米ドルに成長すると予想されています。 1.22%の。将来的に、AI テクノロジーは製薬業界に変化をもたらす大きな可能性を秘めています。
参考文献:
1.https://mp.weixin.qq.com/s/OL7TJQcUE-ubhUDyc7GBzQ
2.https://www.thepaper.cn/newsDetail_forward_29097303
3.https://news.bioon.com/article/6127e7234091.html
4.https://bydrug.pharmcube.com/news/detail/49720140c1e9d57ac3c7cfe20ef7f8be
5.https://mp.weixin.qq.com/s/UGAXWMhPlSg2hFnI5ghr1w









