Command Palette
Search for a command to run...
Natureサブマガジンに掲載されました!中華師範大学は、AI を使用して分子断片を正確にセグメント化し、44 個の薬物/農薬分子を生成する DigFrag を提案しました。

過去数十年にわたり、フラグメントベース創薬(FBDD)では、標的タンパク質と弱い相互作用を持つ小分子フラグメントを特定し、これらのフラグメントの構造情報を最適化することで、より高い活性を持つリード化合物を開発し、新しい薬の開発に役割を果たすことができました。薬は重要な役割を果たしました。
FBDD は創薬と開発の分野で重要な役割を果たしていますが、効率的な分子フラグメント ライブラリーの構築とスクリーニングはこの分野での大きな課題でした。従来の FBDD 手法は経験的な直観に依存しているため、多様な構造を開発する能力が制限されています。幸いなことに、AI の出現により、この課題に対する革新的なソリューションが提供されます。
最近、中華師範大学のYang Guangfu教授とWang Fan准教授のチームは、DigFragと呼ばれるデジタルセグメンテーション手法を開発しました。この方法では、分子グラフに局所的に焦点を当て、これらの部分構造をフラグメントにセグメント化することで、重要な部分構造を強調表示します。実験結果は、DigFrag によってセグメント化されたフラグメントがより高い構造多様性を示し、これらのフラグメントに基づいて生成された化合物が予想される化学的特性とより一致していることを示しています。これは、AI 手法を使用して生成されたデータが、AI モデルのトレーニングとアプリケーションにより適している可能性があることを示しています。
この研究は「人工知能ベースの医薬品設計に使用されるデジタルフラグメンテーション手法としてのDigFrag」と題され、国際学術雑誌「nature communication Chemistry」に掲載された。
研究のハイライト:
* DigFrag に基づいてセグメント化されたフラグメントを AI モデルと組み合わせると、目的の特性を持つ分子を効果的に生成できることが研究で判明
* この研究では、精密なスクリーニングにより最終的に 24 個の薬物分子と 20 個の農薬分子を同定しました
* チームは、複数の断片化テクノロジーを統合して、より広範囲の分子分析と設計作業をサポートするユーザーフレンドリーなプラットフォームである MolFrag を開発しました。
用紙のアドレス:
https://doi.org/10.1038/s42004-024-01346-5
オープンソース プロジェクト「awesome-ai4s」は、100 を超える AI4S 論文の解釈をまとめ、大規模なデータ セットとツールを提供します。
https://github.com/hyperai/awesome-ai4s
データセット: 3,000 近くの医薬品データを含む自己構築データベース PADFrag
この研究で使用されるモデリング データ セットは、主に独自に構築されたデータベース PADFrag から取得されます。具体的には、PADFrag データベースには主に、DrugBank データベースの FDA 承認医薬品リスト (1,652 種類の医薬品が含まれる) と、Alan Wood がリストした市販の農薬の合計 1,259 種類が含まれています。
*PADFrag、創薬のための生物活性フラグメント空間を探索するために構築されたデータベース
https://pubs.acs.org/doi/10.1021/acs.jcim.8b00285
データの一貫性と信頼性を確保するために、研究チームは非標準構造を持つ化合物を除外しました。その後、モデルのトレーニング、評価、テストを容易にするために、データ セット全体が 8:1:1 の比率でトレーニング セット、検証セット、テスト セットに分割されました。
DigFrag: より高い構造多様性を持つフラグメントを取得するための 3 ステップのワークフロー
DigFrag は、グラフ アテンション メカニズムを使用して薬物/農薬のフラグメントを特定およびセグメント化する革新的なデジタル セグメンテーション手法であり、その主な利点は、人間の知識のみに依存するのではなく、機械知能の観点から開始できることです。構造的な多様性。
さらに、この研究では、BRICS、RECAP、MacFrag、DigFrag の 4 つの方法でセグメント化されたフラグメントを DeepFMPO モデル フレームワークに統合して、薬物分子を生成し、さまざまな指標でのパフォーマンスを評価しました。
最後に、研究者らは、さまざまな分子断片化技術に基づいて、分子の断片化作業をサポートするユーザーフレンドリーなプラットフォーム MolFrag を開発しました。
具体的には、この調査のワークフローは 3 つの部分に分かれています。
まず、AI ベースの断片化手法:この研究は、グラフ ニューラル ネットワーク (GNN) アーキテクチャに基づいており、DigFrag メソッドを使用して分子をフラグメント化します。
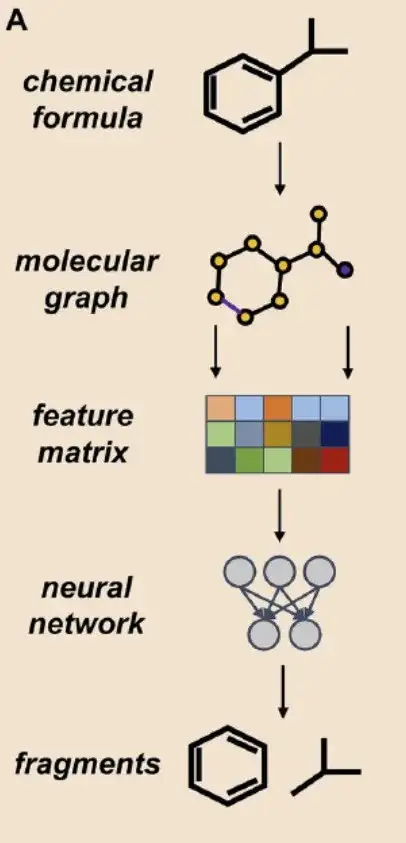
上の図 A に示すように、研究者は分子グラフを G=(V, E) と定義します。ここで、V は分子内の原子に対応するノードを表し、E は原子間の化学結合に対応する接続エッジを表します。このプロセスでは、グラフ アテンション メカニズムの特徴抽出ネットワーク (特徴マトリックス) に基づいて、原子ごとに個別の埋め込み表現を取得するために、元の分子グラフが最初に一連のアテンション レイヤー (アテンション レイヤー) に入力されます。これらのアトミックな埋め込みは集約されて、スーパー ノードとも呼ばれる統一ベクトルを形成します。最後に、さらなる注目層処理を通じて、フラグメント全体の埋め込み表現が取得されます。
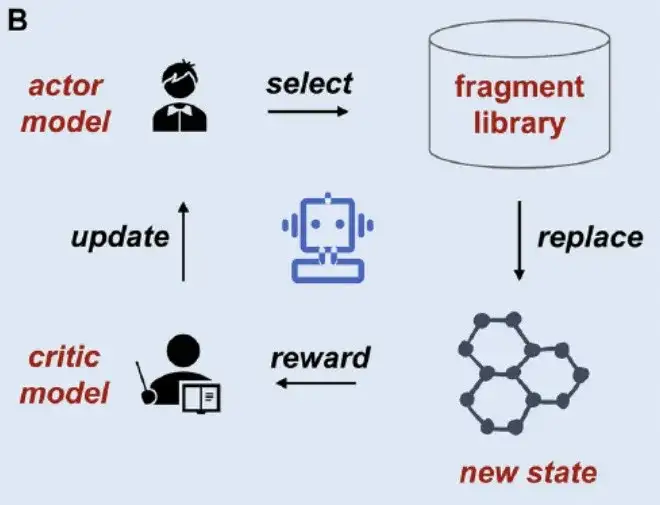
第二に、Actor-Critic モデルのフレームワーク: 以下の図 B に示すように、フラグメントベースの深層生成モデルに対するデジタル セグメンテーションの影響をさらに明確にするために、研究者らは、BRICS、RECAP、MacFrag、DigFrag の 4 つの方法でセグメント化されたフラグメントを統合し、オープンソースのフラグメントベースの強化学習手法である 2 次元分子生成ツール DeepFMPO のアーキテクチャを研究しました。
*DeepFMPO は、化合物内のフラグメントを置き換えることによって目的の化合物を取得する Actor-Critic 強化学習モデルです。
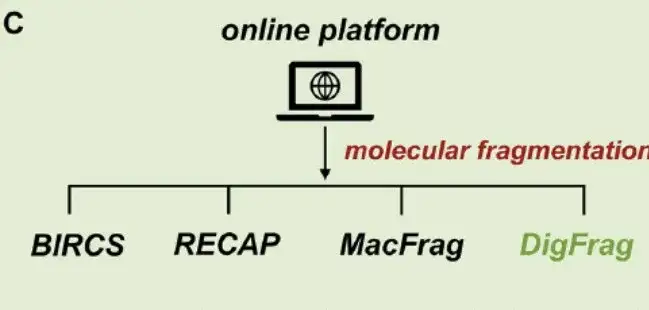
第三に、オンライン プラットフォームを確立します。さまざまな分子断片化手法が存在しますが、操作が簡単なオンライン サーバーが不足しています。そこで、上の図 C に示すように、この研究ではさまざまな断片化技術に基づいたユーザーフレンドリーなプラットフォーム MolFrag を開発しました。このプラットフォームは、BRICS、RECAP、MacFrag、DigFrag の 4 つの分子断片化手法をシームレスに組み合わせており、あらゆるレベルの専門知識の研究者が確実に使用できるようにしています。
MolFrag プラットフォームのアドレス:
https://dpai.ccnu.edu.cn/MolFrag
研究結果: DigFrag により多様性の高い分子断片をセグメント化
DigFrag の分割フラグメントには多数の回転可能なキーがあります
研究ではまず、薬物と農薬の断片を正確にセグメント化するためにモデルをトレーニングしました。次に、研究者らは、DigFrag のモデル精度、曲線下面積 (AUC)、およびマシューズ相関係数 (MCC) と、従来の (RECAP、BRICS) および最新の (MacFrag) 方法で取得されたフラグメントとの詳細な比較を 5 つの方法で実施しました。 - 3 つの主要なパフォーマンス指標の相互検証。以下の表に示すように、薬物フラグメントのプロパティ分布の観点からは、DigFrag によってセグメント化されたフラグメントは BRICS によってセグメント化されたフラグメントにより類似しています。
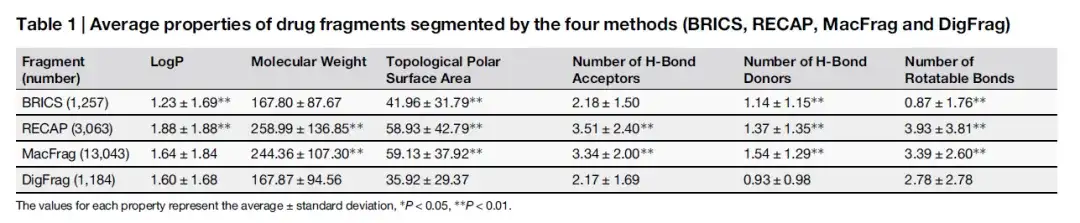
以下の表に示すように、DigFrag でセグメント化された薬物フラグメントの分子量 (Molecular Weight) と H-Bond Acceptor の数は BRICS でセグメント化されたフラグメントと類似していますが、回転可能な結合の数 (Number of Rotatable Bonds) が異なります。これは、その独特の環構造破壊方法に関連している可能性があります。農薬フラグメントに関しては、DigFrag によってセグメント化されたフラグメントの平均分子量が低くなりました。
DigFrag セグメント化されたフラグメントはより高い構造多様性を持っています
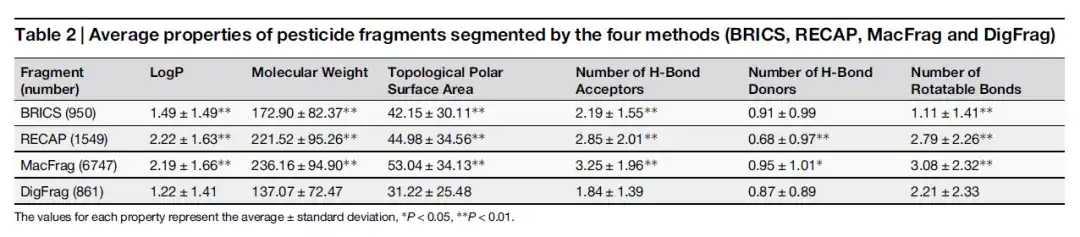
この研究は、DigFrag 法を従来の方法 (RECAP および BRICS) および最先端の方法 (MacFrag) と比較する際に、セグメント化されたフラグメントの構造的多様性を評価することに焦点を当てました。結果は、DigFrag によってセグメント化された薬物および農薬のフラグメントは、他の 3 つの方法 (それぞれ 9.97%-21.37% および 8.94%-15.20%) よりも重複率が低く、ユニークなフラグメントを生成できることを示しています。また、MacFrag は BRICS と RECAP の断片のほとんどをカバーしており、完全に革新的ではなく、従来の手法の拡張であることを示唆しています。

研究者らはまた、t-SNE アルゴリズムを使用して化学物質の空間分布を視覚化しました。以下の図に示すように、DigFrag は、特に類似性のしきい値が 0.4 および 0.6 の場合に、フラグメント クラスタリング率において優れたパフォーマンスを発揮し、より高い構造多様性を示しています。
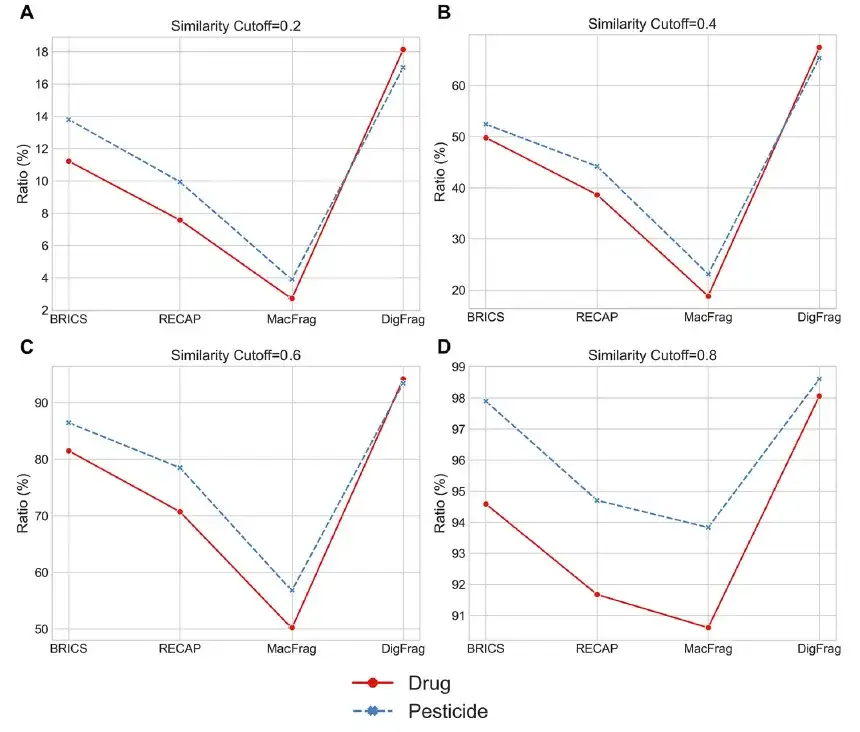
DigFrag ベースのモデルはより高品質の分子を生成します
この研究では、MOSES ベンチマーク プラットフォーム上で、さまざまな生成モデルのパフォーマンスを比較しました。以下の 2 つの表に示されているように、DigFrag に基づくモデルはフィルター スコアで 0.828 に達し、より高い安全性を示しています。これは、フラグメンテーション プロセス中のディープ ラーニングの毒性と安定性が包括的に考慮されていることに起因すると考えられます。
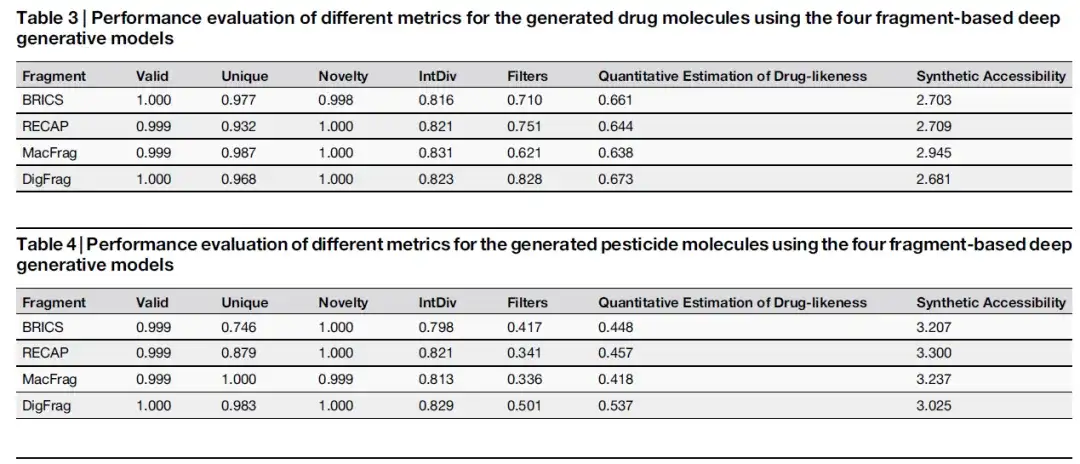
以下の図に示すように、農薬分子に関しては、DigFrag ベースのモデルによって生成された分子フラグメントは、SMILES の有効性、新規性、骨格の多様性、および構造アラートの点で優れたパフォーマンスを発揮します。さらに、DigFrag モデルによって生成された薬物および農薬の分子フラグメントは、定量的推定の平均分析 (QED) および合成アクセス可能性 (SA) において他のモデルを上回りました。
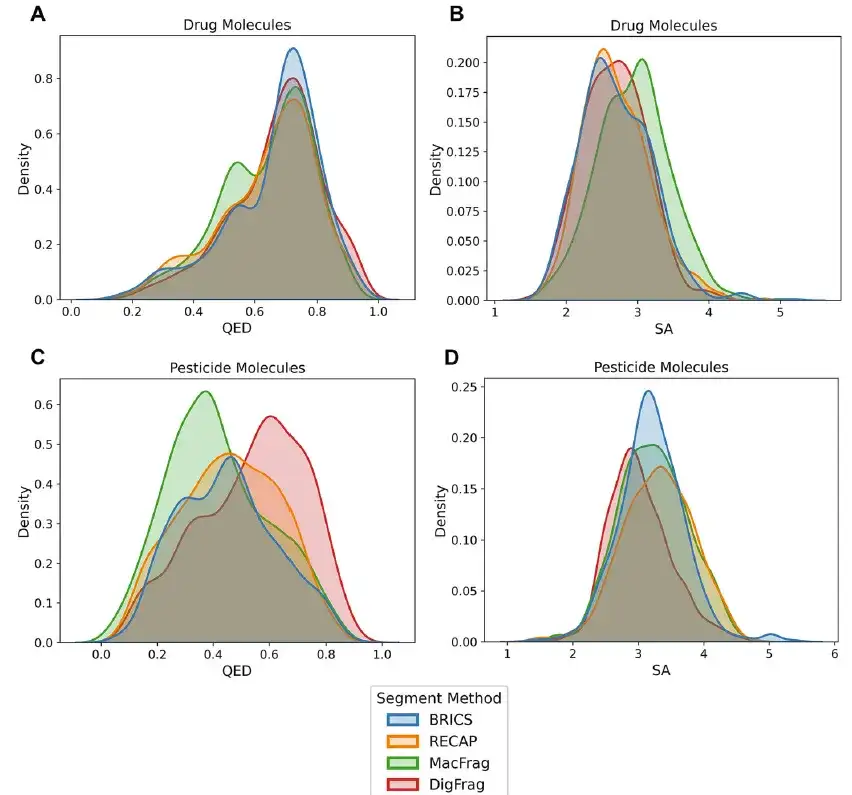
さらに、DigFrag によってセグメント化された分子フラグメントは、分子量、QED、SA 属性分布の点で MOSES データセットと最も高い類似性を示します。これらの結果は、DigFrag モデルがより高品質の分子を生成できると同時に、分子設計における AI ソース データに対する AI モデルの優先性を強調し、この分野における AI テクノロジーの応用利点を強調していることを示しています。
厳選された 44 個の高効率かつ低エネルギーの薬物および農薬分子
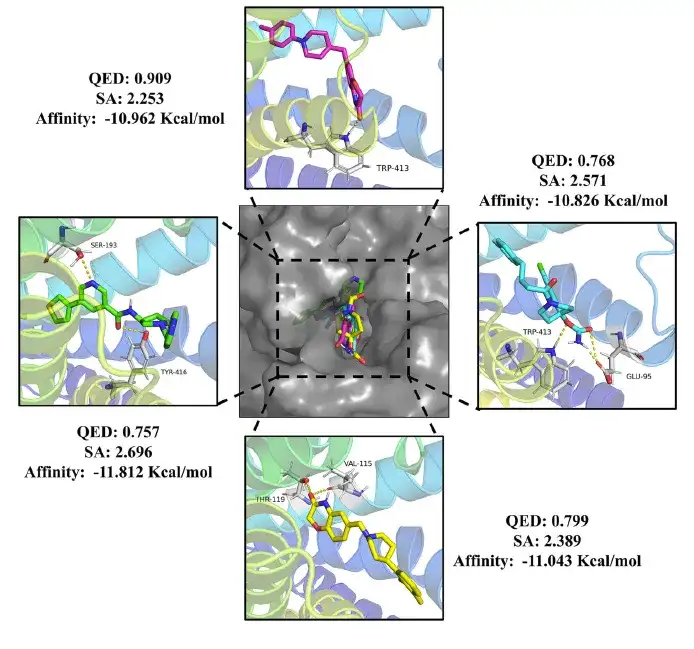
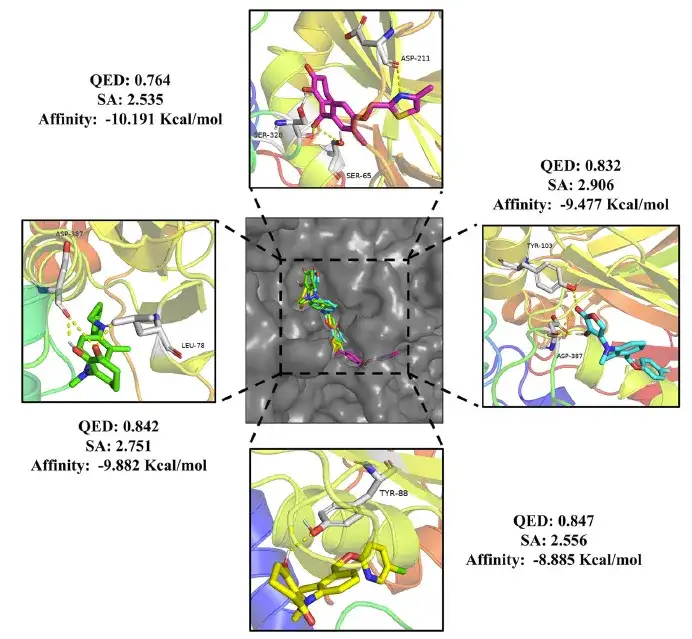
最後に、正確なスクリーニングの後、この研究では24の薬物分子と20の農薬分子が特定され、それらはすべて0.75を超えるQED値、3未満のSA値、およびドンペリドン(-10.7 Kcal/mol)よりも低い結合自由エネルギーを持っていました。 )およびメソトリオン(-8.4 Kcal/mol)標準。
この研究では、これらの分子が標的とどのように相互作用するかをさらに分析しました。以下の図に示すように、この研究では、薬物分子が DRD2 の活性ポケットに効果的に結合し、重要なアミノ酸残基と水素結合を形成できることがわかりました。
それだけでなく、下の図に示すように、農薬分子は HPPD のアミノ酸残基と水素結合を形成することで安定に結合します。陽性薬物と比較して、生成された化合物は異なる結合様式も示しており、異なる薬理学的作用機序が存在する可能性が示唆され、将来の研究に新たな方向性をもたらします。
医薬品研究における AI の応用はゲームのルールを再構築する
現段階では、医薬品研究における AI の応用はますます集中的になっています。 AI モデルは、深層学習ネットワークを通じて複雑な生物学的データと化学構造を分析し、薬物分子の活性と選択性を予測できます。
この記事の研究で言及したYang Guangfu教授とWang Fan准教授のチームは、今年初めに、分子記述子を統合できる、農薬のような特性を予測するためのマルチモーダルディープラーニングアーキテクチャモデルPesti-DGI-Netを共同開発した。 、分子画像および分子マップ これら 3 つの分子表現形式は、化合物の殺虫剤のような特性を予測します。結果は、Pesti-DGI-Net が複数のメトリクスで優れたパフォーマンスを示していることを示しています。
論文リンク:
https://doi.org/10.1016/j.compag.2024.108660
また、最近ではAIが医学研究の分野でも成果を上げています。少し前に、中国科学院上海栄養健康研究所は、薬剤の組み合わせによる相乗効果を予測するためのデュアルビュー深層学習モデル JointSyn を構築しました。結果は、JointSyn が、さまざまなベンチマークにおける予測精度と堅牢性の点で、既存の最先端の手法を上回っていることを示しています。
論文リンク:
https://doi.org/10.1093/bioinformatics/btae604
AI テクノロジーは、薬剤予測への応用に加えて、薬剤設計の最適化、毒物学と安全性の評価、臨床試験の設計、患者の選択などの多くの分野でも重要な研究成果を上げています。医薬品研究における AI の応用は、テクノロジーの継続的な進歩に伴い、医薬品開発のゲームルールを再構築し、予測の精度の向上、医薬品設計の最適化、開発コストの削減により、より良い結果を患者にもたらす可能性があると予測されています。より安全で効果的な治療オプションを提供します。








