Command Palette
Search for a command to run...
DeepMind の新しい結果は広告として批判されていますか? AlphaProteo は、300 倍増加した親和性を持つ標的タンパク質バインダーを効率的に設計します
AlphaFold はタンパク質予測の分野で比類のないものであり、AlphaFold 3 は限界を突破し、あらゆる生命分子の予測を実現しました。発表当時、AlphaFold 3 の構造化された予測と生成により AIDD (人工知能) が加速するという声がありました。 -駆動型ドラッグデザイン、AI駆動型ドラッグデザインの開発)。
本日、DeepMind は AI 医薬品設計に新たな挑戦を行い、新しいタンパク質設計用の AlphaProteo をリリースしました。
Alpha ファミリーのこの新しいメンバーは、実験的にテストされた 7 つの標的タンパク質に関して画期的な機能の向上を実証しただけでなく、より高い実験成功率を達成しました。結合親和性も、既存の最良の方法よりも 3 ~ 300 倍高くなります。同時に研究者らは、それをがんや糖尿病の合併症に関連する標的タンパク質であるVEGF-Aにも応用した。AI ツールを使用した VEGF-A タンパク質バインダーの設計におけるブレークスルーを完了しました。
1 ラウンドのミッドスループット スクリーニングにより、「すぐに使用できる」タンパク質結合剤が生成されます
現地時間9月5日、DeepMindの研究者らは、タンパク質設計のための機械学習モデルであるAlphaProteoを提案した。このモデルは、複雑な手動介入なしで、高い成功率と高い親和性で標的タンパク質バインダーを設計できる。 AlphaProteo は、中スループットのスクリーニングを 1 回行うだけで、多くの研究用途に「すぐに使用できる」タンパク質バインダーを生成するためにさらなる最適化を必要としません。
モデル構造: 生成されたモデルとフィルターを組み合わせて、ターゲットタンパク質バインダーを効率的に生成します。
AlphaProteo には、下図に示すように 2 つのコンポーネントが含まれています。
生成モデル(ジェネレーター)、タンパク質データベース (PDB) の構造と配列データ、および AlphaFold 予測構造の蒸留セットをトレーニングして、分子間の結合方法を学習します。フィルター(フィルター)、生成されたデザインをスコアリングして、実験においてコンジュゲートが標的タンパク質に正常に結合するかどうかを予測するために使用されます。
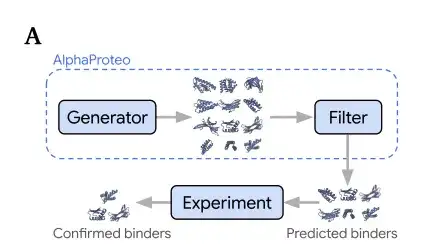
具体的には、標的タンパク質バインダーを設計するために、研究者はまず標的タンパク質の構造を入力し、標的タンパク質エピトープの「ホットスポット」残基を選択し、優先結合位置を推測します。生成されたモデルは、候補バインダー構造を出力します。ターゲットタンパク質と配列フィルター (フィルター) は、実験テスト (実験) の前に、これらの予測されたバインダー (予測されたバインダー) をフィルター処理して、既存の最先端モデルよりも優れたパフォーマンスを示します。最良の方法。
実験の結論: 高い成功率と強い親和性により、既存の最良のソリューションを上回る
研究者らは、AlphaProteo を使用して、異なる構造を持つ標的タンパク質に対する 8 種類の結合剤を設計し、それらについて実験テストを実施しました。その中には、感染症に関連する 2 つのウイルスタンパク質、BHRF1 および SARS-CoV-2 スパイクタンパク質受容体結合ドメイン SC2RBD と、がん、炎症、自己免疫疾患に関連する 5 つのタンパク質、IL-7Rɑ、PD-L1、TrkA、IL-1 が含まれます。 17Aおよび関節リウマチなどの自己免疫疾患に関連するタンパク質TNFであるVEGF-A。
以下の図に示すように、AlphaProteo によって生成された 7 つの標的タンパク質結合剤は、実験テスト中に標的タンパク質にしっかりと結合できます。しかし、8番目の標的であるTNFに対して成功する複合体を設計することはできなかった。
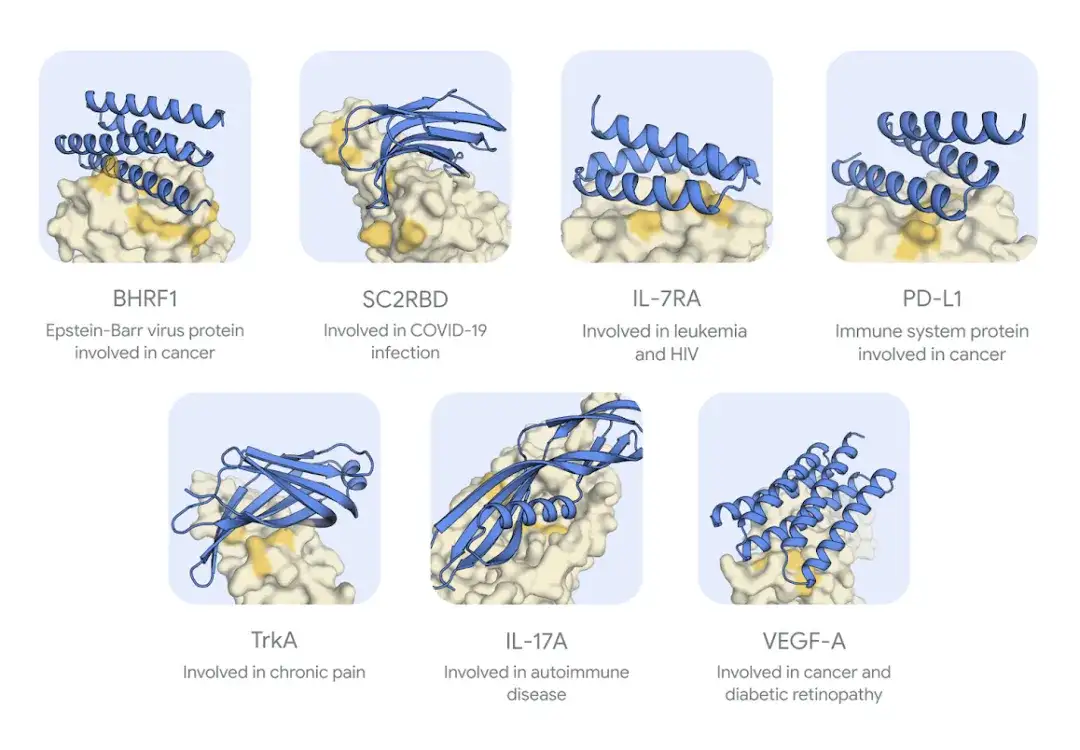
*青は結合剤を示し、黄色はタンパク質ターゲットを示し、濃い黄色は予想される結合領域を示します
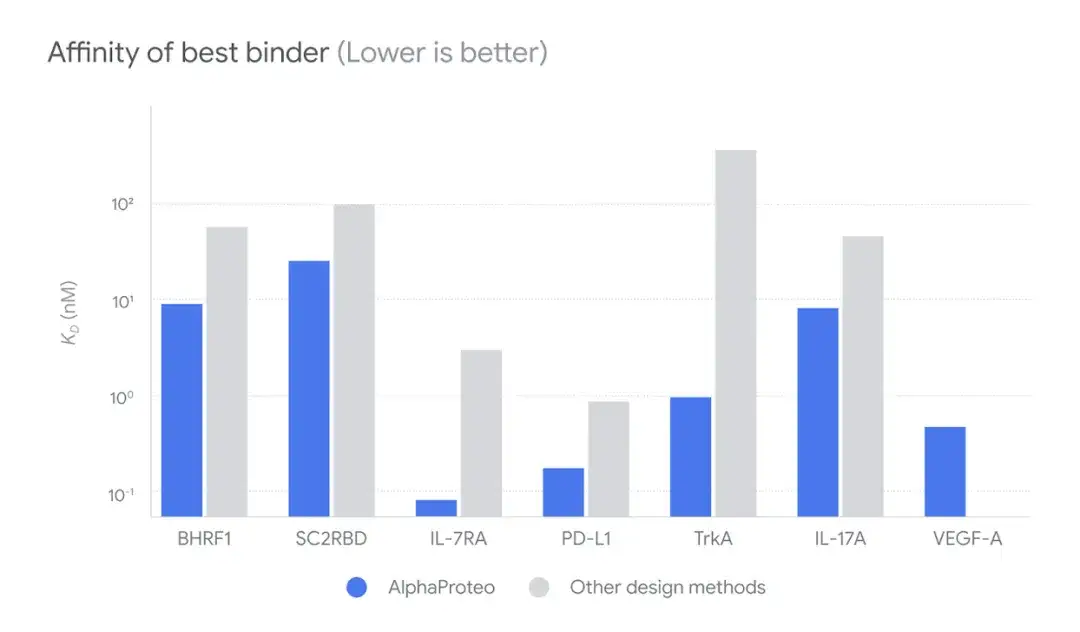
さらに、下図に示すように、研究者らは、AlphaProteo と他の設計法 (Other design Methods) を比較し、in vitro での成功率を比較しました。消す、ウェットラボ試験では、9%-88% 候補複合体は他の方法よりも 5 ~ 100 倍優れた標的タンパク質への結合に成功しました。
その中で、ウイルスタンパク質BHRF1については、AlphaProteoによって生成された候補分子は標的タンパク質への結合率88%を達成し、その結合強度はタンパク質TrkAに対する既存の最良の設計方法の10倍であった。エージェントは、このタンパク質について以前よりも複数回のテストを受けており、実験的に最適化された最適な結合剤はより強力です。
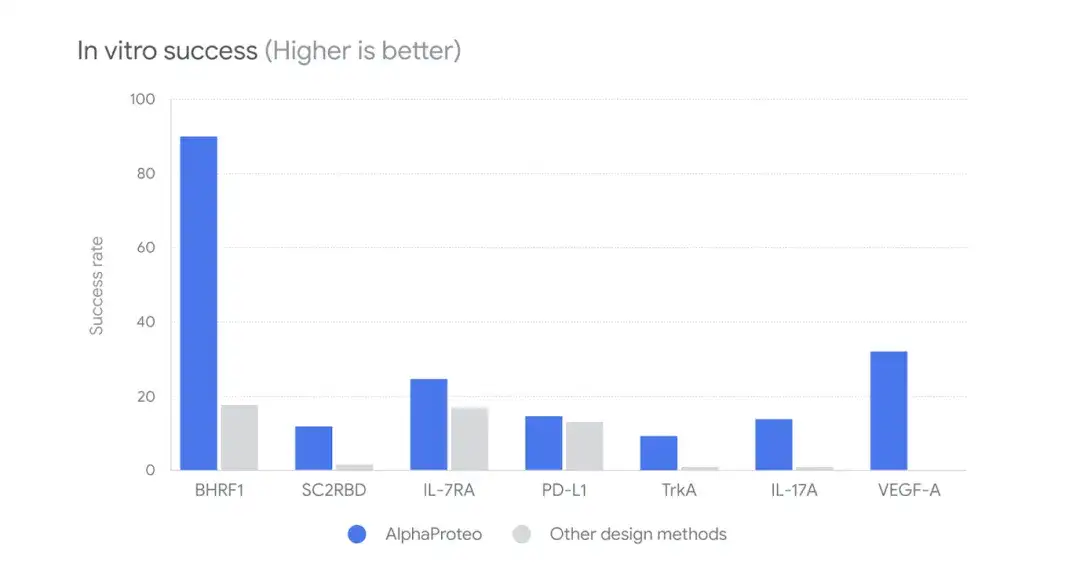
さらに、研究者らは、実験的最適化を行わない他の設計アプローチと比較して、AlphaProteo が設計した複合体の標的タンパク質に対する最適な親和性を調査しました。消す、AlphaProteo は、既存の最良の方法で設計された結合体よりも約 3 ~ 300 倍高い、より高い結合親和性を持つ結合体を生成します。
* 親和性が高いほど、結合はより強くなります。
研究者らはさらに、SC2RBDおよびVEGF-Aタンパク質のより強力な結合剤と、AlphaProteoによって設計された結合剤との間の類似性を調査し、その結果、以下のことが確認された。これらのより強力なバインダーの結合相互作用は、AlphaProteo によって予測されたものと類似しており、AlphaProteo の信頼性が実証されています。
さらに、研究者らは、これらのバインダーが実際の生物学的機能を持っていることを確認しました。たとえば、一部の SC2RBD バインダーは SARS-CoV-2 とその変異体の細胞への感染を防ぐことが示されました。さらに、AlphaProteo の幅広い適用性により、ハイスループットのスクリーニングや親和性最適化実験の必要性がなくなり、タンパク質バインダーを設計するための最初の実験時間が大幅に短縮されます。
ヨーロッパ最大の生物医学研究所とのコラボレーション
新しいタンパク質設計システム AlphaProteo をテストする最初の実験の中には、フランシス クリック研究所の 3 つのチームがあります。
英国ロンドンにあるフランシス クリック研究所は、現在ヨーロッパ最大の生物医学研究所であり、英国の研究センターです。この研究は、国立医学研究研究所 (NIMR) と英国がん研究機関が共同で約 7 億ポンドの費用をかけて開始されました。
現在、クリック研究所には 2,000 人を超える研究者と 100 を超える研究グループがいます。さらに、この研究所は、Medical Research Council、Cancer Research UK、Wellcome Trust、University College London、Imperial College London、King's College Londonを含む世界有数の生物医学研究機関6つによる独自のパートナーシップです。
フランシス・クリック研究所公式ウェブサイトのアドレス:
* https://www.crick.ac.uk/
ディープマインドの最新結果には賛否両論あり
研究の重要性とオープンソースの比較
実際の研究における AlphaProteo の価値の高さは誰の目にも明らかですが、多くのネチズンはこのツールがオープンソースであるかどうかをより懸念しています。あるネチズンは、「それはオープンソースなのか?そうでなければ、あまりにも退屈だろう」と述べた。
そして、他のネチズンはこう言いました。AlphaProteo は、オープンソースであるかどうかよりも、命を救うために重要です。そしてその発展の可能性について楽観的な見方を表明した。
方法論的な詳細が少なすぎて、論文というよりも広告のように見えます。
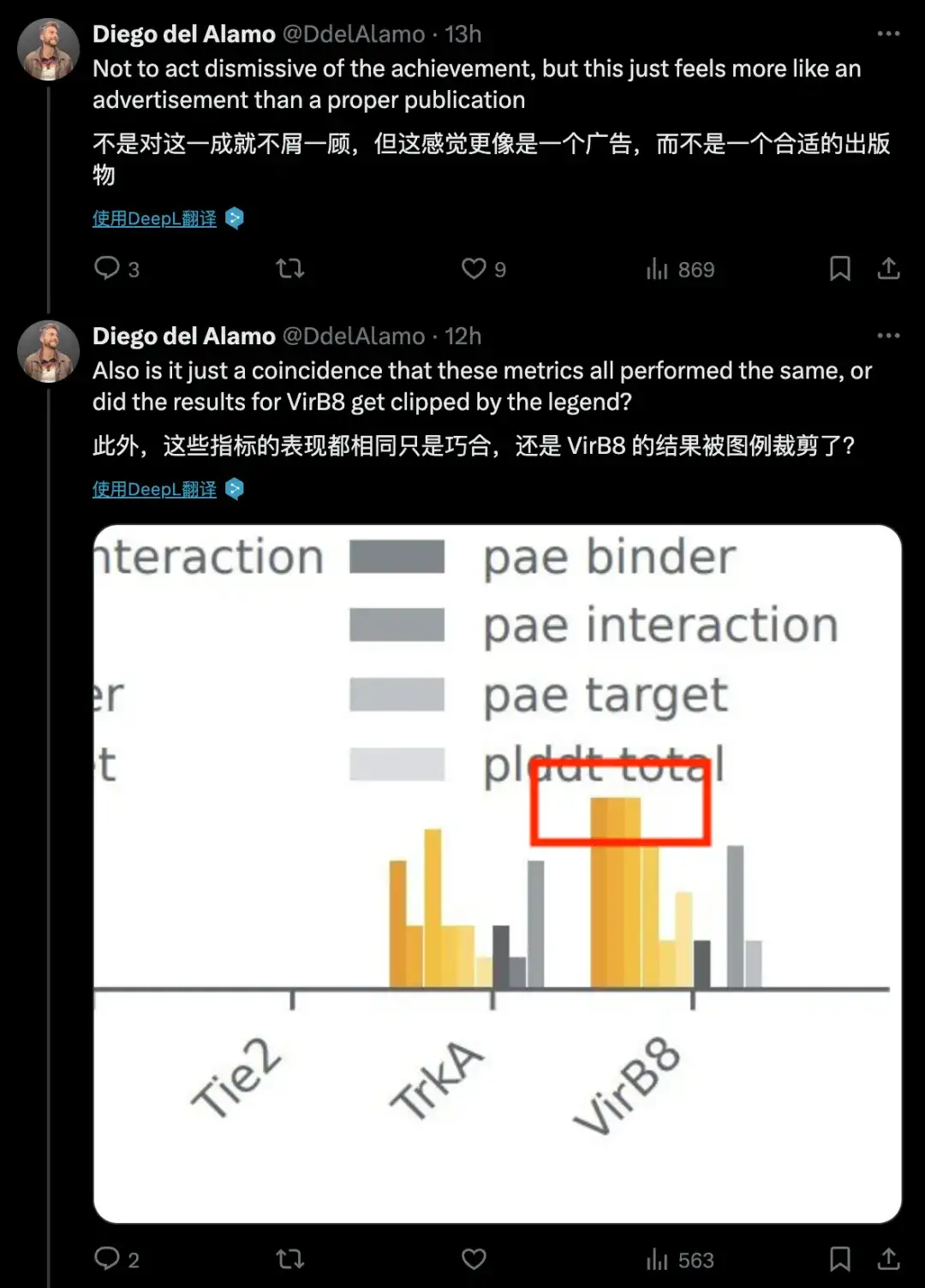
DeepMind チームはこのモデルの論文を書きましたが、モデルのメソッドの詳細はほとんど、またはほとんどありません。ある世界的な製薬・ヘルスケア企業の科学者は、「この白書には方法論の詳細が少なすぎる」「適切な出版物というよりは広告のような感じがする」と述べ、3回連続で更新情報を投稿し、この白書について懸念を表明した。同じ凡例インジケーターに質問します。
MITの別の生物学博士は、Scienceのオープンソースの重要性を繰り返し述べただけでなく、「Deepmindは行き過ぎだ。私はそれがどのように機能するのか本当に知りたい」とDeepMindの動きを批判した。
DeepMind が新たな戦場を切り開き、AlphaFold を補完します
DeepMindの生物医学産業向けの「アップグレードされたモンスターハンティング」は新たな戦場を切り開き、AI創薬の実装を加速する後押しとなるだろうか。
周知のとおり、AlphaFold 3 は、あらゆる生命分子 (タンパク質、DNA、RNA、リガンドなど) の構造と相互作用を超高精度で予測することができました。その将来の反復方向について、一部の内部関係者は、そうなる可能性があると予測しています。運動情報予測がさらに進化。今回発売したAlphaProteoは、AlphaFoldとある程度補完し合い、促進し合うことができます。
一方では、タンパク質の設計では、機能から始めて、特定の生物学的または化学的機能を実現するために新しいタンパク質構造または改良されたタンパク質構造を設計する必要があるため、タンパク質の構造と機能の関係の理解に大きく依存します。一方で、タンパク質の予測は、設計を導くための重要な構造情報を提供します。同時に、設計されたタンパク質は、予測モデルを改善し、タンパク質のフォールディングやダイナミクスなどの側面での予測精度を向上させるのにも役立ちます。
DeepMind は、AlphaProteo の紹介の中で、このイノベーションが生物学的プロセスに対する人々の理解を加速し、新薬の発見やバイオセンサーの開発などに貢献する可能性があると述べました。同社は将来、科学コミュニティと協力して、AlphaProteoを使用して広範な生物学的疑問を解決し、その限界を理解する予定です。同時に、DeepMind は Isomorphic Labs と協力して医薬品設計アプリケーションの研究も行っています。
Isomorphic Labs は DeepMind から生まれ、AI 医療の分野に焦点を当てています。その使命は、人類の最も壊滅的な病気の治療法を見つけるために、人工知能と機械学習手法を使用して創薬プロセスを加速および改善することです。
Isomorphic Labs は、ある程度、AI 医療分野における DeepMind の触手でもあり、薬剤設計アプリケーションにおける最新の成果を、初めてターゲットを絞った方法で探索することができます。このチームはAlphaFold 3の研究にも参加しており、DeepMindの支援によりAI創薬の実装に朗報をもたらすことが期待されている。
最後に、学術的な共有活動をお勧めします。
Meet AI4S の 3 回目のライブ ブロードキャストでは、上海交通大学自然科学アカデミーおよび上海国立応用数学センターの博士研究員である Zhou Ziyi 氏を招待しました。 9 月 25 日、Zhou Ziyi 博士は、オンライン ライブ ブロードキャストの形式でタンパク質言語モデルの小規模サンプル学習方法を共有し、AI を活用した指向性進化の新しいアイデアを探ります。クリックしてライブ配信を予約してください。








