Command Palette
Search for a command to run...
3大固形がんを狙え!上海交通大学のチームが、がんの生存予測精度を向上させる深層学習システムをリリース

世界保健機関が2022年に発表した報告書では、次のように述べられています。がんなどの非感染性疾患(NCD)は感染症を上回り、「世界で一番の死亡者」となった。中国国立がんセンターが発表した最新データによると、2022年には中国での新たながん患者数は約482万4,700人、がんによる新たな死亡者数は257万4,200人になると予想されている。
長い間、人々は「がん」に注目してきましたが、実際には慢性疾患として、がんの 1/3 は早期発見、早期診断、1/3 の治療によって予防可能であり、1/3 は治癒可能です。治癒するものではありませんが、適切な治療により制御し、生活の質を改善し、生存期間を延長することができます。このうち、予防は主に、自分自身の免疫力の向上や定期的な健康診断などを通じて、個人の健康に注意を払うことです。がんと診断された後の予後分析は非常に重要です。
がんの予後とは、がん患者の起こり得る経過と転帰を予測することを指し、予後分析はがん患者の生存確率の向上に役立ちます。これまで研究者らは、がん患者のさまざまな予後サブグループを区別するために、空間トランスクリプトミクス(ST)技術に基づく空間遺伝子発現の観点から腫瘍微小環境(TME)を特徴づけてきました。しかし、ST はコストが高く、実験期間が長いため、大規模ながん患者コホートにおける生存予測への応用が妨げられています。対照的に、組織学的画像は費用対効果が高く、臨床現場で簡単にアクセスでき、腫瘍の形態に関する豊富な情報が得られるため、分子レベルの TME 分析に代わる優れた代替手段となり、より正確ながんの予後が可能になります。
最近では、上海国立応用数学センター(上海交通大学分校)のYu Zhangsheng氏(生命理工学部/医科大学臨床研究センター)の研究グループ、Wang Yuguang氏(医学研究所)の研究グループが、自然科学/数理科学部) とその共同研究者は、Cell Reports Medicine で研究を実施し、「組織学的画像によって描かれた TME を活用し、深層学習システムを通じてがんの予後を改善する」というタイトルの論文を発表しました。本研究では、空間トランスクリプトームデータを持たずにがん患者の病理組織画像から腫瘍微小環境情報を予測できる深層学習システムを開発し、正確ながん予後を実現しました。
研究のハイライト:
- STデータを持たないがん患者の病理組織画像からTME情報を予測する
- IGI-DLを特徴とするTMEはがん生存予測の精度を向上させる
- 生物医学病理学画像の大規模な公共データベースにおける遺伝子の空間発現情報の使用を大幅に拡大

用紙のアドレス:
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00205-2
公式アカウントをフォローし、バックグラウンドで「Tumor Microenvironment」に返信すると、完全な PDF が表示されます
データセット: 3 種類の固形腫瘍からの組織サンプルの評価
この研究では、3 つの異なるデータセットを使用して、結腸直腸がん (CRC)、乳がん、皮膚扁平上皮がん (cSCC) という 3 つの異なる固形腫瘍タイプの組織サンプルに対するモデルのパフォーマンスを評価しました。
大腸がんの場合は、研究者らは、上海交通大学医学部瑞金病院の大腸がん患者 10 名からの 10 個の ST データセットからの 41,492 ポイントを使用し、10 倍 Visium によって 1 人の患者を除外する方法で配列決定しました。検証セットを以下の表に示します。

乳がんに関しては、研究者らは、以下の表に示すように、従来の ST 技術によって配列決定された 27 人の患者の 92 組織サンプルからの 34,678 個のスポットを、リーブワンアウト患者検証セットとして使用しました。

皮膚扁平上皮癌の場合、研究者らは、以下の表に示すように、従来の ST 技術によってシーケンスされた 4 人の患者の 12 組織サンプルからの 4,353 スポットを、リーブワンアウト患者検証セットとして使用しました。

モデル アーキテクチャ: 新しい深層学習システムによりがんの予後が改善
この研究では、研究者らは、組織学的画像に描写された TME を使用してがんの予後を改善できる深層学習システムを開発しました。
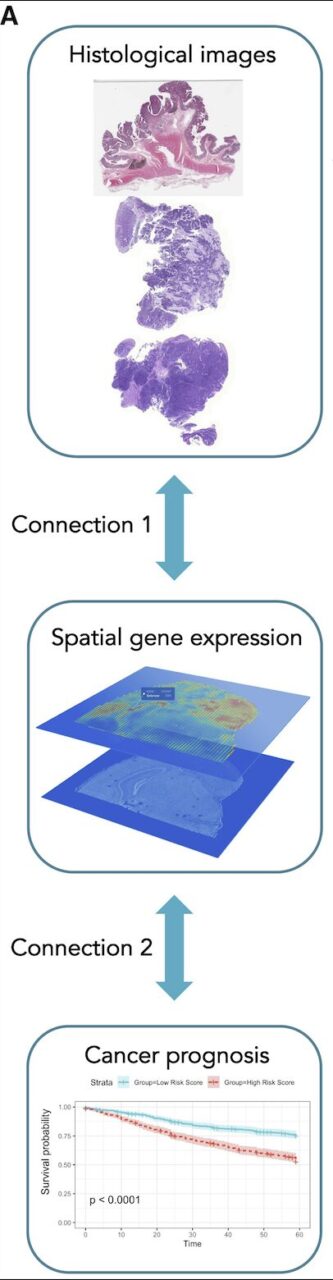
システムは 2 つの部分で構成されます。
最初の部分 (上図の接続 1) は、統合グラフおよび画像深層学習 (IGI-DL) に基づくモデルです。これは、畳み込みニューラル ネットワークとグラフ ニューラル ネットワークを使用して、H&E 染色された組織学的画像 (組織学的画像) が投影される遺伝子発現空間。
2 番目の部分 (上図の接続 2) では、研究者らはスーパー パッチ グラフと IGI-DL を使用して、Cancer Genome Atlas (TCGA) データセットの結腸直腸がんコホートと乳がんコホートにおける空間的遺伝子発現を予測しました。 ) ノード特徴として予後予測が実行され、外部テスト セット MCO-CRC (分子細胞腫瘍学結腸直腸癌) で検証されました。
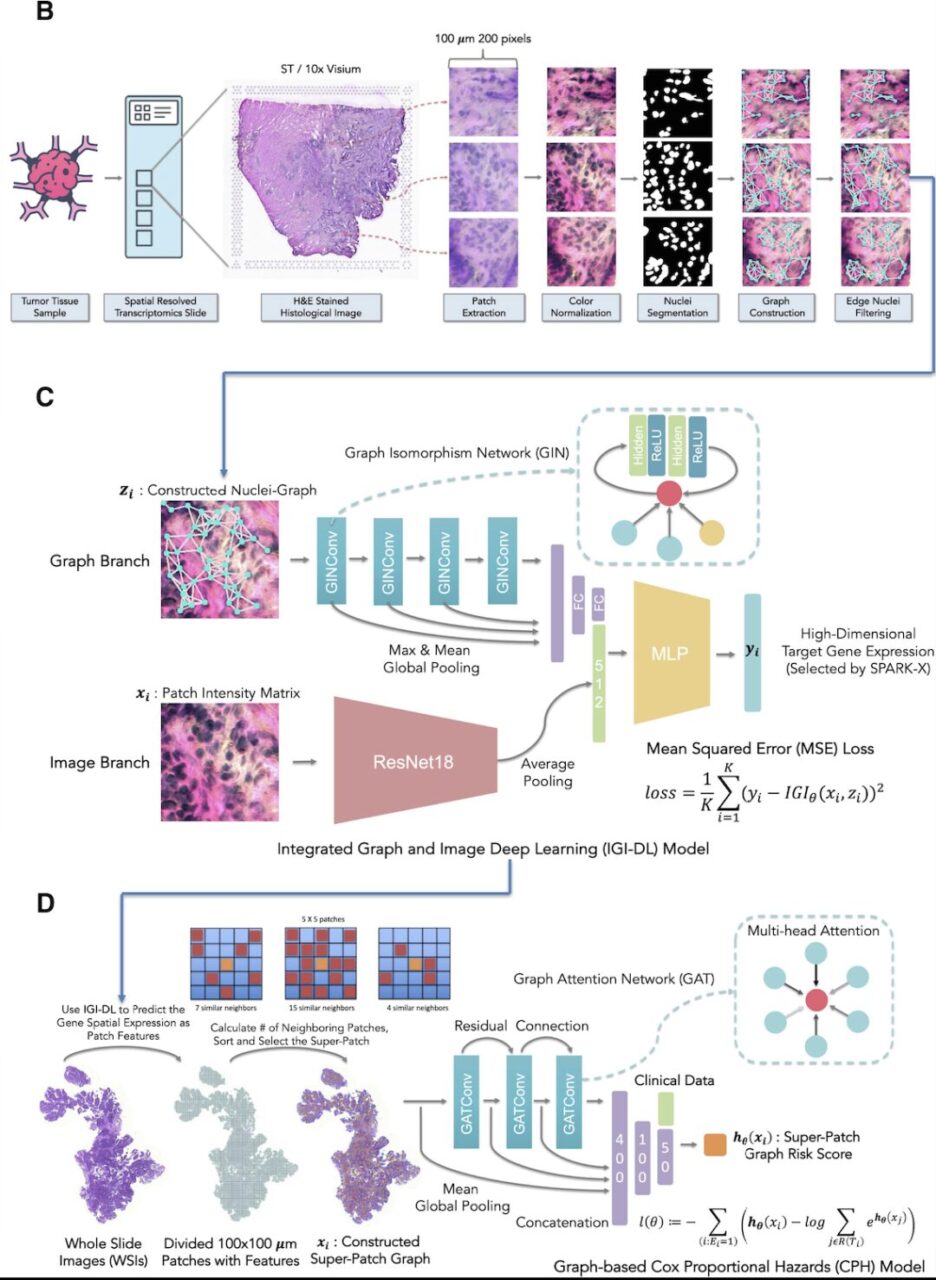
具体的には、このシステムの構築には、H&E 染色組織像前処理、空間遺伝子発現予測モデル、予測に基づく空間遺伝子発現スーパーパッチグラフ生存モデルの 3 つのステップが含まれます。
- H&E 染色組織学的画像の前処理:まず、各 H&E 染色組織画像を、各点の座標に基づいて、解像度 0.5 μm/ピクセルで、重複しない複数の 200 × 200 ピクセルのパッチに分割しました。
- 空間的遺伝子発現予測モデル:研究者らはパッチごとに、Hover-Net24 によってセグメント化された各核がノードとして表される核グラフを構築し、各核ペア間の距離によってエッジ接続があるかどうかが決まります。上の図 C に示すアーキテクチャに基づいて、研究者らは IGI-DL モデルを使用して、組織学的画像の各点での標的遺伝子発現を予測しました。
- 予測された空間遺伝子発現に基づくスーパーパッチグラフ生存モデル:空間的遺伝子発現によって描写される TME に基づいて予後をさらに予測するために、研究者らは各がん患者の H&E 染色全スライド イメージング (WSI) からスーパー パッチ グラフを構築し、構築されたスーパー パッチ グラフと臨床的特徴を入力として、グラフベースの生存予測モデルが構築されました。
研究結果:IGI-DLモデルは総合性能が優れている
全体として、この研究で構築されたIGI-DLモデルは、畳み込みニューラルネットワークとグラフニューラルネットワークの利点を統合し、病理組織画像のピクセル強度と構造的特徴を最大限に活用して、遺伝子の空間的発現レベルのより正確な予測を達成します。このモデルは、結腸直腸がん、乳がん、皮膚扁平上皮がんの 3 種類の固形腫瘍で良好な結果を示し、既存の 5 つの方法と比較して、平均相関係数は 0.171 増加しました。

結腸直腸がんについて、研究者らは、IGI-DL によって予測された 179 個の遺伝子のピアソン相関を 5 つの SOTA モデルと比較しました。IGI-DL は、保持された 10 人の患者間で平均 0.343 のピアソン相関を達成しました。これは、平均 0.233 の増加で、他のモデルよりも大幅に優れています。上の写真に示すように。

乳がんについて研究者らは、IGI-DL によって予測された 187 個の遺伝子のピアソン相関を以前のモデルと比較し、IGI-DL は保持された 27 人の患者の間で平均 0.231 の相関を達成しました。上の図に示すように、IGI-DL モデルはすべての SOTA モデルよりも優れており、平均 0.142 の改善が見られます。

皮膚扁平上皮癌について、研究者らは、IGI-DL によって予測された 487 個の遺伝子のピアソン相関を以前のモデルと比較したところ、IGI-DL は保持された 4 人の患者間で平均 0.198 の相関を達成し、すべてのモデルで最高のパフォーマンスを示しました。他の SOTA モデルの平均パフォーマンスは 0.131 向上し、上の写真に示すように。
上記の実験で示されているように、クロスプラットフォームおよびクロスがんタイプのパフォーマンスの観点からは、最適な SOTA モデルは、さまざまながんタイプの内部検証および外部テスト セットに対して固定されていません。ただし、IGI-DL モデルのパフォーマンスは常に他のモデルよりも優れており、平均改善率は 0.171 であり、優れたクロスプラットフォーム汎化機能を示しています。
さらに、研究者らは、結腸直腸がんについて訓練されたモデルが、皮膚扁平上皮がんの内部検証セットと外部試験セットで良好なパフォーマンスを示し、平均相関関係がそれぞれ 0.204 および 0.143 であった、IGI-DL の交差がん予測パフォーマンスも調査しました。ただし、ほとんどのがんタイプ間の予測パフォーマンスは、単一のがんタイプをトレーニングおよびテストする場合よりも低くなります。この結果は、腫瘍領域における空間的遺伝子発現が特定のがんに特異的であり、がんの種類全体にわたって予測することが本質的に困難であることを示しています。

予後予測パフォーマンスに関しては、The Cancer Genome Atlas Breast Cancer (TCGA-BRCA) コホートでは、ノード特徴としての空間遺伝子発現に基づくスーパーパッチ グラフ生存モデルは、5 倍クロスで平均一貫性指数 (C) 0.747 を達成できます。 -validation. -index); Cancer Genome Atlas Colorectal Cancer (TCGA-CRC) コホートでは、この生存モデルの 5 倍交差検証 C インデックスは 0.725 であり、これは他の予後モデルよりも優れています。上の図。
この生存予後モデルは、初期段階の患者 (ステージ I および II) の予後を予測する際の精度の利点も維持しており、予測されたリスク スコアは、すべてのステージの患者および初期段階の患者に対する独立した予後指標として使用できます。 1,000 人以上の患者からのデータが含まれる外部テスト セット MCO-CRC では、生存予後モデルは安定した優位性を維持し、一般化能力を備えています。
まずは乳がんと膵臓がん: AI を活用して予後を改善する
がんの診断と治療の過程において、がんの予後分析は過剰治療や医療資源の無駄を効果的に回避し、医療スタッフや家族が医療上の決定を下すための科学的根拠を提供することが、最近のがん研究において一般的な方向となっています。年。
乳がんの転帰を改善するために、Salesforce の研究者は 2020 年に南カリフォルニア大学ローレンス J. エリソン研究所の臨床医と協力して、機械学習システム「ReceptorNet」を立ち上げ、そのアルゴリズムは、低コストで簡単にアクセスできる組織画像から、臨床医が乳がん患者の適切な治療方針を決定する際に重要なバイオマーカーであるホルモン受容体の状態を予測できます。このシステムの精度は92%に達します。

2024 年 2 月、ケンタッキー大学、マカオ科学技術大学、マカオ大学、広州医科大学第一付属病院の研究者は、ニューラル ネットワーク モデルを使用して、正確な予後スコアリングシステム - MIRS (転移および免疫ゲノムリスクスコア) を確立しました。腫瘍転移および免疫ゲノムリスクスコアは、乳がん患者にほぼ普遍的に適用できる予測ツールを提供し、乳がん集団における治療選択に新たな方向性をもたらします。 (クリックして詳細レポートを表示: 世界最大のがんをターゲットに、中国の学者らが乳がん予後スコアリングシステム MIRS を確立)
さらに、膵臓がんは消化管の一般的な悪性腫瘍の 1 つであり、診断後の 5 年生存率は 10% を超えません。患者の生存率を向上させるための重要なリンクは、目標を絞った治療計画を立てるために患者の予後リスクを正確に予測することです。組織病理学は腫瘍学における日常的な検査であり、顕微鏡レベルで腫瘍の特徴を分析でき、腫瘍進行のリスクを評価する重要な方法です。しかし、スライスサイズが大きく、組織構成が複雑であるため、評価結果は主観的な要素の影響を受けやすくなります。

2023年、南京信息大学、人工知能学部、スマート医療研究所の研究チームが、「マルチタスクと注意力に基づく膵臓がん全スライス画像の多組織セグメンテーションモデル」と題した研究論文を発表しました。膵臓癌の病理学的スライスの 8 つのカテゴリーの組織セグメンテーションが研究されました。アテンション メカニズムを導入し、階層的な共有マルチタスク構造を設計することにより、関連する補助タスクを使用することでモデルのパフォーマンスが大幅に向上しました。
この研究で提案されたモデルは、上海長海病院のデータセットでトレーニングおよびテストされ、TCGA 公開データセットで外部検証されました。内部テストセットの F1 スコアはすべて 0.97 より高く、外部テストセットの F1 スコアはすべて 0.97 を超えていました。検証セットはすべて 0.92 と高く、汎化パフォーマンスはベースライン手法よりも大幅に優れています。
AIは病理専門家に代わるものではなく、病理診断の利便性を高め、病理医の業務効率をさらに向上させる補助的な診断技術であることは強調しておきたい。長期的な観点から見ると、デジタルバイオマーカー検出、医療画像解析、疾患経過予測などにおいて、AIにはまだ大きな発展の余地が残されています。
参考文献:
1.https://news.un.org/zh/story/2018/09/1017602
2.https://mp.weixin.qq.com/s/VE68FKL6kwpO1IFsbR-LVA
3.https://ins.sjtu.edu.cn/articles/286
4.https://www.cdstm.cn/theme/khsj/khzx/khcb/202012/t20201214_1039028.html








