Command Palette
Search for a command to run...
AlphaFold 3 が登場!クローズドソースだが科学研究には利用可能、DeepMind子会社がまず商業利用を促進する?

現地時間5月8日、Google DeepMindとその子会社Isomorphic LabsはAlphaFold 3をリリースした。
DeepMind は、AlphaFold 3 がすべての生体分子 (タンパク質、DNA、RNA、リガンドなど) の構造と相互作用を前例のない精度で予測することに成功したと述べています。従来の予測手法と比較すると、AlphaFold 3 は、他の分子タイプとのタンパク質相互作用を少なくとも 50% より正確に発見し、一部の重要な相互作用クラスでは予測精度が 2 倍になりました。
AI for Science をフォローしている読者なら、最初に発売されたときに「マイルストーンの画期的な進歩」として賞賛された AlphaFold についてよくご存じでしょう。 AlphaFold 2 は、2021 年に Science によって「ブレークスルー オブ ザ イヤー」に、Nature によって「メソッド オブ ザ イヤー」に選ばれ、AI + 生物学の応用限界を常に突破し、道をリードしてきました。
さて、AlphaFold 3 は、「すべての生命分子は予測可能である」ということをどのようにして人々の理解を新たにしたのでしょうか?突然のテクノロジーとパフォーマンスのアップグレードとは何ですか? DeepMindから生まれたIsomorphic Labsはどのような役割を果たしているのでしょうか?
Pairformer モジュールは Evoformer を置き換え、Diffusion モジュールは Structure モジュールを置き換えます。
研究者らは、より一般的な化学構造に対応し、モデル学習のデータ効率を向上させるために、AlphaFold 2 の構造とトレーニング手順に大幅な改善を加えました。さて、分子の入力リストが与えられると、AlphaFold 3 はそれらの結合 3D 構造を生成し、それらがどのように結合するかを明らかにすることができます。

上の図に示すように、AlphaFold 3 の全体構造は AlphaFold 2 と似ており、化学複合体のペアリング表現を進化させるために大きなバックボーンが使用されています。 AlphaFold 3 は、AlphaFold 2 の Evoformer をより単純な Pairformer モジュールに置き換えます。これにより、多重配列アラインメント (MSA) の処理量が削減され、MSA モジュールの数が 4 つに減ります。 AF3 の MSA 表現処理では、より安価なペア加重平均法が使用され、後続の処理ステップではペア表現のみが使用されます。

研究者らは、AlphaFold 2 で、構造モジュールの複雑さの多くを削除しても、予測精度にはほとんど影響がない一方、バックボーン フレームワークと側鎖のねじれ表現を保持すると、一般的な分子グラフの複雑さが増加することを観察しました。
AlphaFold 3 では、エンジニアは拡散モジュールを使用して元の原子座標を直接予測し、アミノ酸固有のフレームワークと側鎖のねじれ角に基づいて動作する AlphaFold 2 構造モジュールを置き換えます。後者は、ペアの表現を使用して、明確な原子位置を生成します。拡散プロセスのマルチスケールの性質 (ノイズ レベルが低いとネットワーク内の局所構造が改善されます) により、立体化学損失の排除とネットワーク内の結合パターンの特別な処理も可能になり、任意の化学組成の処理が容易になります。
具体的には、拡散モジュールは、回転フレームや等変数処理を必要とせずに、生の原子座標と大まかな抽象表記表現を直接操作できます。研究者らはまず「ノイズ」原子座標を受け取るように拡散モデルを訓練し、次に実際の座標を予測した。このプロセスでは、モデルがさまざまな長さスケールでタンパク質の構造を学習する必要があります。小さなノイズの下でのノイズ除去タスクでは非常に局所的な立体化学の理解を強調するのに対し、高ノイズ下でのノイズ除去タスクではシステムの大規模な構造が強調されます。
推論時、モデルは最初にランダム ノイズをサンプリングし、次に周期的なノイズ除去を実行して最終的な構造を生成します。 AlphaFold 3 は、回答分布を生成する生成トレーニング プログラムであることに言及する価値があります。これは、各答えについて、モデルがその位置について不確かな場合でも、局所的な構造 (側鎖結合の形状など) を決定できることを意味します。したがって、AlphaFold 3 は、一般的なリガンドの複雑さを処理しながら、ねじれベースの残基パラメータ化と構造違反損失の両方を回避します。

上の図に示すように、タンパク質-dsDNA (タンパク質と二本鎖 DNA の相互作用) の予測性能比較では、AlphaFold 3 の成功率は 64.8% に達しましたが、RosettaAlphaFold2NA の成功率は 28.3% にとどまりました。 。タンパク質-抗体 (タンパク質と抗体間の相互作用) 予測では、AlphaFold 3 の正確な成功率は 62.9% ですが、他のシステムでは 29.6% しかありません。
* RosettaAlphaFold2NA は、Rosetta の古典的なモデリング技術と AlphaFold 2 を組み合わせたものです。
AlphaFoldの成長履歴:6年間で4回ジャンプした優等生
AlphaGoが国際囲碁名人イ・セドルを破った後、「Alphaシリーズ」が正式に人々の目に入るようになった。 DeepMind によると、これも AlphaGo が有名になったほぼ直後の 2016 年に、チームはタンパク質の折り畳み問題の研究を開始しました。
2018年末の第13回CASP(タンパク質構造予測の重要評価)では、AlphaFold は 98 名の出場者中リストのトップとなり、43 種類のうち 25 種類のタンパク質の構造を正確に予測しました。同じグループの 2 位の出場者は、そのうち 3 つだけを正しく予測しました。
当時、「第一世代」の AlphaFold はすでに驚くべき強度を示していました。AlphaFold 1 は、数千の既知のタンパク質に基づいてトレーニングされ、アミノ酸のペア間の距離とそれらを接続する化学結合の角度を予測しました。初期構造を調整して、最もエネルギー効率の高い配置を見つけます。
しかし、チームは、局所物理学とパターン認識から得られるガイドポテンシャルを組み合わせる AlphaFold 1 のアプローチは、鎖に沿って離れた残基間の相互作用よりも効率が低いことを発見しました。この方法は、配列内の隣接する残基間の相互作用を過剰に考慮する傾向があります。したがって、AlphaFold 1 は、実際よりもわずかに多い二次構造 (アルファ ヘリックスとベータ シート) を持つモデルを選択する傾向があります (オーバーフィッティングの一種)。
技術的な観点から見ると、AlphaFold 1 で使用されるソフトウェアは複数のモジュールを含むように設計されており、各モジュールはガイダンス ポテンシャルを生成するように個別にトレーニングされ、物理ベースのエネルギー ポテンシャルと結合されます。
したがって、2020 年にリリースされた AlphaFold 2 は、サブネットワークを単一の微分可能なエンドツーエンド モデルと組み合わせています。このシステムは完全にパターン認識に基づいており、単一のアンサンブル構造としてアンサンブル方式でトレーニングされます。
AlphaFold 2 はタンパク質モノマー構造の高精度な予測を達成しました。その後、DeepMind チームは複合体の予測にさらに焦点を当てました。 2021 年 10 月に、DeepMind は AlphaFold-Multimer と呼ばれるアップデートをリリースしました。AlphaFold 2 に基づいて拡張されており、複数のタンパク質の複合体をモデル化できます。
AlphaFold 2 チュートリアルのワンクリック展開:
https://openbayes.com/console/public/tutorials/m6k2bdSu30C
研究者らは4,433のタンパク質複合体をテストし、ヘテロポリマーとホモポリマーの接触界面でのAlphaFold-Multimerの予測精度を調べ、それぞれ67%と69%に達し、23%と69%の比率を占めました。 34%。
その後、2 年間休眠状態だった AlphaFold は、タンパク質構造予測の精度をさらに向上させたほか、RAN 予測機能も追加して再び人々を驚かせました。 2023 年 10 月末日、DeepMind は、AlphaFold の最新の進捗状況をリリースしました (論文ではこれを AlphaFold 最新と呼んでいますが、現在は AlphaFold 3 であるようです)。

用紙のアドレス:https://storage.googleapis.com/deepmind-media/DeepMind.com/Blog/a-glimpse-of-the-next-generation-of-alphafold/alphafold_latest_oct2023.pdf
DeepMind は、新世代の AlphaFold モデルはタンパク質データベース (PDB) 内のほぼすべての分子を予測でき、その予測精度は原子レベルに達することができ、複数の主要な生物学的高分子カテゴリーの新たな理解を開くだけでなく、大幅に向上すると述べています。予測精度。これらの生体高分子のカテゴリには、リガンド (低分子)、タンパク質、核酸 (DNA および RNA)、および翻訳後修飾 (PTM) を有する生体高分子が含まれます。
2023 年末から待望され、すべての人の食欲を刺激してきた新世代 AlphaFold 3 がついに登場しました。その機能は産業界と学界を失望させるものではありませんでしたが、共同の努力を必要とするさらに重要な問題がまだあります。全当事者が前進する - —AlphaFold 3 を研究室から医薬品生産ラインに持ち込む方法、より多くの科学研究チームがこの高度なツールを使用して研究プロセスを最適化できるようにする方法など。引き続き注意と投資が必要です。
DeepMind 子会社 Isomorphic Labs が表面化
AlphaFold 3-Isomorphic Labs のリリースには無視できないチームもいることは注目に値します。
DeepMindから生まれたこの会社は2021年11月に設立されました。その名前は、生物学と情報科学の間の潜在的な同型マッピングに触発されています。 AlphaFold を利用して Isomorphic Labs は AI 医療の分野に焦点を当てており、人工知能と機械学習手法を使用して創薬プロセスを加速および改善し、人類の最も壊滅的な病気のいくつかの治療法を見つけることを使命としています。
2022 年 5 月、Isomorphic Labs は、スター揃いと言える第 1 段階の経営チームのメンバーを発表しました。
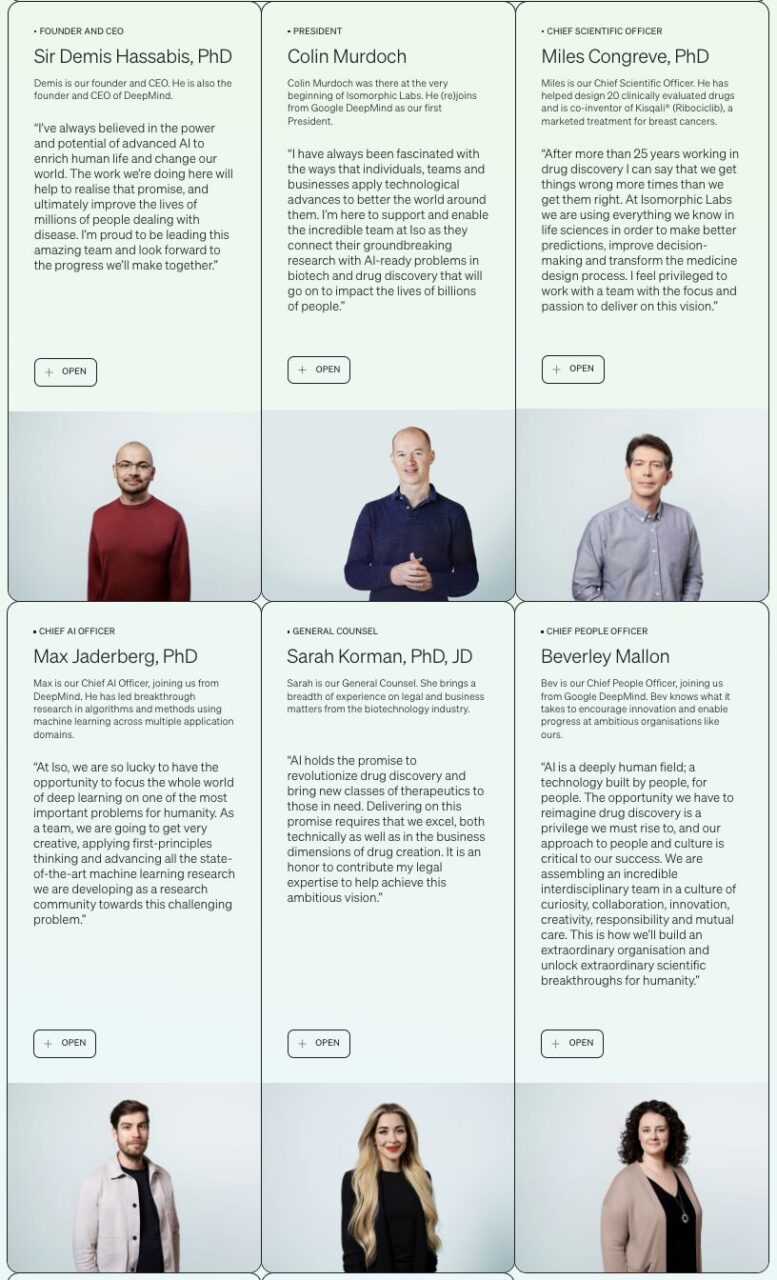
「AlphaGo の父」として知られるデミス・ハサビス氏が同社の CEO を務め、最高科学責任者は 20 種類の臨床評価薬の設計に参加し、市販されている Kisqali® (Ribociclib) のディレクターである Miles Congreve 氏です。乳がん治療薬の共同発明者)、エンジニアリング、機械学習、製品、生命科学、医学研究分野で 20 年以上の経験を持つ、オックスフォード大学のマックス・ジェイダーバーグ博士。機械学習ディレクターを務めています…
Isomorphic はロンドンに本拠を置く会社として設立されてから約 2 年間、最初に正式に発表された経営陣以外の仕事に関するニュースは発表されていません。 Demis Hassabis が初めて Isomorphic についてのビジョンを述べたのは、2023 年の Endpoints News との独占インタビューでした。
インタビューの中で、2021年11月以降の同社の主な仕事について話した際、デミス・ハサビス氏は次のように述べた。「私たちはまず、最も早く変化をもたらすことができる低分子領域に焦点を当てます。次に、相互作用空間(タンパク質-リガンド相互作用、タンパク質-タンパク質相互作用、生物学の動的な性質)にも非常に興味を持っています。」さらに、化学の世界に入り、化合物の構造、化合物が標的にどのように結合するか、結合親和性などを理解する必要があります。」
現在、業界と協力してパイプラインを構築しているかどうかについて、デミス・ハサビス氏は、「当社の技術ロードマップに特に適していると思われる目標と取り組みを選択し、興味深い目標について大手製薬会社と協力する予定です。詳細については、次のサイトで公開できます」と述べた。後日」と明らかにした。
2024 年 1 月、Isomorphic Labs はイーライリリーおよびノバルティスとの 2 つの 30 億ドルの医薬品開発契約を発表しました。 デミス・ハサビス氏は、「アイソモルフィックはこれまでにも他の大手製薬会社と予備交渉を行ってきたが、イーライリリーとノバルティスは協力において非常に誠実である。同時に、この協力の主な目的は明らかである。それは単に医薬品を製造することではない」と述べた。パイロットプロジェクトや学術的なコラボレーション。
具体的には、イーライリリーとの協力には、複数の疾患関連タンパク質と経路を標的とした治療法の開発が含まれます。この点に関して、デミス・ハサビス氏は「当社独自の技術プラットフォーム、次世代AlphaFold、大規模コンピューティング能力をリリーの開発プロジェクトに適用することで、画期的な医薬品設計を共同で推進することになる」と強調した。
ノバルティスとの共同研究は、3 つの未公開の標的を標的とする小分子治療薬の発見に焦点を当てています。 Novartis Biomedical Research の社長であるフィオナ・マーシャル氏は、「この提携は、人工知能やデータサイエンスから医薬化学、疾患領域の深い専門知識まで、両社の独自の強みを組み合わせ、AI 主導の創薬における新たな可能性を前進させます。」と述べています。
現在、AlphaFold 3 のリリースにより、Isomorphic Labs の技術力はさらに強化されるはずですが、応用の観点から見ると、近年、AI 医薬品への投資ブームは低迷しており、先端技術をどのように応用するかという課題に直面しています。これは企業の将来の方向性に関わる重要な問題であり、DeepMind の強力な支援により、AlphaFold 3 ができるだけ早く業界に導入されることを期待しています。
もう 1 つ: AlphaFold サーバー

AlphaFold 3 は、物理ベースの生体分子構造予測ツールを超えた最初の AI システムであるため、現時点では完全なコードをオープンソースにする計画はありません。しかし、研究チームは、非営利研究をサポートするこのモデル AlphaFold Server のパブリック インターフェイスをリリースし、世界中の研究者に門戸を開きました。
AlphaFold Server の公式 Web サイトにアクセスしてください。
アルファフォールドサーバー.com
生物学者は、マウスを数回クリックするだけで、AlphaFold 3 を使用して、タンパク質、DNA、RNA、選択したリガンド、イオン、化学修飾で構成される構造をモデル化し、タンパク質が細胞内の他の分子とどのように相互作用するかを予測できます。このプラットフォームは、科学者が研究室でテストするための新しい仮説を思いつくのに役立ち、ワークフローを高速化し、科学者が十分なコンピューティング リソースや機械学習の専門知識を持っているかどうかに関係なく使用できます。
この点に関して、フランシス・クリック研究所ウールマン研究室の研究科学者セリーヌ・ブシュー氏は次のように賞賛した。「AlphaFold Server では、もはや構造を予測するだけでなく、寛大にアクセスを提供し、研究者が大胆な質問をして Discover を加速できるようになります。 」
AlphaFold 3 の登場が科学的探求における大きな進歩であるだけでなく、生物医学研究開発の新時代を開く重要なツールであることは疑いの余地がありません。これは、医薬品標的の正確な同定などの研究開発プロジェクトにとって重要な、さまざまな種類の分子相互作用のシミュレーションにおいて大きな進歩を遂げました。
DeepMind チームは期待に満ちています。「私たちは AlphaFold 3 の可能性を探求し始めたばかりで、将来何が起こるか楽しみです。」
参考文献:
1.https://cloud.tencent.com/developer/article/2017961
2.https://hub.baai.ac.cn/view/31181
3.https://zh.wikipedia.org/wiki/AlphaFold
4.https://mp.weixin.qq.com/s/18cNw-E-5vU3vKb1J4WWKg