Command Palette
Search for a command to run...
フロリダ大学はニューラルネットワークを使用して GPCR-G タンパク質カップリング選択性を解読
内容の概要:Gタンパク質共役受容体(GPCR)は、細胞膜の外側から細胞膜の内側へ刺激を伝達する膜貫通タンパク質であり、ヒトの生理活動に広く関与しています。最近、フロリダ大学の研究者らは、GPCR と G タンパク質の結合選択性を測定し、それらの選択性を予測するアルゴリズムを開発し、この選択性の構造的基盤を研究しました。
キーワード:GPCRニューラルネットワーク創薬
著者 | 雪才
編集者 | 三陽
G タンパク質共役受容体 (GPCR) は、細胞膜の外側から細胞膜内に刺激を伝達する膜貫通タンパク質です。 GPCR は、細胞膜およびその下流のシグナル伝達経路で G タンパク質を活性化することにより、発生、免疫、ホルモン調節、神経活動などの重要な生理学的活動に広く関与することができます。
Gタンパク質はGα、Gβ、Gγサブユニットで構成されており、その多様性がGPCRシグナル応答の多様性を決定します。ヒトゲノムは合計 16 個の Gα サブユニットをコードしており、それらは 4 つのサブファミリー Gα に分けられます。i/o 、Gαq 、Gαs とGα12/13 。 G タンパク質は下流のシグナル伝達経路を決定し、したがって細胞応答を決定します。したがって、GPCR と G タンパク質の選択的結合は、生物学的シグナル伝達システムを理解する鍵となります。
学術界はかつて GPCR は単一の G タンパク質にしか結合できないと考え、その後 GPCR を機能的に 4 つのタイプに分類しました。しかし、最近研究者らは、ほとんどの GPCR が複数の G タンパク質と結合して、複雑な細胞応答を活性化していることを発見しました。 1 対 1 の分類モデルは、GPCR と G タンパク質の間の結合関係を説明するにはもはや十分ではありませんが、GPCR と G タンパク質の選択メカニズムはまだ明らかではありません。
この目的を達成するために、フロリダ大学の研究者らは、速度論的測定と生物発光共鳴エネルギー移動(BRET)技術を用いて、GPCRとGタンパク質のグアニル酸交換因子を決定し、両者の選択的結合を分析した。そこで研究者らは、Gタンパク質に対する好みに基づいてGPCRを分類し、さまざまな哺乳類からの124種類のGPCRを含む粗視化モデルを確立した。その後、GPCRs-G タンパク質の選択性を予測するアルゴリズムが開発され、選択性の構造基盤が研究されました。関連する結果は「」に掲載されています。セルレポート”。

この成果は「Cell Reports」に掲載されました
論文リンク:
https://doi.org/10.1016/j.celrep.2023.113173
01 BRET: GPCRs-G タンパク質の選択的定量
GPCR-G タンパク質の選択性を定量的に検出するために、研究者らは BRET テクノロジーを使用して生細胞内の G タンパク質活性を測定しました。

Gタンパク質活性をリアルタイムで検出するBRETテクノロジー
その後、研究者らはコレシストキニン II 型受容体 (CCKBR) でそれを検証しました。応答振幅 (Amplitude) の結果は、CCKBR が Gα を活性化できることを示していますi/o 、Gαq 、Gα15 とGα12/13 G タンパク質のファミリーであり、活性化レベルに大きな違いはありませんが、Gα を活性化することはできません。s タンパク質のファミリー。
活性化率に基づく結果は、CCKBRがGαに重要な影響を及ぼしていることを明らかに示しています。q ファミリーアクティベーションが一番良く、次にGαが続くi/o 、Gα15 とGα12/13これは、活性化率に基づく BRET テクノロジーが、異なる G タンパク質の活性間の微妙な違いを捕捉できることを示しています。

振幅ベースの BRET 結果 (C) および活性化率ベースの BRET 結果 (D)
それに応じて、研究者らは、この研究のデータセットとして 124 個の GPCR と G タンパク質の選択性を測定しました。

クラスB GPCRおよびGタンパク質の選択性測定結果
02 モデルの構築: 二値分類ニューラル ネットワーク
上記の結果は、活性化率に基づく BRET 技術により、G タンパク質から数百の GPCR を選択的に区別できることを示しています。この結果を踏まえて、研究者らは、クラス A GPCRs-G タンパク質の選択性に関する機械学習ベースの予測アルゴリズムを開発しました。
このアルゴリズムには 2 つのタスクがあります。
1. GPCR の結合特性に基づいて、特定の GPCR が G タンパク質と結合できるかどうか、つまり振幅が >0% であるかどうかを判断します。
2. GPCR の選択性に基づいて、特定の GPCR-G タンパク質結合が迅速に活性化できる、つまり活性化率が >30% であると判断されます。
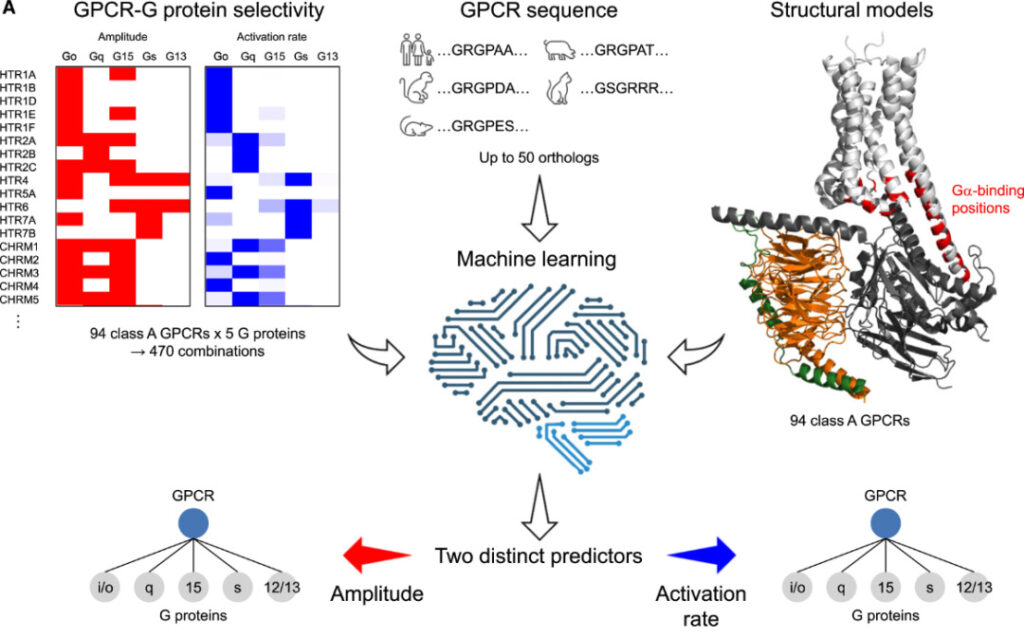
機械学習アルゴリズムの概念図
各 GPCR と G タンパク質の異なるファミリーとの結合は分類問題であるため、各タスクは 5 つの二項分類として設計できます。したがって、研究者らはこれらのタスクを処理するために 10 個のニューラル ネットワーク分類器を設計しました。ニューラル ネットワークは、2 つの完全接続層 (それぞれ 128 個と 16 個のニューロン)、平坦化層、3 つの完全接続層 (それぞれ 128 個、32 個、および 4 個のニューロン)、および 1 つの出力層 (1 個のニューロン)、アクティブ化された内部層で構成されます。修正線形単位 (ReLU) によって、最後にバッチ正規化によって行われます。出力層はシグモイド関数によってアクティブ化されます。
データ量が限られているため、G タンパク質の選択性を決定する配列が進化中に比較的保存されていると仮定して、データ拡張のために各 GPCR に 50 の相同配列を追加しました。教師なし深層学習モデルを使用するモデルに配列埋め込みプロトコルを導入し、特定の環境におけるタンパク質残基の特性を記述します。
ニューラル ネットワークへの入力は、サイズ B*30*1024 のテンソルです。最初の次元はバッチ サイズ (B=32)、2 番目の次元は残基の数 (30)、3 番目の次元はそれぞれアミノ酸残基事前トレーニングされたシーケンスの埋め込みのサイズ (1024)。
振幅と活性化率のモデル予測の平均 オーロック どちらも 0.85 であり、モデルが両方の指標の予測において優れたパフォーマンスを持っていることを示しています。その中でもGに関してはs ファミリータンパク質が最もよく予測され、AUROC はそれぞれ 0.89 および 0.95 でした。ただし、Gαについては、15 とGα12/13 タンパク質ファミリーの場合、モデルは明らかな学習能力を示しません。

振幅 (C) および活性化率 (D) の予測 ROC 曲線
03 GPCRs-Gαタンパク質選択性のメカニズムを解明する
BRET 実験と機械学習は、GPCRs-G タンパク質選択性の構造基盤を解読するためのソリューションを提供します。これに基づいて、研究者らは利用可能な GPCRs-G タンパク質複合体を調査し、33 個のクラス A 受容体を分析して、クラス A GPCRs-Gα タンパク質の選択性を決定する構造を見つけました。
研究者らは GPCR-Gα タンパク質の残基ネットワークを調査し、その結果、細胞質に面した GPCR のすべての構造がさまざまな程度で Gα タンパク質への結合に関与していることが示されました。同様に、Gα タンパク質には GPCRs と Gα タンパク質の結合に関連する構造が 13 個あり、その中で C 末端の α ヘリックス (H5) が最も関与しています。

GPCRとGαタンパク質のさまざまな構造要素間の相互作用
ユニバーサル GPCR-Gα カップリングの場合、GPCR は ICL2、H8、およびほとんどの TM 残基を使用して Gα タンパク質に結合します。その中で、大多数の構造は主に H5 に接続されていますが、ICL2 はより広範に接続されています。
GPCRとGαi/o とGαq このファミリーのタンパク質結合様式は似ていますが、唯一の違いは、GPCR と前者との結合は TM6 に大きく依存しているのに対し、後者との結合は依存していないことです。 GPCRとGαs 接続のうち、ICL2 と ICL3 の割合は大幅に減少し、TM3 と TM5 への依存度が高くなります。上記の結果は、Gα タンパク質のファミリーが異なると、GPCR との関係が構造の違いに依存することを示しています。
さらに、GPCR-G タンパク質の選択的配列を組み合わせて、異なるファミリーの Gα タンパク質に対する特定の構造の影響を調査しました。まずはジャッジとGαi/o 結合した GPCR は Gα と相互作用する可能性があります15 2 つの残基ネットワーク間の差異を結合して比較します。前者と比較して、GPCR間の結合および後者はICL3とH4の間の結合を遮断し、ICL2-H5の相互作用を弱め、TM4-HNとICL2-s2s3の間の結合を強化する。これは、ICL2 と他の残基との間の接続が Gα によるものである可能性があることを示唆しています。i/o またはGα15 リンクされた GPCR 間の主な違い。

GPCR は Gα とのみ相互作用しますi/o 連結残基 (J) と Gα を持つ GPCR のネットワーク15/Gαi/o 接続された残基ネットワーク (K)
同様に、GPCR と Gα を比較しました。s とGαi/o 残基ネットワークを結合した後の結果は、ICL1 と TM5 の間のリンクが 2 つの間の主な違いであることを示しています。
上記の結果は次のことを示しています。BRET と機械学習は、GPCR と G タンパク質の結合のタンパク質残基ネットワークを分析し、その選択性の構造的基盤を見つけることができ、GPCR の研究に新しい方法を提供します。
04 AI-GPCR: 96.4%の未踏領域
過去 10 年間で、GPCR 分野における AI と機械学習の適用割合は着実に増加しました。 2022 年、3.6% GPCR 関連の論文で AI 関連の手法について言及されました。
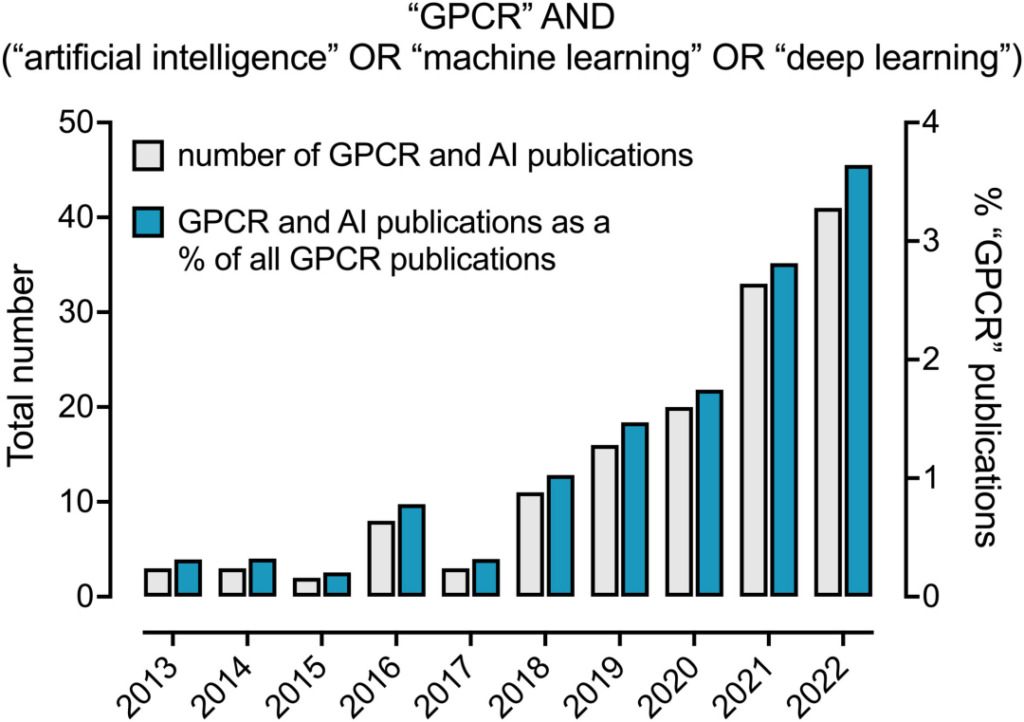
AIに言及しているGPCR関連論文の割合
GPCR医薬品研究におけるAIの応用が増加していることを考慮して、対応するアルゴリズムも継続的に開発されています。分類問題の場合、最も一般的に使用されるアルゴリズムは、サポート ベクター マシン (SVM)、デシジョン ツリー、勾配ブースティング マシン、k 近似などの scikit-learn ライブラリのアルゴリズムなど、従来の機械学習の分野で一般的に使用されているアルゴリズムです。近隣アルゴリズム。
タンパク質-リガンド結合親和性などの数値結果の場合は、多重線形回帰、サポート ベクター マシン、深層学習ネットワークなどの回帰アルゴリズムを使用して解決するのが一般的です。
最近の結果では、予測に多層パーセプトロンや畳み込みニューラル ネットワーク (CNN) などの深層学習アルゴリズムが主に使用されています。深層学習生成アルゴリズムの開発により、タンパク質のリガンドと構造の設計はより効率的かつ正確になりました。敵対的生成ネットワーク、リカレント ニューラル ネットワーク、強化学習などのアルゴリズムは、ベクトル空間の自動構築と適応測定を使用して、より大きな生成空間を探索できます。

GPCR医薬品開発のさまざまな段階におけるAIの役割
したがって、これらのアルゴリズムは、望ましい機能を持つより多くのリガンドを生成したり、未知のタンパク質の構造をより正確に予測したりできます。 アルファフォールド2 。 AlphaFold2 などのモデルは GPCR の構造を予測するために特別に設計されたものではありませんが、それでも GPCR の構造を効率的かつ正確に予測できます。さらに、教師なしまたは自己教師ありの深層学習も創薬分野で登場しつつあります。
AI-GPCR は将来の医薬品開発の新しい方向性となる可能性があることがわかりますが、96.4% という未知の領域も残されています。効率的な分類と正確な予測アルゴリズムの助けを借りて、人々は GPCR の結合メカニズムをより明確に理解し、生物医学の開発に新たな勢いを注入することができます。
