Command Palette
Search for a command to run...
華東科技大学の李紅林氏の研究グループが大環状薬剤の発見を加速するマックフォーマーを開発

大環状分子とは、12 個を超える原子で構成される小分子またはペプチドを指します。大環状化合物は他の小分子化合物と比較して、構造や性能において多くの利点を持っているため、さまざまな標的に対する潜在的な治療薬として注目されています。
医薬化学に基づいて合成される大環状類似体は、大環状薬物の主要な供給源です。しかし、合成方法の欠如、合成の難易度の高さ、参考資料の少なさなどの理由から、大環状薬剤の開発にはほとんど注目が払われてきませんでした。
この目的を達成するために、華東科技大学の Li Honlin 氏の研究グループは、Transformer に基づいて Macformer を開発しました。マクフォーマー氏は、非環式薬物フィゾチニブの大環状化に成功し、より強力な効力を持つ新しい化合物を取得し、医薬品開発の新しい方法を提供しました。
著者 | 雪才
編集者 | 三陽
大環状薬物の過去と現在
大環状分子とは、12 個を超える原子で構成される小分子またはペプチドを指します。。このタイプの化合物は分子量が高く、多数の水素結合供与体を持ち、より強い親和性、選択性、および薬理学的特性を備えています。大環状薬物はさまざまな標的に対する潜在的な治療薬とみなされている、キナーゼ、プロテアーゼ、G タンパク質共役受容体など。

天然の大環状薬物に加えて、医薬化学に基づいて合成された類似体も大環状薬物の主要な供給源です。既知の非環式薬物を大環状化することにより、新しい大環状薬物を直接かつ効率的に得ることができる、そして望ましい薬理学的特性を達成します。しかし、合成方法が乏しく合成難易度が高いため、大環状薬剤は依然として薬剤設計においてほとんど注目されていません。
現在、線状分子の大環状化は主に経験的推論に依存しています。。さらに、最終的な合成結果は文献に示されていますが、薬物の合成および誘導プロセスは常に不明瞭です。不透明で非標準的な合成プロセスは、業界の敷居を高め、大環状医薬品の開発を妨げてきました。
ディープラーニングは医薬品開発のさまざまな段階で大きな可能性を示していますが、ただし、ニューラル ネットワークのトレーニングには大量のデータが必要です。臨床的に承認された大環状薬剤が 90 未満であることを考慮すると、薬剤の大環状化に深層学習アルゴリズムを使用した研究はこれまでにありません。
この目的を達成するために、華東科技大学の李紅林氏の研究グループは、Transformer に基づいて Macformer を開発しました、直鎖状分子の大環状化を達成します。彼らは、異なる単純化分子線形入力仕様 (SMILES) を使用して同じ化合物を表すことにより、データ拡張を実現しました。
続いて、米国食品医薬品局 (FDA) によって承認された JAK2 阻害剤フェドラチニブを例として、Macformer を使用して大環状化し、新しい大環状化合物を取得しました。この化合物は選択性と薬物動態特性が優れているため、フィゾチニブよりも必要な用量が少なくなります。。この成果は『Nature Communication』に掲載されました。

紙を入手してください:https://www.nature.com/articles/s41467-023-40219-8
公式アカウントをフォローし、バックグラウンドで「Macrocyclic Drugs」に返信すると論文全文のPDFが入手できます
実験プロセス
データセット:データ拡張された ChEMBL データセット
まず研究者らは、ChEMBL データベースから 18,357 個の生物学的に活性な大環状化合物を収集し、スクリーニングしました。続いて、大環状化合物の任意の 2 つの化学結合が横断され、それらのリンカーが分割され、対応する非環状化合物が見つかります。最終的に、この研究のデータセットとして、合計 237,728 対の大環状-非環状化合物が得られました。。
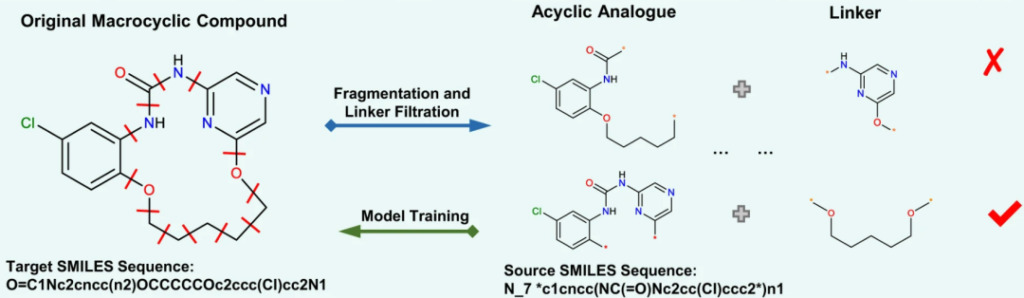
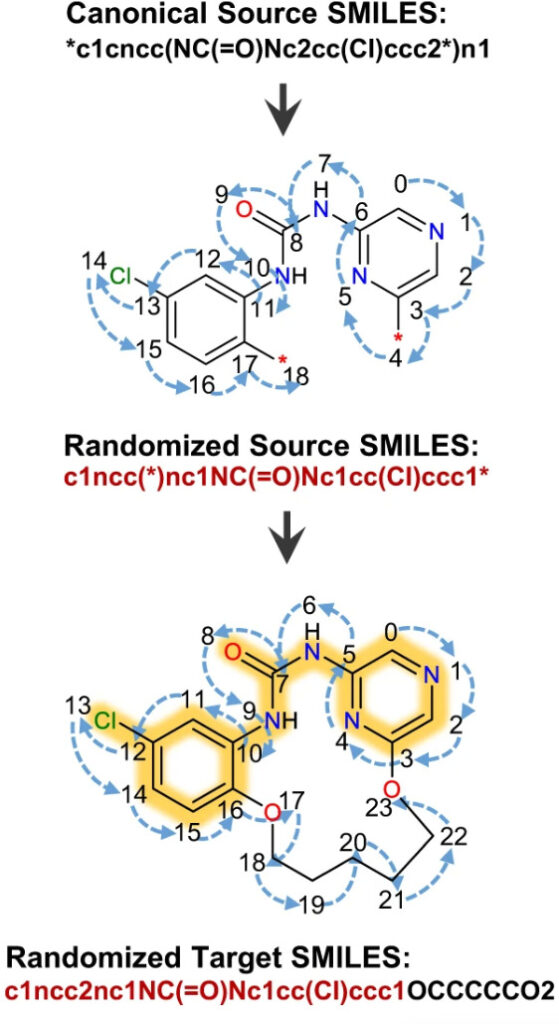
各化合物には特定の SMILES 式があります。しかし、最近の研究によると、化学的には同一だが構文的には異なるランダムな SMILES 式のセットを使用したモデルのトレーニングこれにより、深層学習モデルのパフォーマンスが大幅に向上します。研究者らは、2、5、10 倍に拡張したデータを元のデータと比較したところ、すべてのデータで 50,000 ステップ後の収束効果が向上しました。
モデルアーキテクチャ:トランスフォーマーコーデック
Macformer は Transformer アーキテクチャに基づいて実装されています。入力化合物とターゲット化合物の両方の SMILES シーケンスはトレーニング可能な行列に埋め込まれ、サイン関数とコサイン関数によって位置エンコードされます。
入力化合物の埋め込み行列がエンコーダに供給されて、潜在表現が生成され、エンコード プロセスが初期化されます。各エンコーダ層は、マルチヘッド アテンション層と位置フィードフォワード ネットワークで構成されます。
Macformer の最終目標は、クロスエントロピー損失関数を通じて予測配列と対応するターゲット配列の間のギャップを最小限に抑え、予測された大環状化合物を出力することです。。

比較研究:ChEMBL データセット
研究者らは Macformer と非深層学習モデル MacLS を比較しました。非環式化合物を入力した後、両方とも大環状類似体を出力できます。したがって、大環状分子の化学的妥当性、新規性、独自性がモデル性能の評価基準として使用されます。。
元のデータ セットと比較して、2 倍に拡張されたデータ セットでは、特に回復率 (96.09% 対 54.85%)、有効性 (80.34% 対 66.74%)、およびコネクタの新規性 (58.911 TP3T) において、モデルのパフォーマンスが包括的に向上しました。 vs. 40.56%)、データセットをさらに拡張してもモデルのパフォーマンスは向上しませんでした。
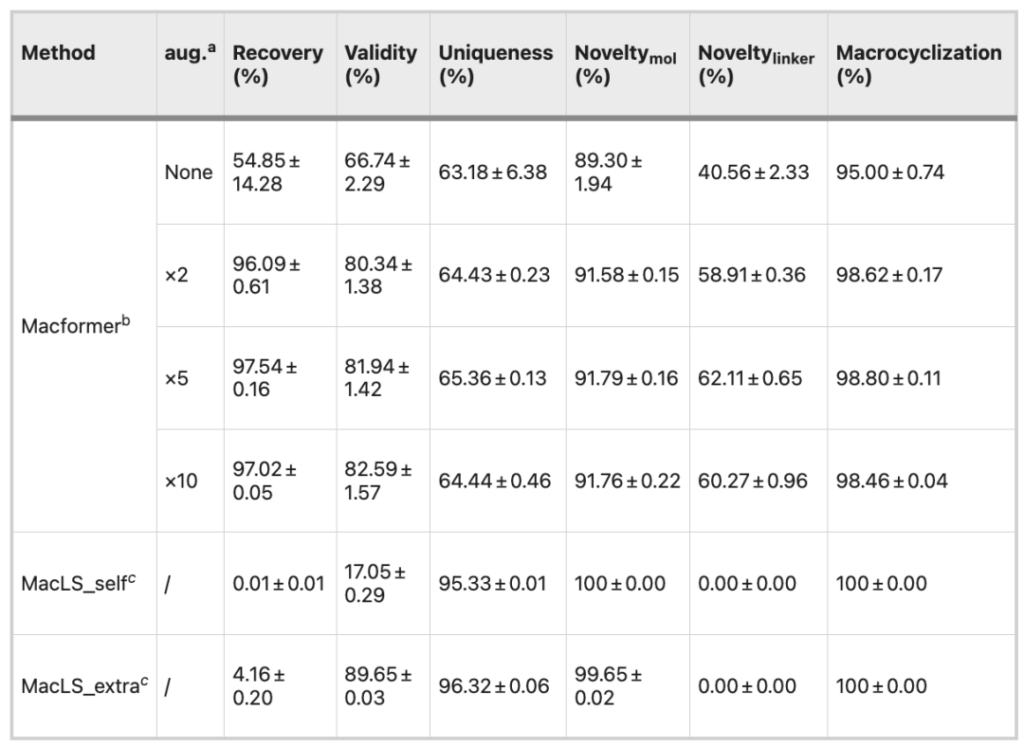
MacLS_self は非環状 SMILES を使用して最初からコンフォメーションを生成しますが、MacLS_extra はターゲット大環状分子の低エネルギー 3D 構造からコンフォメーションを抽出します。
MacLS_self の有効性はわずか 17.05% ですが、MacLS_extra の化合物の新規性と独自性は Macformer を上回ります。ただし、MacLS はトレーニング セットからのみコネクタを検索できるため、コネクタの新規性は 0 です。さらに、MacLS による大環状化合物の回収率も非常に低く、5% 未満です。
比較研究:ZINC データセット
さらに、2 つのモデルは外部データセット ZINC 上で比較されました。 5 倍に拡張されたデータセットでトレーニングされた Macformer モデルは、80% を超える回収率、84% を超える有効性、99% を超える新規性を備えています。以上の結果より、データ拡張後の Macformer は汎化能力に優れていることが分かります。
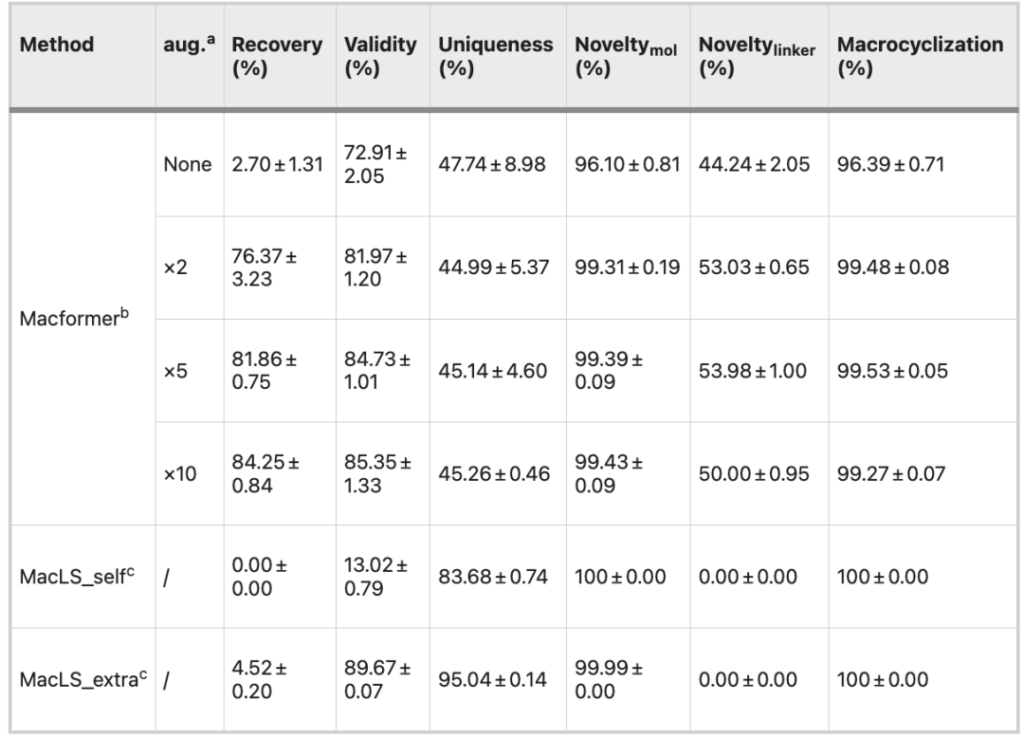
MacLS には Macformer のような学習機能がないため、さまざまなデータセットに対する結果は基本的に似ています。
化学物質の分布:Macformer は入力に似ています
リンカーの新規性に関係なく、Macformer と MacLS は両方とも新しい大環状分子を生成する能力を持っています。したがって、研究者らは、化学空間における 2 つによって生成される化合物の分布を比較しました。
まず、谷本係数を用いて化合物間の類似性を比較した。非環式化合物と大環状化合物の構造類似性により、モデルによって生成されたほとんどの化合物のタニモト係数は 0.7 を超えています。ただし、Macformer は、MacLS_extra よりも元の化合物に構造的に類似した化合物を生成します。
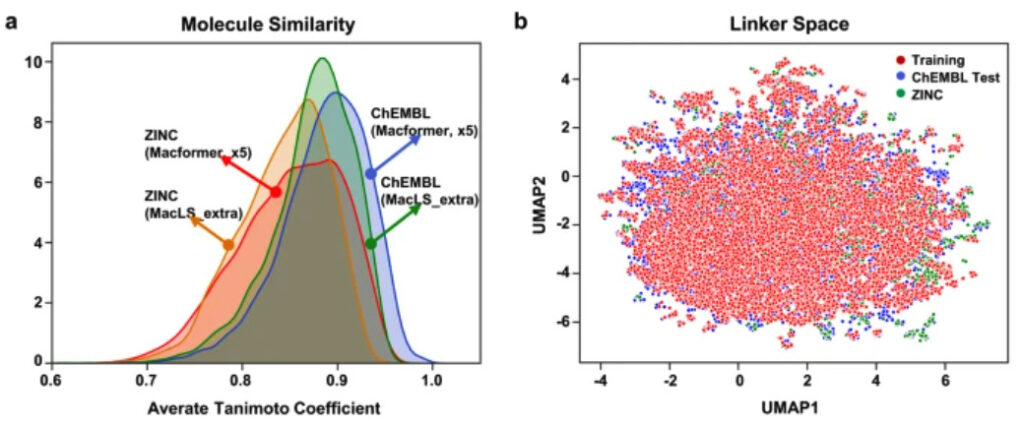
Macformer はトレーニング セットに存在しない接続を推測できるのに対し、MacLS にはこの機能がないため、この結果は異常です。この目的を達成するために、研究者らは統一多様体近似および投影アルゴリズム (UMAP) を使用してデータの次元削減を実行しました。結果は次のようになります。Macformer によって生成された新しいコネクタはすべて ChEMBL トレーニング セットの近くに配布されます。
実験による検証
創薬:フィゾチニブの大環状化
近年、大環状化合物がキナーゼ阻害剤の可能性として大きな注目を集めています。モデルの予測性能を検証するために、研究者らは Macformer を使用して JAK2 阻害剤を設計しました。 JAK2 はキナーゼの JAK ファミリーに属し、骨髄増殖性腫瘍および関節リウマチの治療の重要な標的です。
モデルへの入力は、骨髄線維症の治療に使用される小分子薬であるフィゾチニブです。フィゾチニブは他の JAK キナーゼよりも JAK2 に対する選択性が高いですが、他のキナーゼに対する選択性が低く、他の副作用を引き起こします。
大環状化の結合点は 2 つの末端ベンゼン環に設定され、Asp994 ターゲットとの接触に有害な可能性がある tert-ブチルフラボノイドを除去します。予測される大環状薬剤の多様性を高めるために、各ソース SMILES 配列は 10 倍に拡張されました。最終的に、Macformer は 281 の新しいマクロサイクルを含む 10,700 の結果を出力しました。。
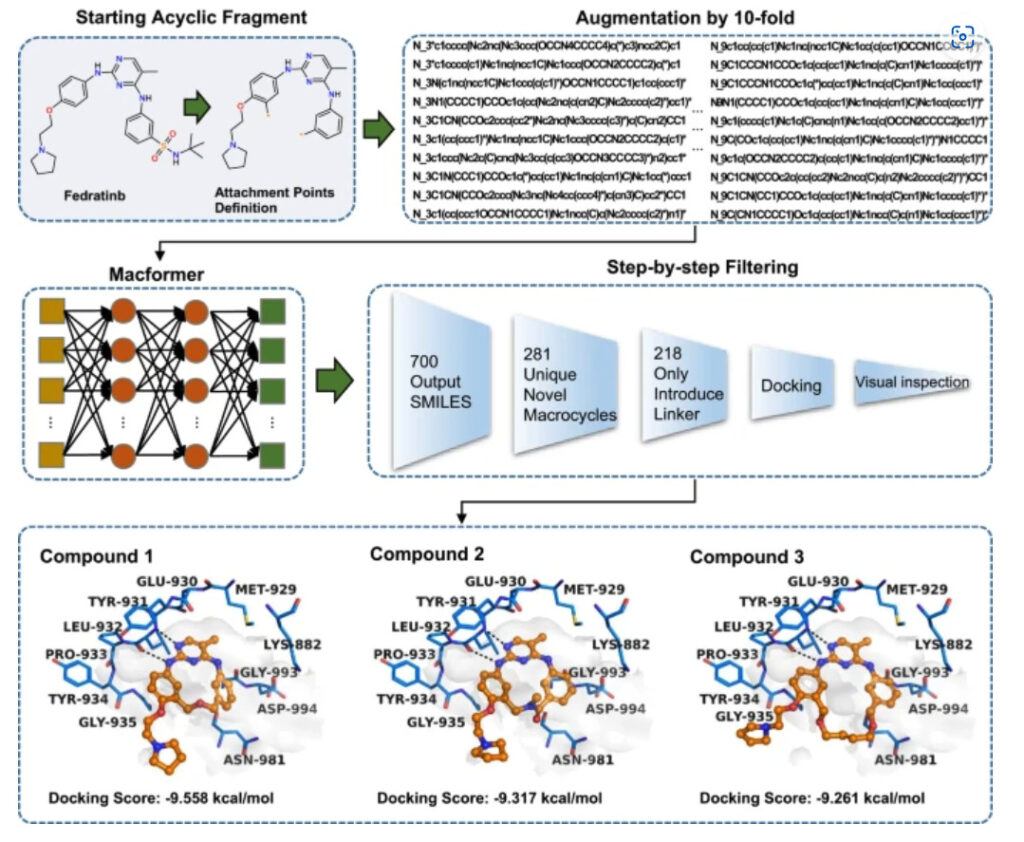
大環状薬物と標的の結合および合成の実現可能性を評価した後、研究者らは最終的に合成評価試験用に 3 つの化合物を選択しました。このうち、化合物 1 のリンカーは大環状薬剤の設計や JAK2 阻害剤の開発において報告されていません。。
MacLS によって設計された 300 種類の大環状薬剤の中には、これら 3 つの化合物は見つかりませんでしたこれは、新薬の設計における深層学習アルゴリズムの可能性を改めて証明しました。
インビトロ評価:酵素および細胞レベルの活性
続いて、これら 3 つの化合物の JAK2 に対する活性を評価しました。それらの半数阻害濃度 (IC50) はそれぞれ 0.07、0.364、および 0.006 μM です。 。最も強力な 1 と 3 の特異性を 100 μM で評価したところ、それぞれ 10 個と 17 個の野生型キナーゼのみが阻害されましたが、フィゾチニブは 34 個の野生型キナーゼに影響を及ぼし、化合物 1 と 3 の選択性がより優れていることが示されました。
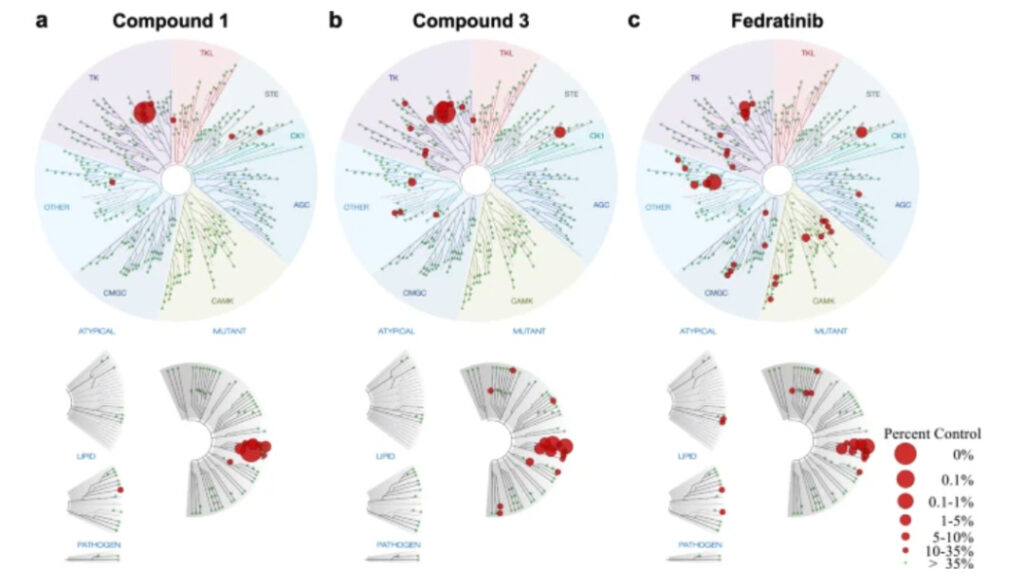
同時に、JAK2依存性細胞に対する化合物1〜3の抗増殖特性も評価した。結果は次のようになります。化合物 1 および 3 は、フィゾチニブよりも低用量で JAK2 依存性の細胞増殖を促進できます。。
インビボ評価:薬物動態検査
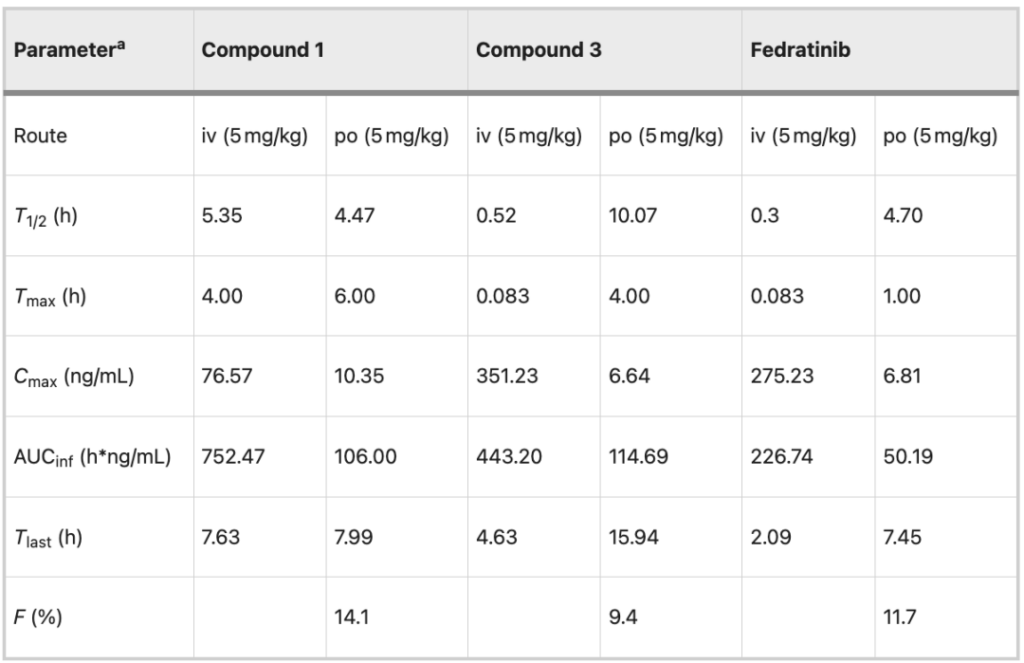
最後に、化合物1、3および静脈内(i.v.、5mg/kg)および経口(p.o.、5mg/kg)投与されたフィゾチニブの薬物動態(PK、薬物動態)を研究した。
バイオアベイラビリティ (9.4% 対 11.7%) を除いて、化合物 3 は全体的にフィドラチニブより優れていました。同時に、化合物 1 は、全身曝露 (106.00 対 50.19 h*ng/mL) や生物学的利用能 (14.1% 対 11.7%) などの経口特性においても利点があります。上記の結果は次のことを示しています。大環状化はフィゾチニブ薬の代謝安定性の改善に有益です。
インビボ試験:化合物 3 による炎症の抑制
JAK2 の過剰発現は炎症性腸疾患 (IBD) を引き起こす可能性があることが報告されており、これは JAK2 活性の阻害が炎症性腸疾患の治療に役立つ可能性があることを意味します。研究者らは、IBDの治療における大環状薬剤の役割を評価するために、マウスモデルで大環状薬剤を試験した。
薬物動態試験の結果によると、フィゾチニブの用量は化合物 3 の 2 倍でした。結果は、化合物 3 とフィゾチニブの両方が IDB による体重減少を軽減し、実験グループの疾患活動性指数が 8 日目から大幅に減少したことを示しました。
最後に、HE 染色を使用して炎症の重症度を分析しました。対照群では、炎症細胞浸潤、杯細胞の喪失などの重大な炎症反応が示されましたが、実験では炎症反応は穏やかで、結腸の構造は無傷でした。

上記の結果は、Macformer によって推定された大環状化合物が薬物動態と選択性において従来の薬物よりも優れており、より低用量で病気を治療できることを示しています。
高い効能と合成の難しさ、大環状分子の悲喜こもごも
2020年現在、米国食品医薬品局 (FDA) は合計 67 種類の大環状薬剤を承認しており、承認された全薬剤の 4% を占めています。 。そのうち 59 種類は天然大環状薬物であり、非天然薬物は 8 種類のみです。 2008 年、FDA は癌治療用として初の非天然大環状薬剤であるプレリキサフォルを承認しました。
大環状薬の主な適応症は感染症で、44.4%を占め、次いで腫瘍(20.8%)、抗真菌薬(8.3%)が続く。近年、抗腫瘍目的での大環状薬剤の使用が劇的に増加しています。 2007 年以前は 4 種しかありませんでしたが、それ以降 11 種が承認されました。

大環状薬物は、半硬質の事前に組織化された構造で多様な機能と複雑な化学構造を提供することができ、これにより、従来の小分子に結合することが困難な標的に対する大環状薬物の親和性と選択性が向上し、それによって薬効が向上します。さらに、一部の大環状薬物は、外部環境に適応するために立体構造を調整することができます。この能力により、水溶性と細胞透過性が高まります。
しかし、大環状薬物の合成は非常に複雑です。大環状構造は特定の標的に結合する能力を強化する一方で、環ひずみ (Ring Strain)、立体相互作用、および非共有結合による環間相互作用も引き起こします。分子構造と特性の予測がより困難になる。
医薬品開発におけるAIの活用はますます進んでいます。ただし、データ量が限られているため、AI のパフォーマンスが制限されることがよくあります。この研究では、研究者はランダムな SMILES 式を使用してデータ拡張を実行しました、データセットの豊富さを確保しながら、Macformer の予測パフォーマンスも向上します。
将来的には、薬物の構造と特性に対する人々の理解が深まるにつれ、人々の健康を守るための新薬の研究開発プロセスにAIがより高度に関与するようになるでしょう。
参考リンク:
[1]https://www.cambridgemedchemconsulting.com/resources/hit_identification/macrocycles/macrocycles.html
[2]https://pubs.acs.org/doi/10.1021/acs.jmedchem.3c00134








