Command Palette
Search for a command to run...
細胞の老化を拒否し、加齢に伴う病気から遠ざけるために、エディンバラ大学は細胞に対する3つの「AIアンチエイジング処方箋」を発行した。
内容の概要:研究によると、細胞の老化は、がん、2型糖尿病、変形性関節症、ウイルス感染症などの疾患と密接に関連していることがわかっています。老化細胞を除去する薬剤は徐々に研究開発のホットスポットになってきましたが。しかし、十分に特徴づけられた分子標的が不足しているため、老化防止化合物 (Senolytics) はほとんど発見されていません。最近、研究者らが3つの新しい老化細胞破壊薬を発見したという研究結果が国際学術誌「Nature Communications」に掲載された。
キーワード:Senolytics 機械学習 XGBoost
この記事は、HyperAI Super Neural WeChat パブリック プラットフォームで初めて公開されました~
太古の昔から、人々は不死を追い求めてきました。驚くべきことに、近年、アンチエイジングや長寿などのテーマは、神秘的で幻想的な健康製品の世界から、一般に認知される医療・健康の世界へと移りつつあります。一般的な理解では、老化は体の機能がゆっくりと衰えていくプロセスであり、そのプロセスは元に戻すことができないため、人間は自然の成り行きに身を任せることしかできません。ただし、多くの人が理解していないのは、世界保健機関はすでに2018年に国際疾病規約の中で、老化は治療可能な病気であると発表しました。
広範な老化の定義の中で、細胞老化は科学者によって最近研究されている注目のトピックの 1 つです。細胞老化は、細胞分裂の停止を特徴とする現象です。通常、人間の免疫系は老化細胞(老化細胞)を効果的に除去しますが、年齢が上がるとこの除去機能が徐々に弱くなり、視力の悪化や運動能力の制限などを引き起こすだけでなく、がんを引き起こしやすくなります。アルツハイマー病や他の多くの病気。
2015年、メイヨークリニックのジェームズ・L・カークランド博士らは、老化細胞を除去できる初の抗老化薬(セノリティクス)を発見した。Senolytics は、老化細胞の死を選択的に誘導する小分子化合物を指し、その名前は Senense (老化) と Lytic (破壊) に由来しています。最新の研究では、エディンバラ大学とカンタブリア大学が機械学習を使用して、ギンゲチン、ペリプロシン、オレアンドリンという 3 つの老化細胞破壊薬を発見し、それらの抗老化効果をヒト細胞株で検証しました。この研究は、「機械学習を使用したセノリティクスの発見」というタイトルで「Nature Communications」誌に掲載されました。

図 1: 研究結果は Nature Communications に掲載されました
用紙のアドレス:
https://www.nature.com/articles/s41467-023-39120-1#Sec2
実験プロセス
データセット
この実験データセットは、学術出版物や商業特許などの複数のソースから得られています。まず研究者らは、58 種類の既知の老化細胞破壊物質をマイニングし、次に 2 つの既存の化学ライブラリ、LOPAC-1280 と Prestwick FDA-approved-1280 からさまざまな非老化細胞破壊物質をマイニングしました。データセットは 2 つを統合します。合計 2,523 種類の化合物が含まれており、そのうち Senolytics は 2.3% を占めます。

図 2: 機械学習モデルのトレーニングに使用される化合物
答え:トレーニング データは複数のソースから取得されます。
b:トレーニングに使用される 58 の Senolytics ソース (各ソースの化合物と細胞株の数を含む)。
モデルのトレーニング
研究者らは上記のデータセットを使用してモデルをトレーニングし、老化細胞破壊(陽性)特性を持つ化合物を特定しました。まず、研究者はデータセットに対して特徴選択を実行しました。このプロセスでは、ランダム フォレスト (RF) モデルを使用して各特徴の平均ジニ指数減少を計算し、最も重要な 165 の特徴を選択しました。これにより、特徴の数が減り、モデルの複雑さが軽減されました。
- ジニ指数は、ノード内のサンプルがどの程度混合されているかを測定します。値が低いほど、ノード内のサンプルはより純粋になります。
次に、研究者らは、完全なデータセット内の 165 の最も重要な特徴とさまざまなサンプル データを使用して、複数の Senolytics バイナリ分類モデル (Senolytics または非 Senolytics を識別する) を開発しました。モデルを比較し、限られた数の Senolytics サンプルを活用するために、研究者らはデータセットに対して 5 重の相互検証を実行し、精度、再現率、F1 スコアの 3 つのパフォーマンス指標を使用してモデルをスコアリングしました。
当初、研究者らは主にサポート ベクター マシン (SVM) と RF モデルに焦点を当てていましたが、実験的にはそれらのパフォーマンスが理想的ではないことが判明しました。また、ロジスティック回帰分析、ナイーブ ベイズ分類器、不均衡分類のためのデータ拡張 (SMOTE) など、さまざまな複雑さの他のモデルも評価しましたが、結果は、これらのモデルのパフォーマンスが SVM モデルや RF モデルほど良くないことを示しました。
したがって、研究者らは RF パフォーマンスに基づいて XGBoost モデルを開発しました。デシジョン ツリー モデルを繰り返しトレーニングすることで予測力を向上させます。図 3b に示すように、XGBoost モデルは精度、再現率、および F1 スコアが向上し、検討したすべてのモデルの中で最高のパフォーマンスを示します。
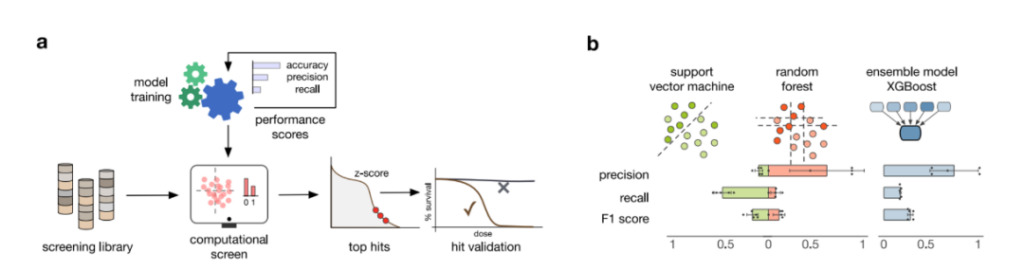
図 3: 機械学習モデルのトレーニング
答え:モデルのトレーニング、化合物のスクリーニング、および結果の検証プロセスでは、複数のパフォーマンス指標を使用して適切なモデルを選択します。
b:3 つの機械学習モデルのパフォーマンス。棒グラフは 5 分割相互検証で計算された平均パフォーマンス メトリックを示し、エラーバーは 1 つの標準偏差を表します。
この実験データセットのアドレスは、後で HyperAI 公式 Web サイトに同期されます。
https://doi.org/10.5281/zenodo.7870357
実験結果
まず、研究者らは、4,340 を超える化合物から 21 の化合物をアンチエイジング活性の可能性についてスクリーニングしました。その後、これら 21 種類の化合物をテストしました。図 4 に示すように、そのうちの 3 つは老化細胞除去効果があります。ペリプロシンとオレアンドリン (老化細胞を除去できるかどうかは確認されていない 2 つの強心配糖体)、およびギンゲチン (天然の無毒ビフラボノイド化合物) です。
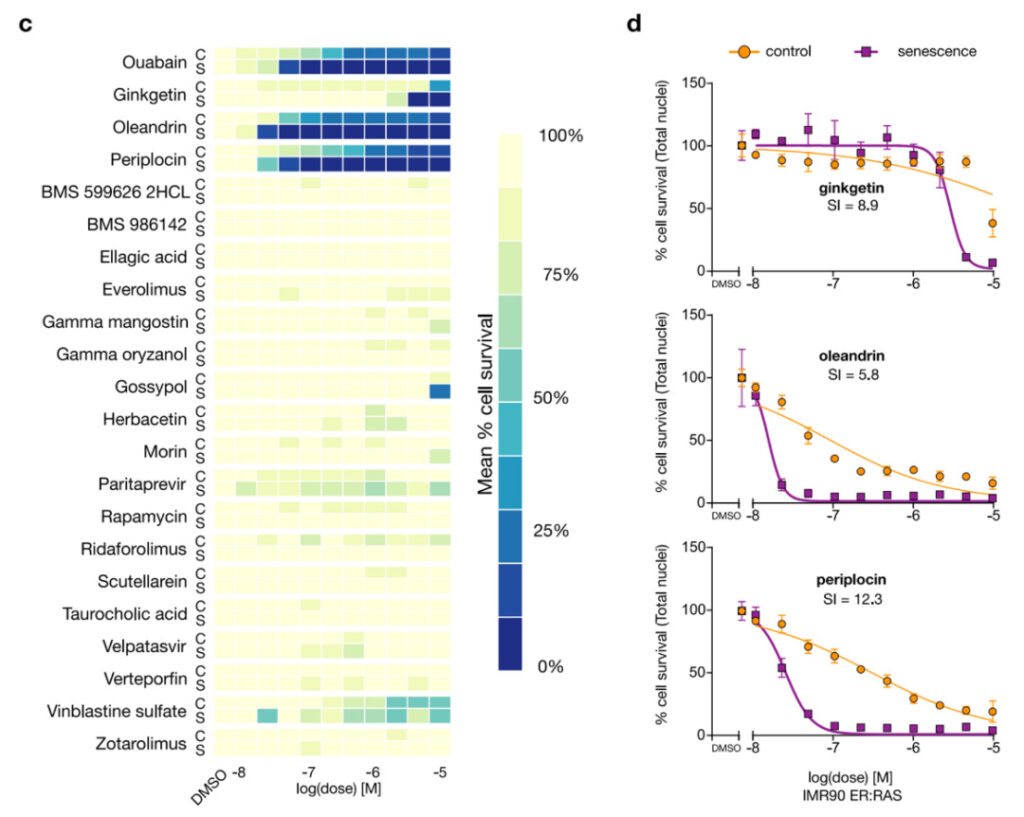
図 4: ペリプロシン、オレアンドリン、およびギンゲチン 老化細胞除去効果あり
c:実験検証。 21 の化合物のうち 3 つが老化防止活性を示しました: ギンゲチン、オレアンドリン、ペリプロシン。ヒート マップは n = 3 回の反復実験の平均を示しています。写真のウアバインはSenolyticsに知られています。
d:新しく発見された 3 つの老化防止化合物の用量反応曲線。 SIとはアンチエイジング指数のことです。
また、上記の実験過程において、研究者らはまた、新たに発見されたオレアンドリンが、特に低濃度でウアバインよりも老化防止効果が高いことも発見した。したがって、研究者らは、ペリプロシン、オレアンドリン、およびウアバインの抗老化活性を 10 nM の低濃度で比較しました。
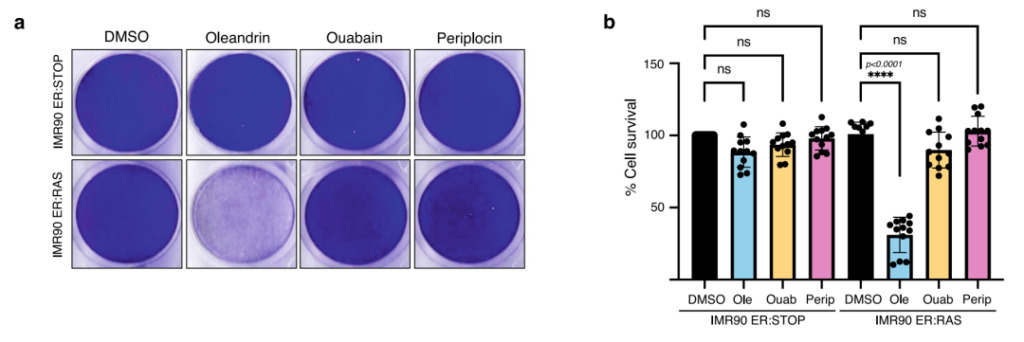
図 5: ペリプロシン、オレアンドリン、およびペリプロシン 低濃度での老化防止特性の比較
答え:この図は、100 nM 4OHT で培養した IMR90 ER:RAS (老化細胞) および IMR90 ER:STOP (コントロール) 組織培養ディッシュを示しています。次の 72 時間にわたって、10 nM オレアンドリン、ウアバイン、ペリプロシン、および DMSO (対照) で治療を実施しました。
b:細胞生存率は定量分析によって評価されました。
図5bに示すように、低濃度のウアバインおよびペリプロシンは、IMR90-ER:STOPおよびIMR90-ER:RASにおいて明らかな細胞毒性を示さなかった。オレアンドリンによる治療後、IMR90-ER:RAS の老化細胞の生存率は大幅に減少しました。これは、オレアンドリンがより低い薬物濃度で強力な抗老化活性を有することを示しています。上記の実験結果に基づいて、機械学習は老化防止化合物の発見に成功し、既存の老化防止化合物よりも老化防止効果が高いオレアンドリンも発見しました。
AI を活用した創薬
AI は新薬開発のあらゆる段階で重要な役割を果たします。現在、研究は創薬と前臨床開発段階に焦点を当てています。この研究は、特に複雑な生物学的構造や既知の分子標的がほとんどない疾患を扱う場合、医薬品開発における AI の可能性を実証しています。著者のディエゴ・オヤルズンは次のように指摘しています。「AI は、特に創薬の初期段階において、新薬候補の発見に非常に効果的です。」
研究の共著者の一人であるヴァネッサ・スメル・バレト氏は、データサイエンティスト、化学者、生物学者の緊密な協力の重要性を強調した。彼女はこう言いました。「この研究は、データサイエンティスト、化学者、生物学者の緊密な協力から生まれました。私たちはこの学際的なコラボレーションを利用して、モデルのトレーニングに公開されたデータのみを使用することで堅牢なモデルを構築し、スクリーニング コストを節約しました。」この協力モデルは、AI 応用を加速する新たな機会を提供し、医薬品の研究開発におけるイノベーションと開発を促進することが期待されています。
現在、AI は新薬の研究開発において画期的な進歩を遂げていますが、データの品質と信頼性、アルゴリズムの解釈可能性、モデルの一般化機能など、依然としていくつかの課題に直面しています。テクノロジーの継続的な進歩とデータリソースの増加に伴い、医薬品の研究開発における AI の応用の可能性は依然として非常に広いです。データ共有と学際的な協力を強化することで、AI の利点をより有効に活用して新薬の発見と開発を加速し、人間の健康に利益をもたらすことができます。
参考記事:
[1]http://zixun.69jk.cn/shwx/79532.html
[2]https://en.wikipedia.org/wiki/Cellular_senescent#老化細胞の特性
[3]https://newatlas.com/medical/machine-learning-algorithm-identifying-natural-anti-aging-chemicals/
[4]https://www.sohu.com/a/673349496_121124375
[5]https://www.ed.ac.uk/institute-genetics-cancer/news-and-events/news-2023/ai-algorithms-find-drugs-that-could-combat-ageing
[6]http://www.stcn.com/article/detail/904319.html
この記事は、HyperAI Super Neural WeChat パブリック プラットフォームで初めて公開されました~