Command Palette
Search for a command to run...
AI がスーパーバグと戦う: マクマスター大学がディープラーニングを使用して新しい抗生物質アバウシンを発見
内容の概要:アシネトバクター・バウマニは、院内で感染する一般的なグラム陰性病原体であり、多くの場合多剤耐性を示します。従来の方法では、この細菌を阻害する新しい抗生物質を発見することは困難です。しかし、機械学習を使用すると、化学空間を迅速に探索でき、新規の抗菌分子を発見する可能性が高まります。最近、研究結果が国際ジャーナル「Nature Chemical Biology」に掲載されました。
キーワード:アシネトバクター・バウマニ・アバウシンディープラーニング
この記事は、HyperAI Super Neural WeChat パブリック プラットフォームで初めて公開されました~
アシネトバクター・バウマニ(学名:Acinetobacter baumannii、通称:AB菌)は、アシネトバクター属の中で最も一般的なグラム陰性桿菌であり、自然界の水中や土壌中に広く存在し、人間の正常な皮膚や気道にも存在します。 、消化管および泌尿器管。この細菌は院内感染でよく見られますが、水産養殖動物の病原性細菌でもあります。菌血症、肺炎、髄膜炎、腹膜炎、心内膜炎、尿路感染症、皮膚感染症がよく起こります。
アシネトバクター・バウマニは、湿熱、紫外線、化学消毒剤に強く、低温にも強い。従来の消毒剤はその増殖を阻害するだけで、殺すことはできませんが、医療従事者の手や医療機器から最も多く分離されるグラム陰性桿菌です。 、およびオブジェクトの表面。抗生物質の乱用により、アシネトバクター バウマニは多剤耐性を獲得しており、世界保健機関によって世界で最も危険な抗生物質耐性菌の 1 つとして認識されています。
最近、マクマスター大学のゲイリー・リュー氏やマサチューセッツ工科大学のデニス・B・カタクタン氏らの研究者らは、深層学習を利用して約7,500の分子をスクリーニングし、アシネトバクター・マニメンスに対するB.新規抗生物質を阻害する化合物を同定した。現在、この研究は「アシネトバクター・バウマニを標的とする抗生物質の深層学習に基づく発見」というタイトルで「Nature Chemical Biology」誌に掲載されている。

研究結果は雑誌「Nature Chemical Biology」に掲載されました。
口論記事アドレス:
https://www.nature.com/articles/s41589-023-01349-8#access-options
実験プロセス
データセット
研究者らは、LB培地でのAcinetobacter baumannii ATCC 17978の増殖に基づいて7,684個の小分子をスクリーニングした。これらの小分子には、2,341 種類のジェネリック医薬品と 5,343 種類の合成化学物質が含まれており、これらはすべてブロード研究所のハイスループット スクリーニング サブライブラリによって提供されています。彼らは、従来のヒットレートカットオフ(つまり、データセット全体の平均増殖阻害率より標準偏差が1未満である分子)に基づいて、480の分子を「活性」、7,204の分子を「不活性」と特定した。
モデルのトレーニング
モデルの構造を強化するために、研究者らは分子の特性評価を、RDCit を使用して計算された 200 の追加の分子レベルの特徴と結び付けました。さらに、モデルのパフォーマンスをさらに向上させるために、研究者らは 10 個のモデルのアンサンブルを使用して、7,684 個の分子 (有効な例が約 6.2%) のトレーニング データセットでモデルを構築およびトレーニングし、そのモデルを最新の薬物再利用に適用しました。ハブ。研究者らは、データセットを 80% トレーニング データ、10% 検証データ、および 10% テスト データにランダムに分割しました。
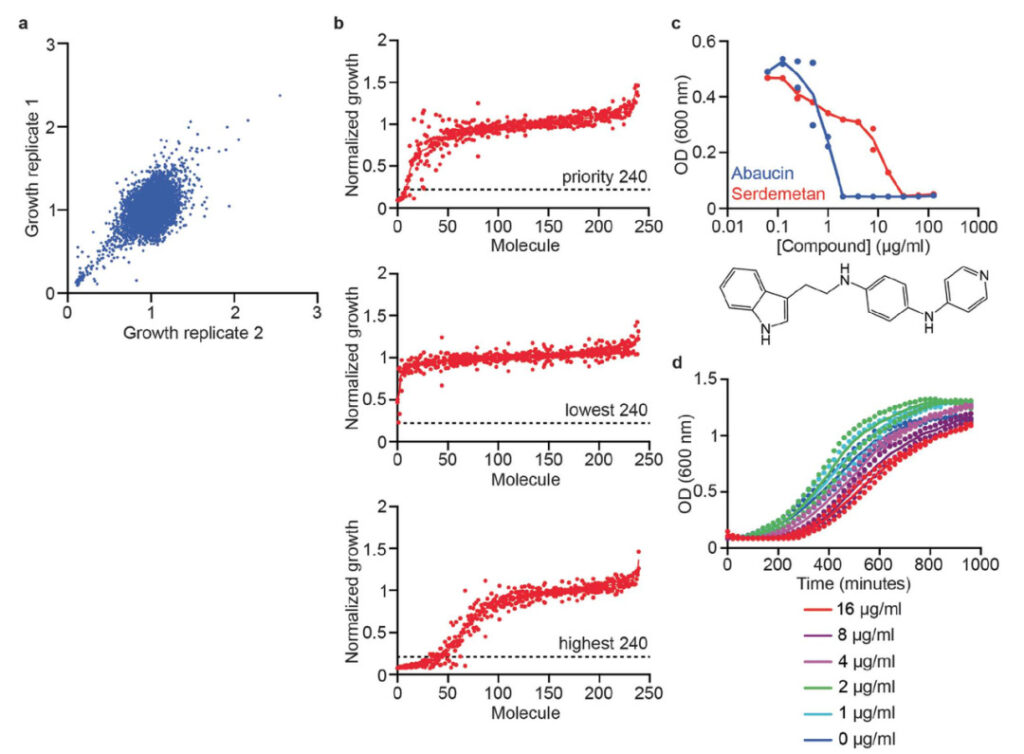
図 1: モデルのトレーニング データ
a. LB培地中のAcinetobacter baumannii ATCC 17978の増殖を50μMで阻害する7,684個の小分子の予備スクリーニングデータ。
b. 予測セットから検証用に選択された 240 個の優先分子のランク付けされた成長阻害データ (上)、最も低い予測スコアを持つ 240 個の予測分子のランク付けされた成長阻害データ (中央)、トレーニング データに見つからなかった最も高い予測スコアを持つ 240 個の予測分子のランク付けされた成長阻害データ。 set 予測分子のランク付けされた成長阻害データ (下)。水平破線は、50 μM での >80% 増殖阻害の厳密なヒット カットオフを表します。
c. アシネトバクター バウマニの増殖は、LB 培地中でアバウシン (青) とセルデメタン (赤) によって阻害されます。
d. 異なる濃度のアバウシンで6時間処理したアシネトバクター・バウマニ細胞の増殖動態。
コードの取得:
https://github.com/chemprop/chemprop
マウスモデルの実験
研究者らは、ラット好中球減少症の実験開始の4日前と1日前に、それぞれ150 mg/kgと100 mg/kgのシクロホスファミドを注射することで、生後6〜8週の雌C57BL/6Nマウスを前治療した。 0日目に、マウスをイソフルランで麻酔し、鎮痛剤としてブプレノルフィンを0.1mg/kgの用量で腹腔内注射した。研究者らは、約30~35枚の高圧テープを使ってマウスの背中に2平方センチメートルの擦り傷を残し、それをテープを通して表皮の基底層まで剥がし、その後マウスに〜を感染させた。 6.5 x 106 CFU A. バウマニ ATCC 17978。マウス (n = 5/6) を、アバウシン (実験グループ) または DMSO (対照グループ) を含む ~10 ~ 20 μl の Glaxal Base で、投与後 1、2、3、4、6、10、21、および 24 時間後に処理しました。感染症を治療します。
実験結果
研究者たちは、機械学習の助けを借りて、アバウシンと呼ばれる抗菌化合物を発見しました。アシネトバクター バウマンニに対する活性スペクトルは狭く、LolE 機構に干渉することでリポタンパク質の輸送プロセスに干渉する可能性があります。以下の図は、ディープラーニングに基づいてアバウシンを発見するプロセスを示しています。
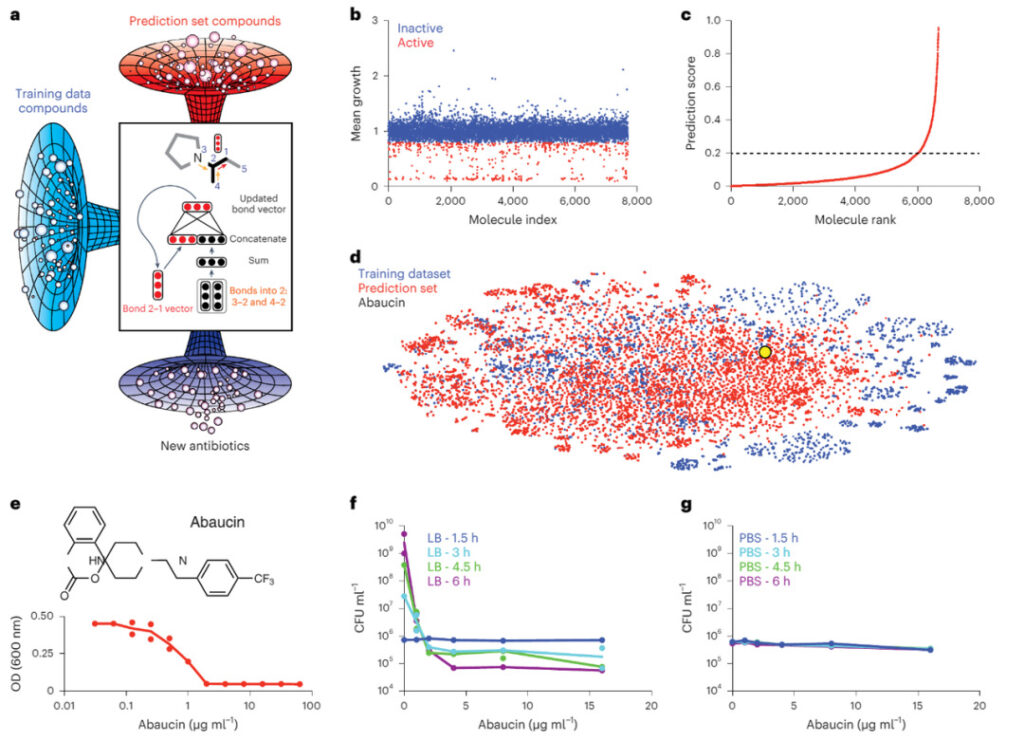
図 2: 機械学習によるアバウシンの発見
a. 約 7,500 個の分子がスクリーニングされ (青)、この増殖阻害データセットでトレーニングされ、薬物再利用センターで予測された指向性情報伝達のためのディープ ニューラル ネットワーク (赤)、アシネトバクター バウマニを阻害できる新しい分子 (紫)。
b. 50 μM の 7,684 個の小分子のコレクションによる Acinetobacter baumannii ATCC 17978 の増殖阻害。
c. トレーニングされたモデルは、薬物再利用センター内の分子の予測スコアをランク付けします。予測スコアが 0.2 を超える分子は予備候補です。
d. トレーニング データ セット (青)、予測セット (赤)、およびアバウシン (黄色) の間の化学的関係を示す t-SNE プロット。
e. LB培地におけるアバウシンによるアシネトバクター・バウマニの増殖阻害。
f. 栄養豊富な条件下で、さまざまな濃度で 1.5 時間 (青)、3 時間 (青緑色)、4.5 時間 (緑)、および 6 時間 (紫) インキュベーション後のアシネトバクター バウマンニに対するアバウシンの殺傷能力。
g. 栄養欠乏条件下での 1.5 時間 (青)、3 時間 (青緑色)、4.5 時間 (緑)、および 6 時間 (紫) のインキュベーション後のアシネトバクター バウマニに対するアバウシンの致死率。
図2に示すように、研究者らは約7,500の分子をスクリーニングし、この増殖阻害データセットを使用してニューラルネットワークを訓練し、A.バウマニの活性を阻害できる新規分子を予測した。まとめると、これらのデータは、アバウシンが、ほとんどの既知の抗生物質と一致して、成長および分裂中に最大限に活性化される生物学的プロセスを阻害することによってその抗菌力を発揮することを示している。
さらに、アバウシンの in vivo 有効性をテストするには、研究者らはマウスの背中に傷の感染を確立した。
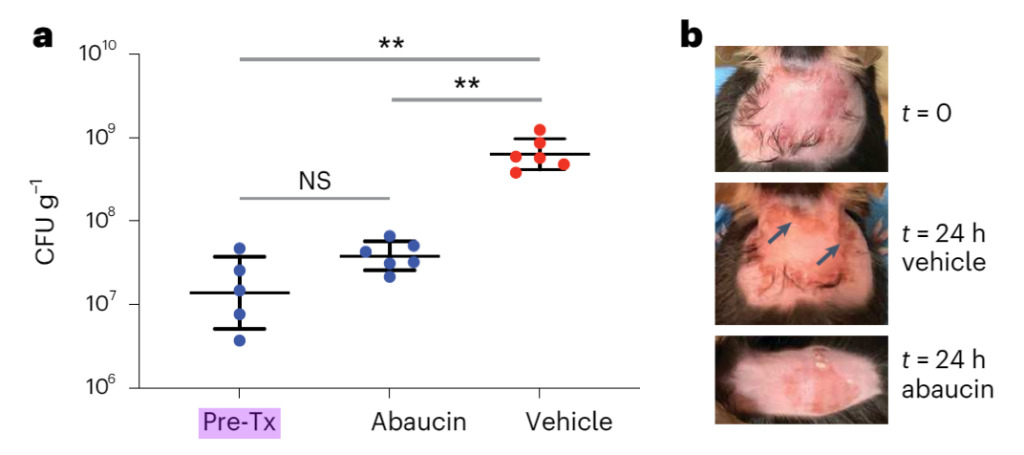
図 3: アバウシンは創傷モデルにおけるアシネトバクター・バウマンニ感染を阻害します
a. 背中の創傷感染モデルでは、マウスをアシネトバクター バウマンニ ATCC 17978 (約 6.5 x 106 CFU) に感染させました。感染の 1 時間後、マウスを DMSO (赤色、n = 6) または 4% アバウシン (青色、n = 6) で 24 時間以上処理しました。縦軸は、感染後 25 時間の創傷組織の細菌量です。 Pre-Tx は、初期治療時の細菌量を表します (n = 5)。黒い線は平均値±標準偏差を表します。 NS は統計的に有意ではないことを示します。 ** ウェルチ補正を使用した対応のない両側 t 検定を使用した P < 0.005 (Pre-Tx 対 4% アバウシンでは P= 0.0704、Pre-Tx 対 DMSO では P= 0.0034、DMSO との比較では P = 0.0039) 4% アバウシンを使用)。
ps 一般に、1 つのアスタリスクは p 値が 0.05 未満であることを意味し、2 つのアスタリスクは p 値が 0.01 未満であることを意味し、3 つの星は p 値が 0.001 未満であることを意味します。 p 値が小さいほど、有意性が強くなります。
b. 感染前 (t = 0)、DMSO で 24 時間処理した後、およびアバウシンで 24 時間処理した後のマウスの背面の画像。 DMSOで観察された炎症(矢印)は、アバウシンで処置したマウスには存在しなかった。
図 3 は、アバウシンによる治療後の創傷細菌量が DMSO 群よりも有意に低く、DMSO による治療の 24 時間後にまだ存在していた創傷炎症がアバウシンで消失したことを示しています。アバウシンはアシネトバクター・バウマニ感染症の制御に効果的です。
要約すると、研究者らはディープラーニングを使用して、アバウシンがアシネトバクター・バウマンニ感染を効果的に制御できることを発見しました。この研究は、新しい抗生物質を発見し、グラム陰性病原体に関する挑戦的な研究を導く上での機械学習の役割に焦点を当てています。
AI は新薬を発見する従来の方法を変える
この研究は、マクマスター大学のジョン・ストークス助教授、マサチューセッツ工科大学医工学・科学教授のジェームス・J・コリンズ氏、マクマスター大学大学院生のゲイリー・リュー氏とデニス・カタクタン氏らによって行われたことは注目に値する。 Jon Stokes、Gary Liu、Denise Catacutan は全員、Stokes Laboratory のメンバーです。

ストークス研究所の住所:
https://www.thestokeslab.com/projects
この研究室は、最先端のハイスループット生物学と現代の人工知能手法を活用して、新しい抗生物質を発見しています。具体的には、研究者らはコンピューターシミュレーションの巨大なデータベースから新しい抗生物質を予測するために深層学習モデルを訓練し、また新しい抗生物質の作用機序と生体内特性を予測するモデルも構築した。彼らは機械学習を使用して、研究開発コストを削減しながら新しい抗生物質の発見を加速します。
ストークス教授はかつてインタビューで「人工知能は新薬の発見方法を根本的に変えるだろう」と語った。この研究結果は、さまざまな困難な病原体に対する新しい抗生物質を発見する際の人工知能の重要性を示しており、このアプローチは他の抗菌療法の探索にも可能性を秘めています。人工知能はすべての問題を解決できるわけではありませんが、強力なツールとして、新薬の発見に役立ち、人々に希望をもたらすことができます。
参考記事:
[1]http://ccm.dxy.cn/article/805579
[2]https://zh.wikipedia.org/wiki/
[3]https://www.ctvnews.ca/health/scientists-use-ai-to-discover-antibiotic-for-very-difficult-to-treat-bacteria-1.6411927
- 以上 -