Command Palette
Search for a command to run...
Durch Den Horizontalen Vergleich Von 11 Algorithmen Hat Die Universität Toronto Ein Maschinelles Lernmodell Eingeführt, Um Die Entwicklung Neuer Langwirksamer Injizierbarer Medikamente Zu Beschleunigen
Laut dem „Bericht über die Ernährung und den chronischen Krankheitsstatus chinesischer Einwohner (2020)“ machten im Jahr 2019 Todesfälle durch chronische Krankheiten 88,51 % aller Todesfälle in meinem Land aus.Chronische Krankheiten sind zu einer der häufigsten Todesursachen geworden und bedrohen die menschliche Gesundheit.Nehmen wir als Beispiel Schizophrenie, eine chronische Krankheit, die von Wissenschaftlern als „die schlimmste Krankheit der Menschheit“ bezeichnet wird. Wenn Patienten sich vollständig erholen möchten, benötigen sie eine lange Erhaltungstherapie. Während dieser Zeit kann es jedoch vorkommen, dass Patienten die Einnahme des Medikaments aus verschiedenen Gründen unterbrechen, was zu einem Rückfall führen kann.
Um das Problem der mangelnden Medikamenteneinnahmetreue bei chronischen Patienten zu lösen, wurden Injektionen mit Langzeitwirkung entwickelt. Dieses Medikament wird hergestellt, indem eine ausreichende Dosis des Medikaments in einem bestimmten Präparat gelöst wird, das durch Injektion in den Körper gelangt, um ein kleines „Lagerhaus“ für das Medikament zu bilden, und das Medikament dann langsam im Körper freisetzt, um eine stabile therapeutische Wirkung zu erzielen. Im Vergleich zu herkömmlichen MedikamentenLangzeitinjektionen haben die Vorteile langer Dosierungsintervalle, schneller Wirkung und stabiler Medikamentendosierung.
Andererseits ist die Forschung und Entwicklung dieses neuen Arzneimitteltyps auch eine große Herausforderung. Um beispielsweise die optimale Freisetzung des Arzneimittels im Körper innerhalb eines bestimmten Zeitrahmens zu erreichen, sind zahlreiche umfangreiche Experimente mit unterschiedlichen Kandidatenformulierungen erforderlich. Dieser Prozess ist umständlich und zeitaufwendig und wird zu einem Engpass für die weitere Entwicklung von Injektionen mit Langzeitwirkung.
Kürzlich haben Forscher der Universität Toronto ein Modell für maschinelles Lernen entwickelt. Relevante experimentelle Ergebnisse zeigen, dass das Modell die Freisetzungsrate lang wirkender injizierbarer Medikamente genau vorhersagen kann, wodurch die Entwicklung lang wirkender injizierbarer Medikamente effektiv beschleunigt wird.Die Forschungsergebnisse wurden in der Zeitschrift Nature Communications veröffentlicht.Der Titel lautet „Maschinelles Lernmodell zur Beschleunigung der Entwicklung polymerer Injektionsmittel mit Langzeitwirkung“.

Die Ergebnisse wurden in Nature Communications veröffentlicht.
Papieradresse:
https://www.nature.com/articles/s41467-022-35343-w#Abs1
Experimentübersicht
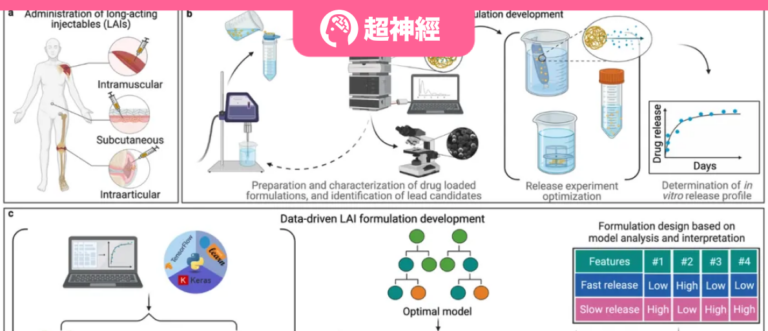
Es gibt verschiedene Arten von injizierbaren Präparaten mit Langzeitwirkung, im Allgemeinen handelt es sich dabei um Lipide und synthetische Polymere.Die folgende Abbildung zeigt einen Vergleich zwischen traditionellen und datengesteuerten Ansätzen zur Entwicklung langwirksamer injizierbarer Formulierungen.

Abbildung 1: Schematische Darstellung traditioneller und datenbasierter F&E-Ansätze für langwirksame injizierbare Formulierungen
a Abbildung: Verabreichungswege der von der US-amerikanischen Food and Drug Administration zugelassenen langwirksamen injizierbaren Formulierungen.
Abbildung b: Typischer Versuch-und-Irrtum-Zyklus bei der Entwicklung herkömmlicher langwirksamer injizierbarer Formulierungen.
Abbildung c: Übersicht über den Arbeitsablauf dieser Studie, die trainierte Modelle des maschinellen Lernens verwendet, um den Entwicklungsprozess langwirksamer injizierbarer Formulierungen zu beschleunigen.
Dieser experimentelle Datensatz basiert auf zuvor veröffentlichten Forschungsergebnissen.Außerdem werden Daten aus externen Quellen hinzugefügt, die mit der Web of Science-Suchmaschine durchsucht wurden. Konkret umfasst der Datensatz die Freisetzungsmengen (die Anzahl der in einer bestimmten Zeit freigesetzten Arzneimittelmoleküle) von 181 Arzneimitteln und 43 Arzneimittel-Polymer-Kombinationen. Gleichzeitig teilten die Forscher den erstellten Datensatz in zwei Teilmengen auf:Sie werden jeweils zum Trainieren und Testen von Modellen verwendet.
Datensatz zu langwirksamen Injektionspräparaten
Verlag:Universität von Toronto
Enthaltene Menge:Freigabe von 181 Medikamenten und 43 Medikamenten-Polymer-Kombinationen
Geschätzte Größe:394,1 KB
Veröffentlichungszeit:2022
Downloadadresse:hyper.ai/datasets/23625
Experimentelle Verfahren
In dieser Studie trainierten die Forscher insgesamt 11 Algorithmen des maschinellen Lernens.Einschließlich multipler linearer Regression (MLR), kleinster absoluter Schrumpfungs- und Auswahloperator (Lasso), partieller kleinster Quadrate-Regression (PLS), Entscheidungsbaum (DT), Random Forest (RF), Light Gradient Boosting Machine (LGBM), extremem Gradient Boosting (XGB), natürlichem Gradient Boosting (NGB), Support Vector Regression (SVR), k-Nearest-Neighbor-Algorithmus (k-NN) und neuronalem Netzwerk (NN).
Modellauswahl
Um die Vorhersageleistung dieser Modelle des maschinellen Lernens zu bewerten, verwendeten die Forscher einen verschachtelten Kreuzvalidierungsansatz, der aus einer inneren (Training und Validierung) und einer äußeren (Test-)Schleife bestand. Der konkrete Ablauf besteht darin, dass die Forscher den Datensatz zunächst nach der Arzneimittel-Polymer-Kombination gruppierten.Anschließend wurden an jedem maschinellen Lernmodell 10 verschachtelte Kreuzvalidierungsexperimente durchgeführt.
Abschließend wird die Vorhersageleistung jedes maschinellen Lernmodells in den inneren und äußeren verschachtelten Kreuzvalidierungsschleifen in Tabelle 1 und Abbildung 2 unten zusammengefasst. Tabelle 1 zeigt die Werte des mittleren absoluten Fehlers (MAE) und des mittleren Standardfehlers (σM, in Klammern angegeben), die nach der Vorhersage der Arzneimittelfreisetzung mithilfe verschiedener Algorithmen des maschinellen Lernens in verschachtelter Kreuzvalidierung (n = 10) erhalten wurden. Wie aus der Tabelle ersichtlich ist,Baumbasierte Maschinenmodelle sind im Allgemeinen genauer als lineare, instanzbasierte und Deep-Learning-Modelle (MAE < 0,16).

Tabelle 1: Vorhersageleistung jedes Machine-Learning-Modells bei verschachtelter Kreuzvalidierung
Abbildung 2 zeigt die absoluten Fehlerwerte (AE) der Arzneimittelfreisetzungsvorhersagen, die bei der verschachtelten Kreuzvalidierung erhalten wurden (n = 10). Kombiniert man die Informationen in Tabelle 1 und Abbildung 1, weist das auf LGBM basierende Modell von den 11 Modellen den kleinsten MAE- und AE-Wert sowohl in der inneren als auch in der äußeren Schleife auf. daher,Die Forscher sind davon überzeugt, dass das auf LGBM basierende Modell die beste Vorhersageleistung aufweist.

Abbildung 2: Gesamtvorhersageleistung jedes Algorithmusmodells
Die schwarzen Kreise und gestrichelten schwarzen Linien in den Kästchen in der Abbildung stellen den MAE-Wert bzw. den AE-Wert jedes Modells dar.
Modelloptimierung
Um die Generalisierungsfähigkeit von Machine-Learning-Modellen weiter zu verbessern,Die Forscher optimierten und verbesserten außerdem das LGBM-Modell mit 17 Merkmalen durch Clusteranalyse.
Hier verwendeten sie den Farthest-Neighbor-Clustering-Algorithmus, wie in der Abbildung unten dargestellt, um die Eingabefunktionen in einer Hierarchie anzuordnen. Die Forscher stellten bei 17 Merkmalen Redundanz fest. Nach Verbesserungen,FinaleEs wurde festgestellt, dass das LGBM-Modell mit 15 Merkmalen die beste Leistung zeigte.

Abbildung 3: Spearman-Korrelationskoeffizienten-Heatmap der ersten 17 Eingabefunktionen
Dunkelblau steht für einen absoluten Spearman-Korrelationskoeffizienten (eine Methode zur Untersuchung der Korrelation zwischen zwei Variablen auf Grundlage von Rangdaten) von 1, und Rosa steht für einen absoluten Spearman-Korrelationskoeffizienten von 0. Die Heatmap wird von einem Dendrogramm begleitet, das die Hierarchie der Merkmalscluster zeigt, die durch eine agglomerative hierarchische Clusteranalyse ermittelt wurden.
Experimentelle Ergebnisse
Nachdem die Forscher das oben genannte optimale Modell erhalten hatten, führten sie zwei Tests durch. Eine bestand darin, das Modell zu verwenden, um die Arzneimittelfreisetzungskurve eines bestimmten langwirksamen Injektionsmedikaments vorherzusagen, und die andere bestand darin, das Modell zu verwenden, um die Arzneimittelfreisetzungskurve des Arzneimittelpolymers im Testsatz vorherzusagen. Die Ergebnisse wurden mit den experimentellen Arzneimittelfreisetzungskurven verglichen und sind in der folgenden Abbildung dargestellt.
Abbildung 4 zeigt den Vergleich der vorhergesagten und experimentellen Arzneimittelfreisetzungsprofile für eine ausgewählte Langzeitinjektion, und Abbildung 5 zeigt den Vergleich der Arzneimittelfreisetzungsprofile für Arzneimittelpolymere und der experimentellen Arzneimittelfreisetzungsprofile. Man sieht, dass in beiden FällenDie vorhergesagten Werte und die experimentellen Werte stimmen grundsätzlich überein.Daher glauben die Forscher, dass das auf dem LGBM-Algorithmus basierende Modell die Arzneimittelfreisetzungsrate bei Injektionen mit Langzeitwirkung genau vorhersagen kann.

Abbildung 4: Vergleich der vorhergesagten und experimentellen Arzneimittelfreisetzungskurven für langwirksame Injektionen im Datensatz

Abbildung 5: Vergleich der vorhergesagten Wirkstoff-Polymer-Freisetzungsprofile mit den entsprechenden experimentellen Profilen
Acceleration Alliance: Unterstützung bei der Umsetzung neuer wissenschaftlicher Forschungsparadigmen
Es ist erwähnenswert, dassDie Autoren dieser Forschung, Christine Allen und Alán Aspuru-Guzik, gehören beide dem Acceleration Consortium (AC) an.Die Accelerator Alliance wurde 2021 ins Leben gerufen und ist eine neue globale Zusammenarbeit zwischen Wissenschaft, Industrie und Regierung mit Hauptsitz an der Universität Toronto in Kanada. Ihre Vision besteht darin, mithilfe von KI und Robotik die Entdeckung und Entwicklung neuer Materialien und Moleküle zu beschleunigen.
„Unser Ziel ist es, die Wissenschaft zu beschleunigen“,„Um dieses Ziel zu erreichen, haben wir erkannt, dass wir die Idee hinter dem autonomen Fahren auf automatisierte Labore ausweiten können, indem wir KI und Automatisierung nutzen, um auf intelligentere Weise zu experimentieren“, sagte Alán Aspuru-Guzik, Direktor der Accelerator Alliance.

Abbildung 6: Accelerator Alliance, ein Wissenschaftler entnimmt vordosierte Reagenzien aus einem automatisierten Feststoffdosierroboter
Es ist erwähnenswert, dass die Accelerator Alliance erst letzten Monat einen Zuschuss von 200 Millionen US-Dollar vom Canada First Research Excellence Fund (CFREF) erhalten hat, der zur Unterstützung der Arbeit der Allianz im Bereich der „selbstfahrenden Labore“ verwendet werden soll. Meric Gertler, Präsident der Universität von Toronto, sagte:„Diese erheblichen Investitionen in KI-gestützte Forschung und Innovation haben das Potenzial, das Leben der Menschen in Kanada und auf der ganzen Welt zu verbessern.“.
Die Codeadresse dieser Studie:
https://github.com/aspuru-guzik-group/long-acting-injectables








