Command Palette
Search for a command to run...
抗击化疗耐药性与肿瘤复发!山东大学研究团队用 AI 构筑乳腺癌干细胞的有力防线

乳腺癌,可谓是女性恶性肿瘤中的「头号杀手」,一直是医学界攻坚克难的重点。目前,细胞毒性化疗作为乳腺癌患者最普遍的全身治疗手段,虽然在一定程度上缓解了病情,但仍旧会出现癌细胞复发或转移的情况。
过往研究表明,乳腺癌干细胞 (BCSC) 是乳腺癌对化疗和放疗产生抵抗性的根源。 BCSC 虽仅占乳腺癌细胞的一小部分,却拥有惊人的无限增殖潜力和启动肿瘤的能力。更令人震惊的是,化疗过程本身还可能会促使非 BCSC 细胞转化为 BCSC,从而加剧了肿瘤复发和转移的风险。
由此可见,深入理解 BCSC 对化疗的响应机制,对于改善乳腺癌患者的预后十分重要,临床迫切需要一种能够识别并抑制 BCSC 的方法,优化现有治疗方案。
面对这一挑战,山东大学吕海泉、孙蓉、张凯及山西医科大学梅齐,联合螺旋矩阵公司等研究团队,取得了突破性进展,运用机器学习技术,基于 mRNA 的分析,成功开发了一种评估原发性乳腺癌患者样本中癌症干细胞特性的新方法 BCSC signature 。这项研究不仅揭示了多胺合成代谢在 BCSC 调控中的核心作用,更为乳腺癌的临床治疗提供了全新的策略和方向。
该研究以「Polyamine Anabolism Promotes Chemotherapy-Induced Breast Cancer Stem Cell Enrichment」为题,发表于国际著名期刊 Advanced Science 。
研究亮点:
* 研究人员通过机器学习方法开发了一个基于 mRNA 的 BCSC signature,用于评估乳腺癌患者样本中的癌症干细胞特征 (cancer stemness)
* 该研究发现多胺合成代谢在 BCSC 调控中具有关键作用,化疗通过激活 HIF-1 调控的多胺合成代谢途径,促进了 BCSC 的富集
* 该研究发现了一种新的特异性 HIF-1 抑制剂 Britannin,联合使用可有效抑制化疗诱导的 HIF-1 转录活性、多胺代谢水平以及 BCSC 富集

论文地址:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202404853
利用 TCGA 数据集,构建 Pearson 相关分析与机器学习算法的关联
为了通过基因表达水平,量化评价原发性乳腺癌患者样本的干细胞特性,该研究利用癌症基因组图谱联盟 (TCGA) 的乳腺浸润性癌 (BRCA) 数据集,通过皮尔逊相关系数 (Pearson correlation coefficient) 分析将 mRNA 表达,与基于一元逻辑回归 (OCLR) 机器学习算法的 mRNA 干细胞指数 (mRNAsi) 进行关联,从而开发了基于 mRNA 的 BCSC signature 。
同时,该研究还基于 2,032 名乳腺癌患者的数据集生成了 Kaplan-Meier 曲线,这些数据一部分来自于原发肿瘤中 BCSC P-Sig 和 N-Sig 的表达进行分层,另一部分是根据接受化疗的 1,372 名乳腺癌患者的数据集生成。
具体而言,如下图 A 所示,该研究首先确定了 81 个皮尔逊相关系数 r>0.70 和 91 个皮尔逊相关系数 r<-0.70 的基因,并将它们分别定义为 BCSC 阳性 signature (P-Sig) 和阴性 signature (N-Sig) 。
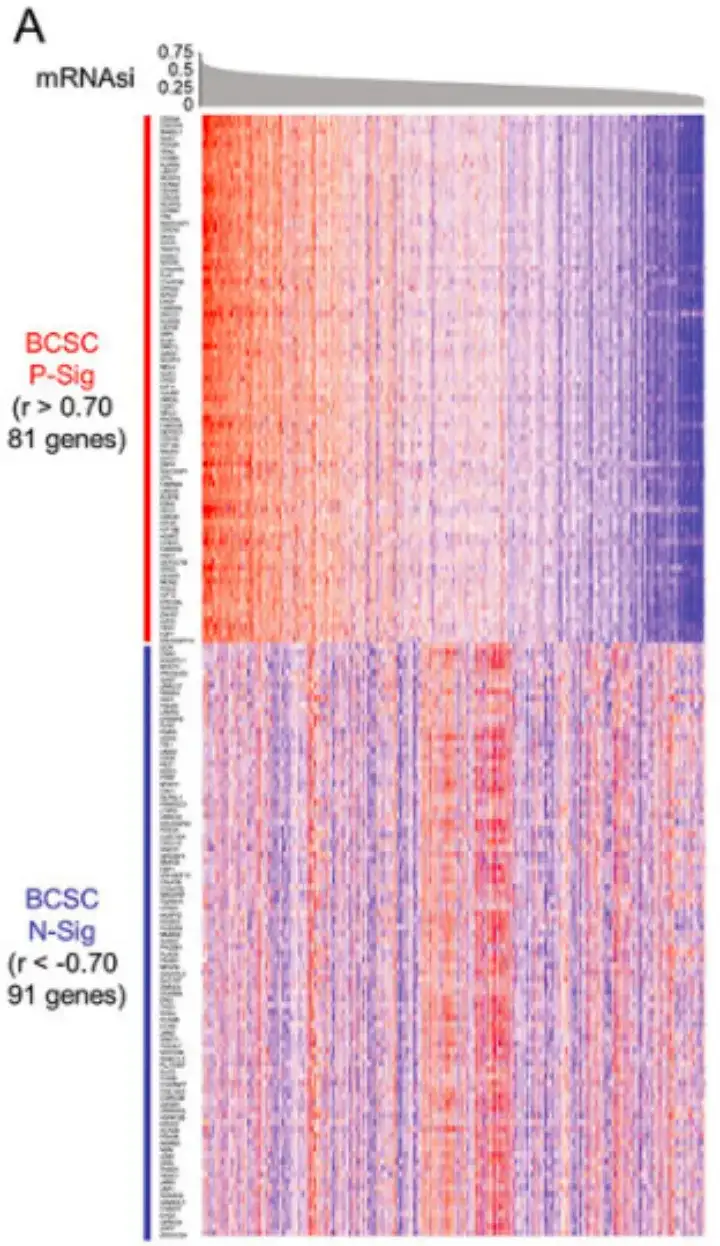
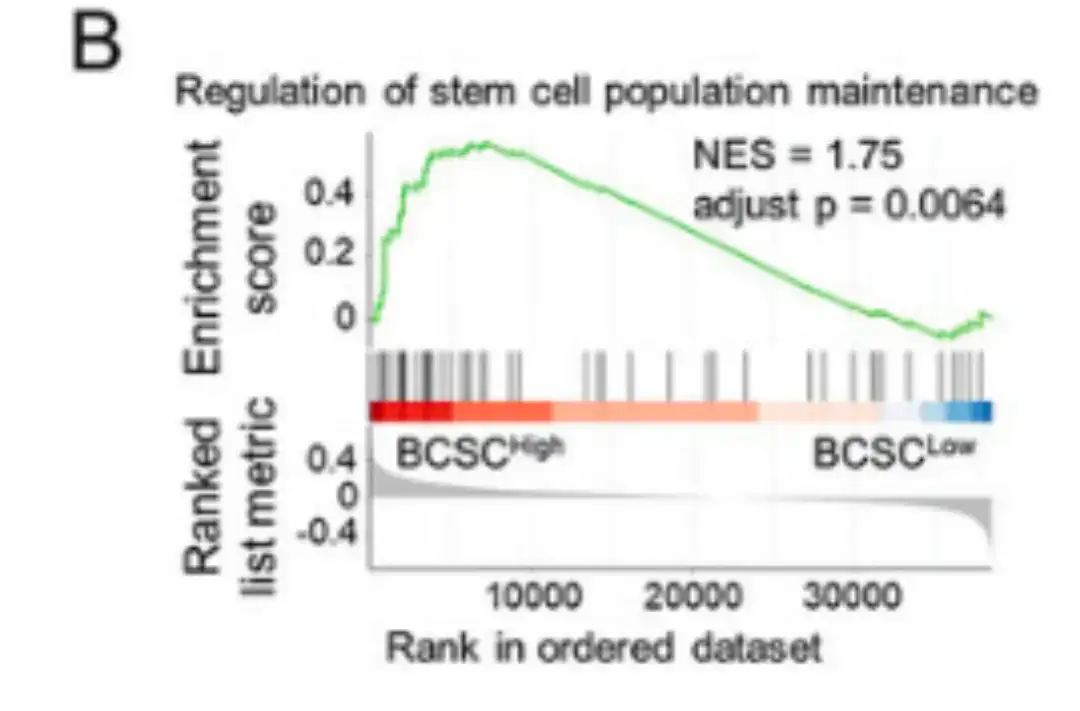
随后,如下图 B 所示,该研究通过比较 BCSChigh 和 BCSClow 数据组,基于 BCSC signature 的表达对组别进行分层,进行了基于排名的基因集富集分析 (GSEA) 。
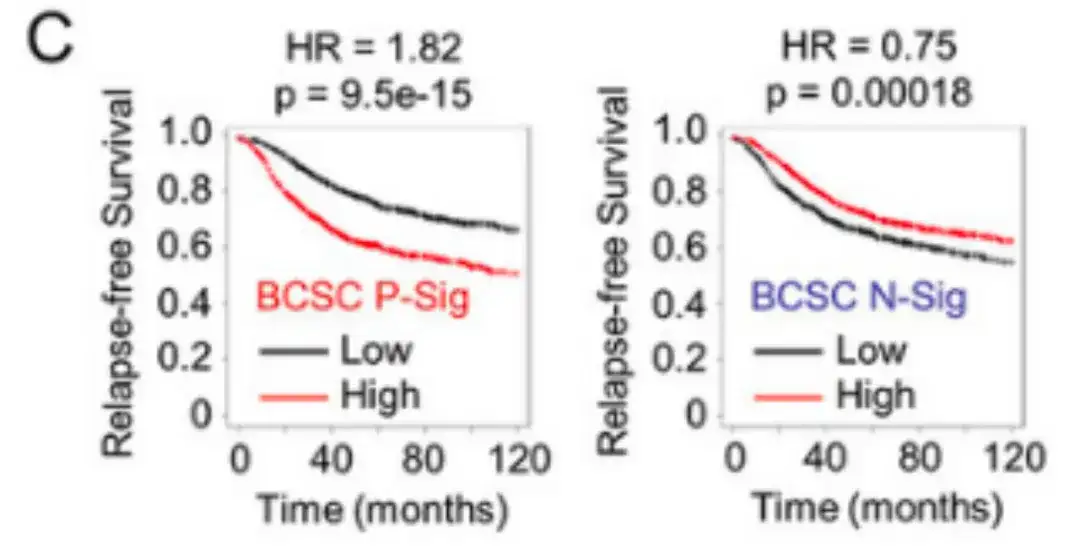
在分析了 2,032 例患者的 BCSC signature 表达与无复发生存期 (RFS) 之间的相关性后,研究人员发现,BCSC P-Sig 表达高于中位数的患者 RFS 会显著降低,而 BCSC N-Sig 表达高于中位数的患者 RFS 会增加,结果如下图 C 所示。
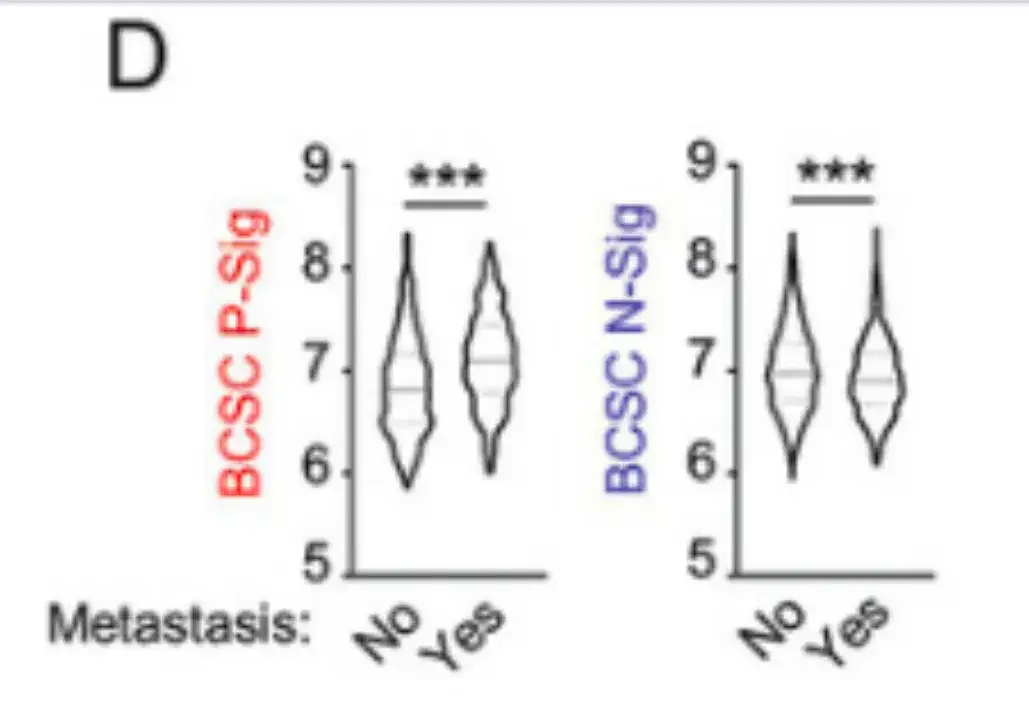
该研究还对国际乳腺癌协会的分子分类数据库 (METABRIC) 中的 1,979 例乳腺癌患者数据进行了分析。结果如下图 D 所示,在 5 年内发生转移的患者与未发生转移的患者相比,其原发肿瘤中的 BCSC P-Sig 表达较高,而 BCSC N-Sig 表达较低。
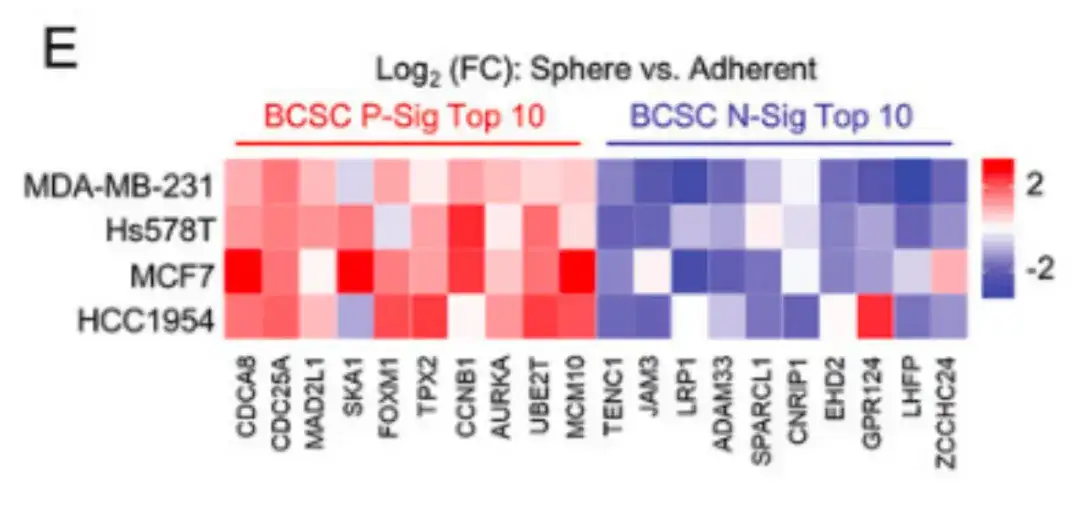
此外,在下图 E 中,该研究还在多种乳腺癌细胞系中验证了 BCSC 特征,与在标准聚苯乙烯组织培养皿中培养的细胞相比,在乳腺球培养基中培养的乳腺癌细胞 BCSC P-Sig 的表达较高,而 BCSC N-Sig 的表达较低。
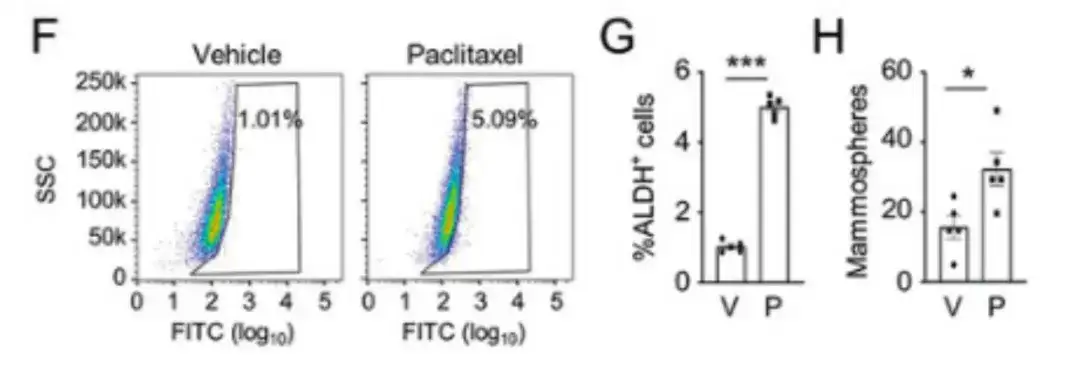
为了评估化疗药物如何影响 BCSC 人群,该研究将人乳腺癌细胞 MDA-MB-231,注射到雌性严重联合免疫缺陷 (SCID) 小鼠的乳腺脂肪垫 (MFP) 中,并用紫杉醇治疗小鼠。如下图 F, G, H 所示,紫杉醇显著增加了乙醛脱氢酶活性 (ALDH+) 细胞的百分比和乳腺球形成细胞的数量。
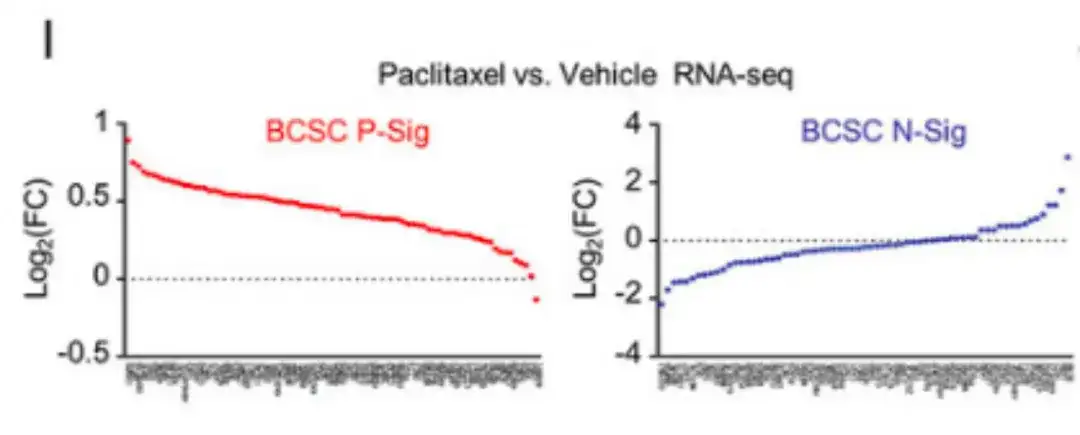
同时,在下图 I 中,RNA-seq 分析显示,紫杉醇治疗增加了大多数 BCSC P-Sig 基因的表达量,并降低了大部分 BCSC N-Sig 基因的表达量。
除紫杉醇外,在下图 J 中,该研究还用 FDA 批准的化疗药物 gemcitabine 和 carboplatin 治疗乳腺癌细胞,这些药物都增加了 BCSC P-Sig 基因的表达量,降低了 BCSC N-Sig 基因的表达量。如下图 K 所示,来自 METABRIC 患者的样本也显示,在新辅助化疗的患者中,原发肿瘤组织中的 BCSC P-Sig 基因的表达量较高,而 BCSC N-Sig 基因的表达量较低。
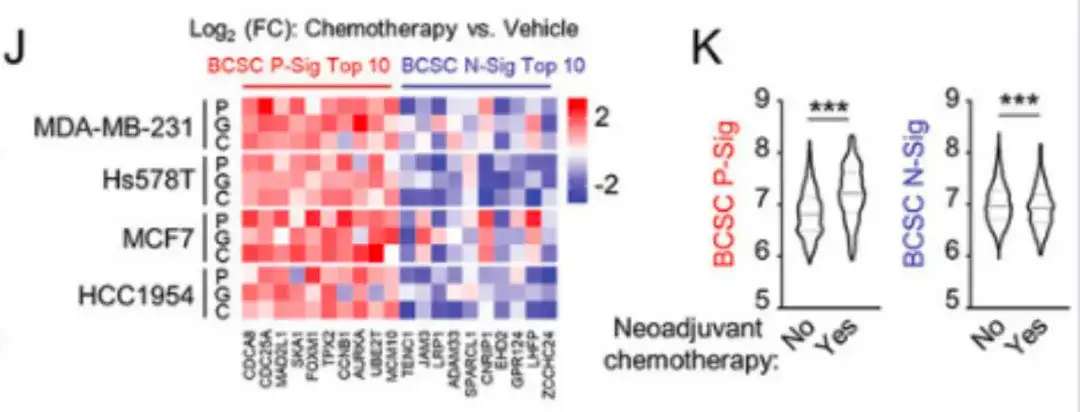
多胺合成代谢与 BCSC 富集正相关,HIF-1 抑制剂 Britannin 可减少多胺生物合成并根除 BCSC
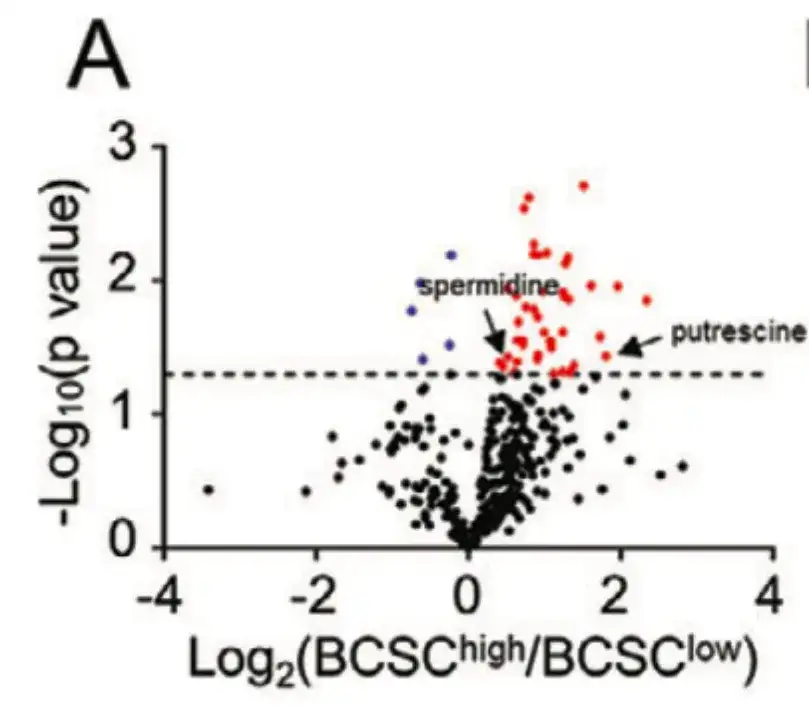
为了从细胞代谢的角度探讨化疗对于 BCSC 富集的诱导机制,该研究根据 BCSC 特征的表达,将 TCGA BRCA 中的 21 例患者分为 BCSChigh 组和 BCSClow 组,并比较两组之间 399 种代谢物的水平,如下图 A 所示。
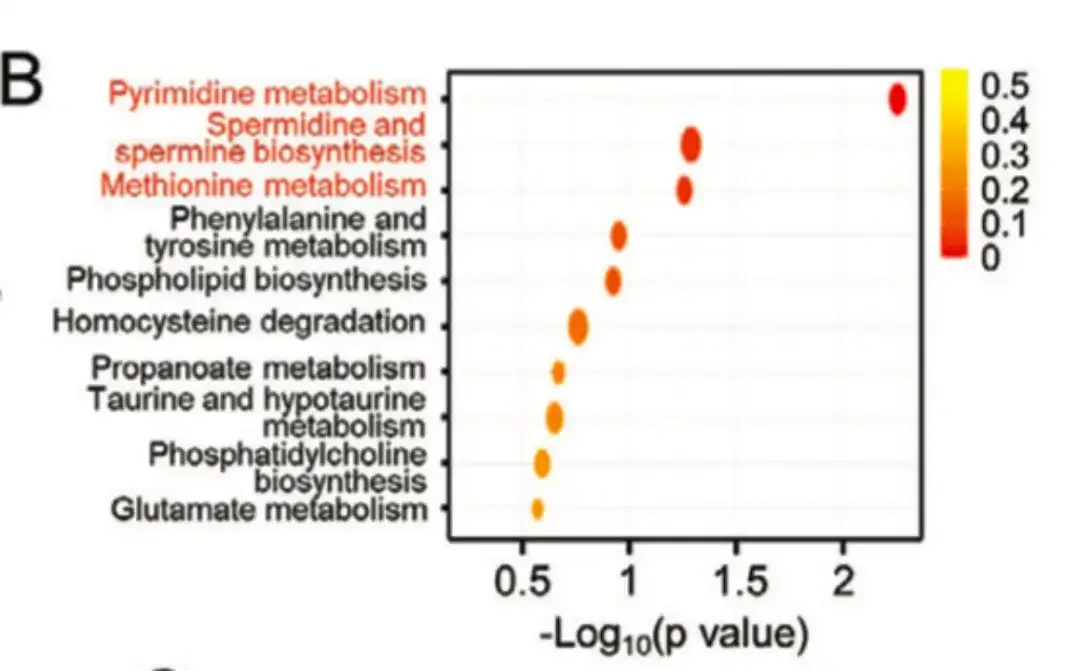
如下图 B 所示,该研究通过代谢通路富集分析表明,在多胺合成代谢相关通路中形成了具有差异水平的代谢物富集。
在下图 C, D 中,该研究发现鸟氨酸脱羧酶 1 (ODC1) 、人亚精胺合酶 (SRM) 和精胺合成酶 (SMS) 等多胺合成代谢途径的关键酶在 BCSChigh 组比 BCSClow 组具有更高的表达,并且在非附着性乳腺癌细胞系上生长的球状培养物中的表达高于单层培养物,这表明多胺生物合成在 BCSC 表型调控中具有重要作用。同时,如下图 E 所示,紫杉醇治疗提高了乳腺癌细胞系中 ODC1 和 SRM 的表达。
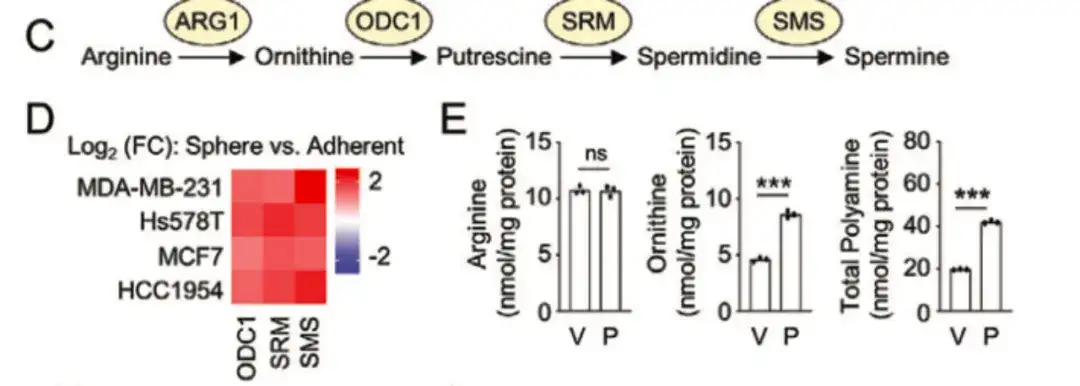
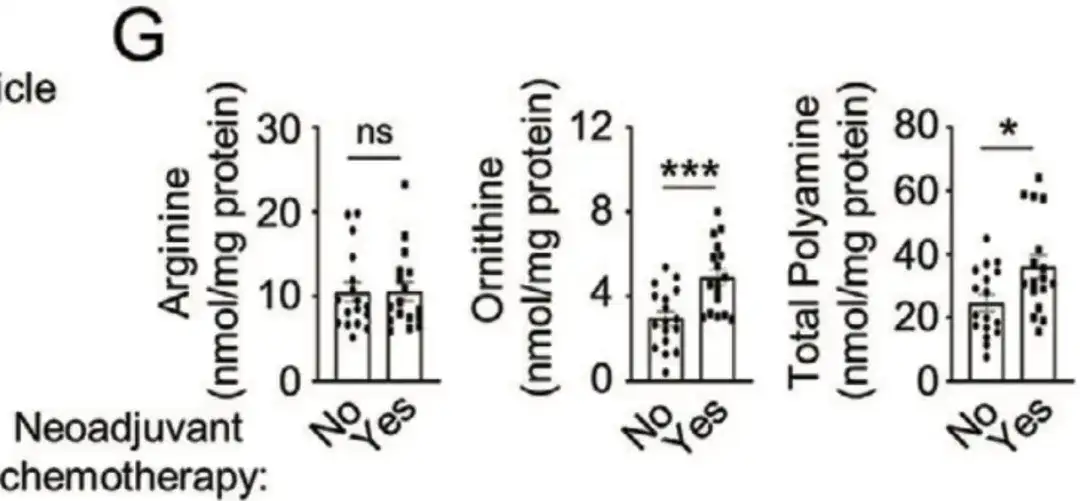
此外,在下图 G 中,该研究还收集到了来自山东大学齐鲁医院的 34 例脱敏乳腺癌患者样本,对其进行分析发现,接受新辅助化疗的患者细胞内鸟氨酸和多胺水平明显升高。这些研究都表明,多胺合成代谢的增强促进了化疗诱导的 BCSC 富集。
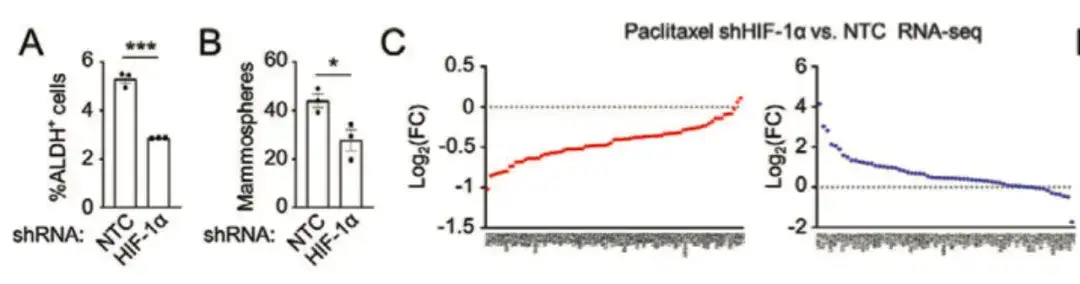
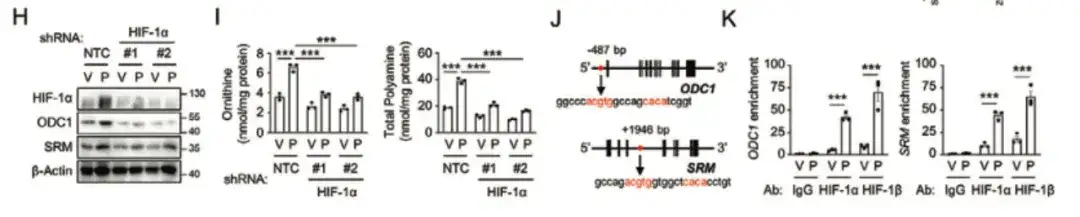
为了进一步分析化疗促进乳腺癌多胺合成代谢的分子机制,该研究发现,缺氧诱导因子 (HIF-1α) 的抑制可减弱紫杉醇介导的 ALDH+ 升高和成球能力,降低了大多数 BCSC P-Sig 基因的表达,同时增加了大多数 BCSC N-Sig 基因的表达,这表明 HIF-1 在调节紫杉醇诱导的 BCSC 富集中起到关键作用,如下图 A-C 所示。
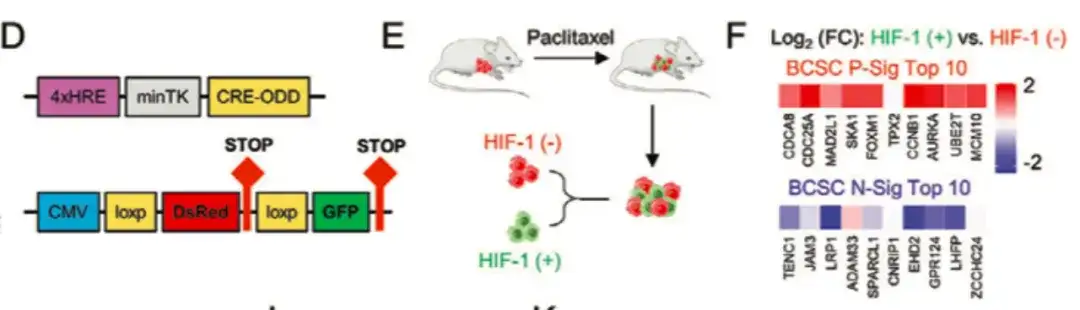
为了进一步研究 HIF-1 在 BCSC 表型调控中的作用,如下图 D-G 所示,该研究还用 HIF-1 表达荧光跟踪系统转殖(transfected)了 MDA-MB-231,通过收集紫杉醇治疗小鼠后的肿瘤组织,将细胞分为 DsRed+/GFP− (HIF-1−) 和 GFP+ (HIF-1+) 细胞群,与 DsRed+/GFP− 细胞群相比,具有高 HIF-1 表达和转录活性的 GFP+ 细胞群中 BCSC P-Sig 基因表达增加,而 BCSC N-Sig 表达减少,同时 GFP+ 细胞的致瘤能力显著高于未处理组或 DsRed+/GFP− 细胞。
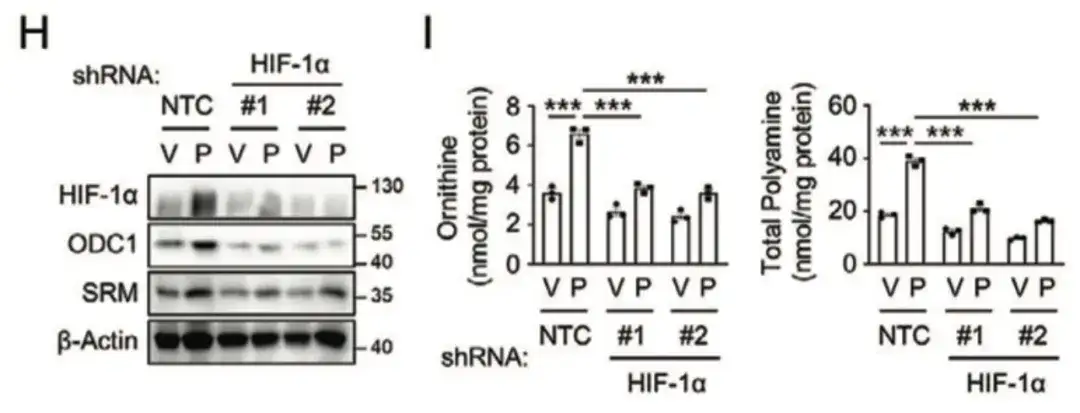
在下图 H, I 中,该研究发现抑制 HIF-1α 可阻断紫杉醇诱导的 ODC1 和 SRM 表达,这表明紫杉醇以 HIF-1 依赖的方式促进了多胺合成代谢。
最后,该研究发现 HIF-1 通过转录激活了 ODC1 和 SRM 基因,促进了多胺的合成代谢,进而导致了化疗诱导的 BCSC 的富集,如下图 L-Q 所示。

如下图 A 所示,该研究用 HIF-1 转录活性报告系统转殖 SUM159 细胞,在包含 4,320 种天然化合物的天然产物文库中筛选新的 HIF-1 抑制剂。研究发现,来自 Inula aucheriana 的 Britannin 以剂量依赖的方式有效地抑制了 HIF-1 的转录活性,Britannin 与 paclitaxel 的联合应用可剂量依赖性地阻断 paclitaxel 引起的细胞内精氨酸和多胺水平的升高,如下图 B-F 所示。
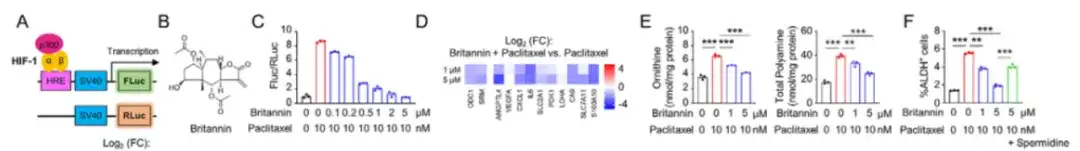
为了研究 Britannin 抑制 HIF-1 转录活性的机制,在下图 H-K 中,该研究将 MDA-MB-231 细胞与 HIF-1 转录活性报告系统共同转殖,结果发现 Britannin 可以剂量依赖的方式减弱紫杉醇诱导的 HIF-1α TAD 活性报告系统,并且 Britannin 可通过阻断转录激活因子 p300 来抑制 HIF-1 的转录活性。
在下图 L-Q 中,该研究通过将 2×106 个 MDA-MB-231 细胞注射到 SCID 小鼠体内,并用紫杉醇单独或联合 Britannin 治疗小鼠。结果表明,联合治疗能够明显抑制原发肿瘤生长,而且不会影响小鼠的外观和体重,并且 10 只小鼠中有 3 只在停止药物治疗 100 天后没有肿瘤复发,这表明紫杉醇和 Britannin 联合治疗小鼠可以完全根除 BCSC 。

AI 助力病理学诊断,靶向 HER2 治疗或成关键
现如今,乳腺癌的诊断不仅仅依赖影像学结果,病理学诊断也扮演着不可替代的角色。 HER2(人表皮生长因子受体 2)的表达状况是乳腺癌治疗中的一个重要考量因素,而 AI 在病理切片的分析中,可以辅助识别 HER2 的表达水平,为后续的靶向治疗提供参考。
尽管道理看似很简单,但想要实现却并不容易。例如,为了利用 AI 技术提高乳腺癌 HER2 判读的准确性和可重复性,需要大量训练,并且不断调试和对比 AI 系统与医疗人员的诊断情况。在此基础上,研究人员又专注于 HER2 阴性与阳性的区分,将 AI 聚焦于 HER2 的低表达下限,从而评估 AI 在不同异质性 HER2 低表达乳腺癌诊断中的价值。
事实上,早在 2022 年,山东大学吕海泉教授就曾在生物医学杂志 Theranostics 上发表封面文章,揭示了靶向 A2BR 联用化疗可能阻断乳腺癌干细胞的富集并提高乳腺癌患者化疗后生存率。
论文链接:
https://www.thno.org/v12p2598.htm

此次 ,吕海泉教授再度揭示 Britannin 的联合应用可抑制 HIF-1 的多胺合成代谢并根除 BCSC,无疑为乳腺癌的治疗提供了全新的思路。未来,AI 将在乳腺癌治疗领域发挥着前所未有的重要作用,并且在医疗健康领域的应用日益显现出巨大潜力。随着技术的不断进步和应用的深入,AI 将成为乳腺癌乃至癌症治疗中不可或缺的伙伴,为患者带来更多力量与希望。