Command Palette
Search for a command to run...
단백질 구조 이질성의 원자 수준 모델링 과제 해결! David Baker 팀의 PLACER 프레임워크 분석

분자 세계에서 단백질과 핵산, 작은 유기 및 무기 분자, 그리고 금속 이온 간의 상호작용은 생명 기능에 매우 중요합니다. 이러한 상호작용의 모든 인지와 결합은 생물학적 기능에 영향을 미치고, 약물 효능을 결정하며, 심지어 새로운 효소 설계의 성공 여부에도 영향을 미칠 수 있습니다. 그러나 이러한 상호작용과 그 구조적 이질성을 원자 수준에서 모델링하는 것은 업계에 여전히 매우 어려운 과제로 남아 있습니다.
DiffDock과 같은 딥러닝(DL) 기반 소분자 도킹 도구는 이전 방법에 비해 정확도가 향상되었습니다.하지만 고정밀 작업에서는 성능 차이가 크지 않습니다.더욱이, 보이지 않는 수용체를 만나면 성능이 크게 저하됩니다. 또한, 화학 구조로부터 소분자 형태를 생성하기 위해 다양한 딥 러닝 기반 방법이 개발되었습니다.그러나 이러한 방법은 일반적으로 상호작용하는 객체의 특정 범주만 모델링하므로 단백질 기능의 전체 스펙트럼을 특성화하는 능력이 제한됩니다.
이를 바탕으로 워싱턴 대학의 노벨상 수상자인 데이비드 베이커 교수가 이끄는 연구팀은 PLACER(Protein-Ligand Atomistic Conformational Ensemble Resolver)라는 그래프 신경망을 개발했습니다.이 기술은 소분자의 원자 구성 및 결합 정보를 기반으로 다양한 유기 소분자의 구조를 정확하게 생성할 수 있으며, 단백질의 거시적 구조 환경을 고려하여 단백질-소분자 도킹 작업을 위한 소분자 및 단백질 측쇄의 세부적인 구조를 구성할 수 있습니다.효소 설계 연구에서, 본 연구팀은 PLACER를 사용하여 설계된 활성 부위의 정확도와 사전 조직화 정도를 평가함으로써 설계 성공률과 효소 활성을 크게 향상시킬 수 있음을 발견했습니다. 예를 들어, 연구진은 kcat/KM = 11,000 M⁻¹·min⁻¹인 사전 조직화된 항알돌라제를 얻었습니다.이는 딥 러닝이 등장하기 전의 모든 설계 결과를 훨씬 능가합니다.
"PLACER를 이용한 단백질-소분자 구조 앙상블 모델링"이라는 제목의 관련 연구 결과는 미국 국립과학원 회보(PNAS)에 게재되었습니다.
연구 하이라이트:
* PLACER는 고속이고 무작위적이어서 형태적 이질성 분포를 묘사하기 위해 많은 수의 예측 샘플을 빠르게 생성할 수 있습니다.
* 모든 상호작용에 대해 통합된 원자 수준 표현을 사용함으로써 PLACER는 거대고리 분자 및 기타 복잡한 소형 분자와 같은 생체 분자를 넘어 쉽게 확장될 수 있습니다.
* PLACER는 계산 효소 설계와 소분자 접합체 설계에 매우 유용합니다. 설계된 활성 부위의 재구성과 주요 촉매/상호작용 측쇄 작용기의 사전 구성의 정확성을 빠르게 평가할 수 있습니다.

서류 주소:
https://www.biorxiv.org/content/10.1101/2024.09.25.614868v2
공식 WeChat 계정을 팔로우하고 백그라운드에서 "효소 디자인"을 댓글로 입력하면 전체 PDF를 받으실 수 있습니다.
데이터 세트: 다단계 및 다양한 데이터 구성을 통해 우수한 일반화 능력이 검증됨
소분자 형태 예측을 위해 연구팀은 케임브리지 구조 데이터베이스(CSD)에서 226,000개 이상의 유기 비고분자 소분자 결정 구조를 훈련 세트로, 7,116개의 샘플을 검증 세트로 선택했습니다. 각 분자는 완전한 원자 구성 및 화학 결합 정보를 제공하며, 원자 좌표는 무작위로 초기화되어 모델이 노이즈가 많은 조건에서도 정확한 구조를 복원하는 능력을 학습할 수 있도록 합니다.이러한 훈련 전략은 모델이 서로 다른 구조의 작은 분자의 미묘한 변화를 포착할 수 있을 뿐만 아니라, 여러 번의 실행을 통해 다양한 분자 구조 세트를 생성할 수 있도록 합니다.
단백질-소분자 시스템과 관련하여, 연구팀은 단백질 데이터 뱅크(PDB)에서 단백질-소분자 복합체를 포함한 고해상도(<2.5 Å) 구조를 선정하여 총 약 113,000개의 훈련 샘플과 7,090개의 검증 샘플을 확보했습니다. 특히,연구팀은 물 분자만 제외했지만 잠재적으로 비생물학적일 수 있는 작은 분자(용매 등)에 대한 정보는 그대로 유지했습니다. 이는 분자 계면의 물리화학적 선호도에 대한 귀중한 단서를 제공하기 때문입니다.훈련 데이터는 최대 600개의 무거운 원자를 포함하도록 잘리고, 실제로 단백질과 작은 분자의 복잡한 동적 환경을 시뮬레이션하기 위해 무작위로 선택된 원자 중심 주변에서 가우시안 노이즈로 교란됩니다.
이러한 다층적이고 다양한 데이터 구성을 통해 PLACER는 단일 소분자부터 복잡한 단백질-소분자 시스템까지 모든 것을 처리할 때 탁월한 일반화 능력을 보여줍니다.
신경망 PLACER는 원자 수준의 측쇄와 소분자 구조에 초점을 맞춘 3트랙 아키텍처를 채택합니다.
PLACER는 부분적으로 교란된 단백질 구조와 상호작용하는 분자의 화학 구조 정보(좌표 제외)를 입력으로 포함하는 잡음 제거 신경망입니다. 출력은 아래 그림 A와 같이 복합체의 전체 원자 구조와 예측 모델에서 각 원자 위치의 불확실성입니다.
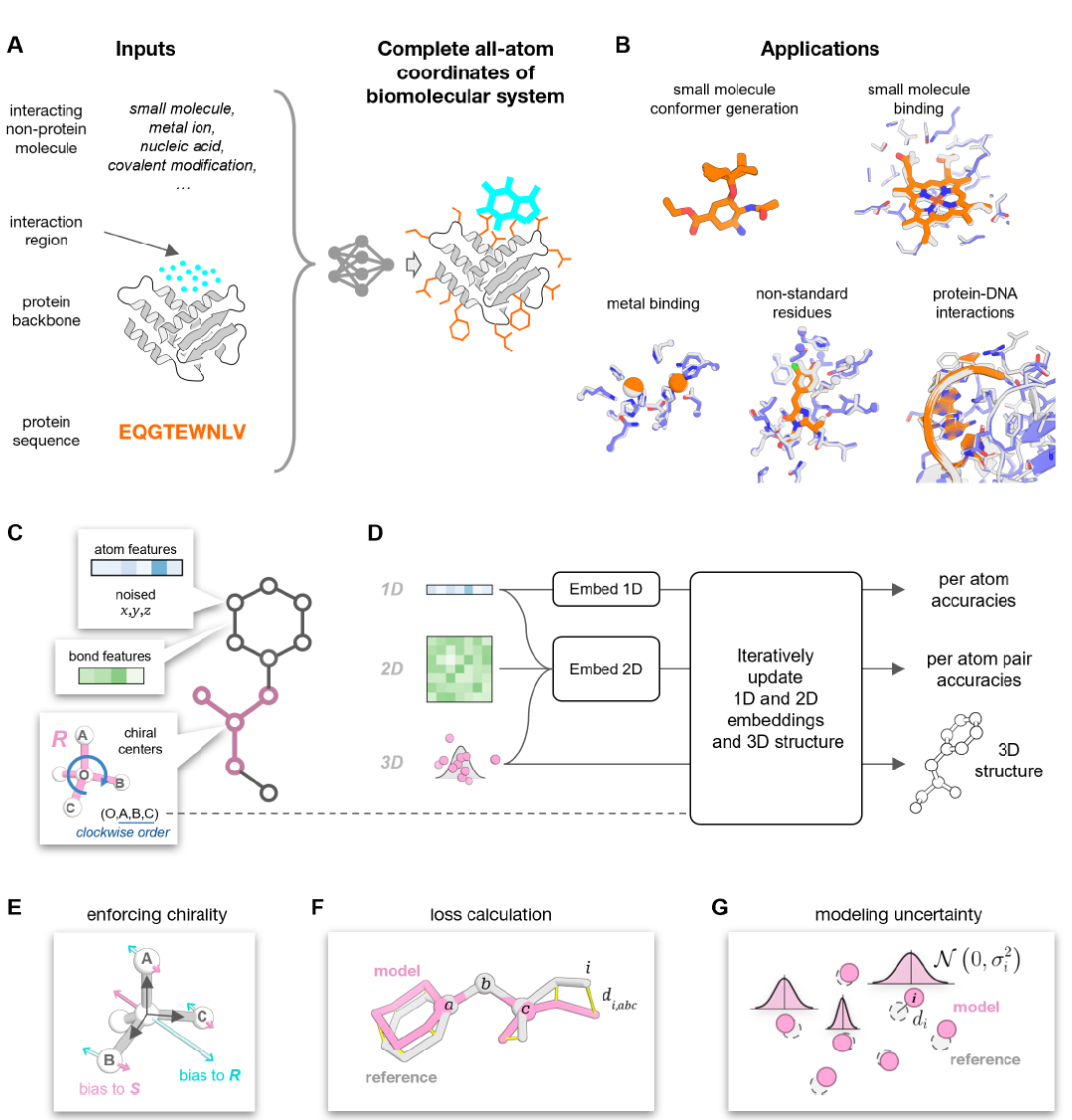
입력 단계에서 분자 시스템은 화학 그래프로 변환됩니다. 여기서 노드는 개별 중원자를 나타내고(수소 원자는 계산 비용을 줄이기 위해 모델링하지 않음), 에지는 원자 간의 화학 결합을 나타냅니다(위 그림 C 참조). 이러한 표현은 다양한 유형의 분자에서 일관되게 나타납니다. 네트워크의 각 노드는 원자 유형 정보와 초기 교란된 3D 좌표를 포함합니다. 네트워크의 작업은 입력 좌표의 잡음을 반복적으로 제거하는 동시에 출력 모델 구조 내 원자 위치의 불확실성을 추정하는 것입니다(위 그림 D 참조).
PLACER는 RoseTTAFold(RF)에서 영감을 받은 3트랙 아키텍처를 채택했으며, 전체 네트워크 아키텍처는 다음과 같습니다.
* 3개 오비탈 설계(1D, 2D, 3D): 1D 오비탈은 원자의 특징 정보를 처리하고, 2D 오비탈은 원자 간 쌍 관계(화학 결합 및 공간적 근접성 등)를 처리하며, 3D 오비탈은 원자 좌표를 업데이트하는 역할을 합니다.
* 반복 최적화: 1D 및 2D 특징의 초기 임베딩이 완료된 후, 이러한 특징들은 반복 블록으로 전달되어 임베딩 벡터와 3D 구조를 반복적으로 업데이트합니다. 반복 블록에서 먼저 원자 이웃 그래프가 생성됩니다. 각 원자에 대해 공간적 근접성의 절반과 화학 그래프 근접성의 절반을 선택하여 총 32개의 최근접 이웃 원자를 생성합니다. 그런 다음, 2D 특징 쌍은 피드포워드 어댑터 계층을 통해 에지 임베딩으로 투영되고, 1D 특징, 원자 이웃 그래프, 그리고 현재 3D 원자 구조와 함께 SE3-Transformer 네트워크의 입력으로 사용되어 3D 좌표와 1D 임베딩 벡터를 업데이트합니다.
* 키랄 중심 처리: 키랄 중심 정보는 유형 1(벡터) 특징을 통해 네트워크로 전달됩니다(위 그림 E 참조). 2D 오비탈의 특징은 쌍 대 쌍(pair-to-pair) 업데이트를 거치고 구조적 편향과 결합됩니다. 원자와 그 쌍에 대한 신뢰도 예측 헤드는 각각 1D 및 2D 오비탈에서 분기되어 반복 블록의 계산을 완료합니다. 완전히 훈련된 네트워크는 공유 가중치를 갖는 8개의 반복 블록으로 구성됩니다.
* 손실 함수 설계: PLACER 학습은 구조적 손실과 신뢰도 예측 손실을 조합하여 사용하며, 각 반복 후에 적용됩니다. 주요 구조적 손실은 전체 원자 FAPE(프레임 정렬 지점 오류)이며, 모델 구조의 신뢰도는 원자 및 원자 쌍 수준 모두에서 평가됩니다.
이 신중하게 설계된 네트워크 아키텍처를 통해PLACER는 무작위로 초기화된 좌표에서 시작하여 다양하고 원자적으로 정확한 단백질-소분자 구조 집합을 생성할 수 있습니다.이는 후속 분석 및 설계를 위한 신뢰할 수 있는 기반을 제공합니다. AlphaFold와 같은 단백질 구조 예측 방법과는 달리,PLACER는 단백질의 주쇄 구조를 예측하지 않고 원자 수준의 측쇄와 소분자 구조에 초점을 맞춰 계산 속도를 크게 향상시키고 다양한 구조 집합을 생성할 수 있게 해줍니다.
결과 쇼케이스: 소분자부터 복잡한 단백질 시스템까지 정밀 엔지니어링 지원 제공
소분자 형태 예측
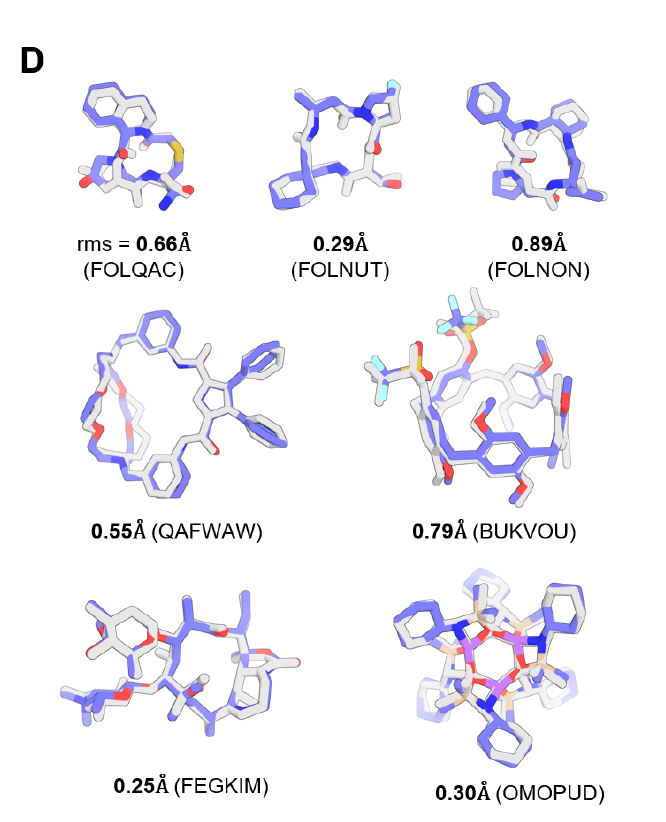
CSD 소분자 데이터세트에 대한 테스트 결과, 완전히 훈련된 PLACER가 복잡한 분자의 3차원 구조를 1Å 미만의 정확도로 정확하게 생성할 수 있음이 입증되었습니다.50개 이상의 원자를 갖는 거대고리(아래 그림 D 참조)와 펩타이드 거대고리(아래 그림 D의 윗줄 참조)가 그 예입니다. 절제 실험 결과, 결합 거리 정보가 누락되거나 반복 횟수가 줄어들면 예측 정확도가 크게 떨어지는 것으로 나타났으며, 이는 PLACER를 위해 설계된 반복 및 특징 전략의 중요성을 보여줍니다.
단백질-소분자 상호작용
연구자들은 PLACER를 사용하여 표적 단백질의 포켓에서 일련의 소분자 형태를 생성했습니다(아래 그림 A). 이를 위해 네트워크를 여러 번 실행했으며, 매번 입력 좌표의 무작위 초기화를 다르게 했습니다.생성된 형태 집합을 분석한 결과, PLACER는 리간드의 초기 위치에 민감하지 않은 것으로 나타났습니다. 즉, 여러 개의 서로 다른 시작 위치가 자연스러운 형태에 가까운 예측을 생성할 수 있으며(아래 그림 B), 이러한 위치는 입력 샘플링의 전체 공간을 포괄합니다(아래 그림 D).연구진은 또한 리간드 원자를 기반으로 계산된 예측 RMSD 점수(pRMSD)를 사용하여 샘플링 풀에서 더 정확한 모델을 선택할 수 있다는 것을 관찰했습니다(아래 그림 E). 가장 높은 점수를 받은 모델은 실험 구조와 높은 수준의 일치를 보였습니다(아래 그림 C).
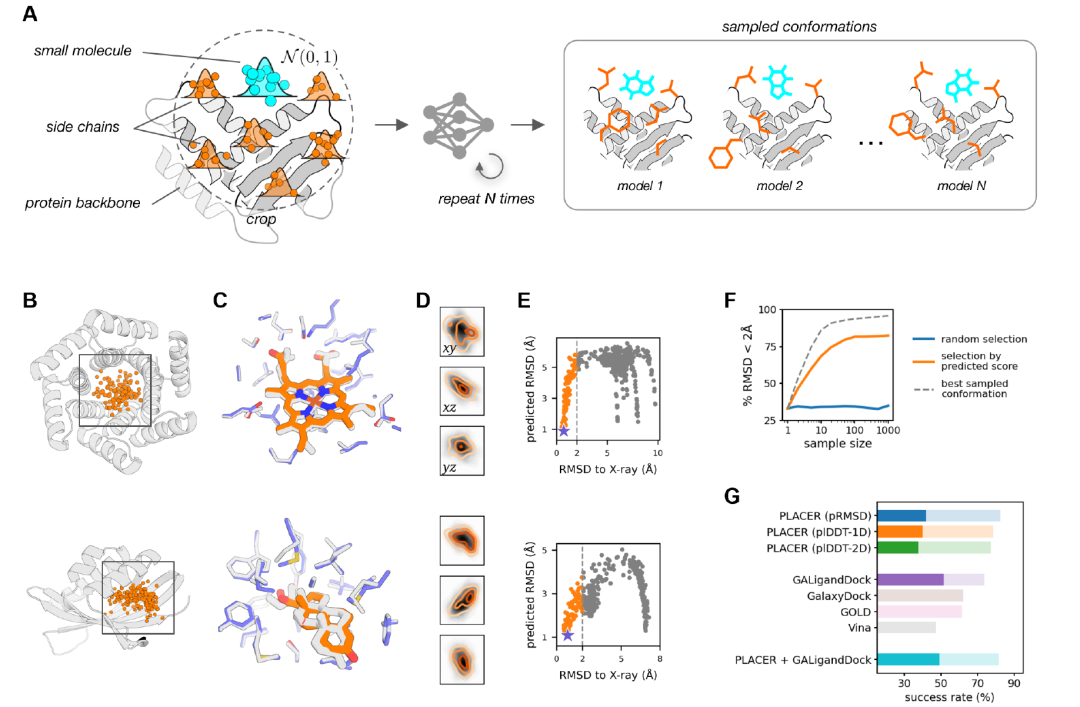
위 그림 G에서 볼 수 있듯이, 65개 약물 표적의 비자연적 형태 시험에서 PLACER는 거의 자연적 형태를 생성하고 선택하는 데 탁월한 성능을 보였으며, pRMSD 점수를 이용한 성공률은 Vina, GOLD, GalaxyDock과 같은 기존 도킹 도구보다 뛰어났습니다. 가장 성능이 좋았던 Rosetta GALigandDock 방법과 비교했을 때, PLACER는 저정밀도 범위(리간드 RMSD < 2 Å인 복합체의 비율)에서 더 우수한 성능을 보였으나(82.4% 대 73.6%), 고정밀도 범위(RMSD < 1 Å)에서는 약간 낮은 성능을 보였습니다(41.8% 대 51.6%).
그러나 PLACER의 성능은 여전히 주목할 만합니다. 다른 방법들과 달리 비자연적 단백질-소분자 도킹 작업을 위해 특별히 훈련되지 않았기 때문입니다. PLACER는 소분자와 단백질 측쇄의 형태를 처음부터 재구성할 수 있는 반면, 다른 테스트 방법들은 주로 입력 단백질의 좌표에 의존합니다.
효소 활성 부위 디자인
PLACER의 레트로 알돌라제 설계 응용은 특히 주목할 만합니다. 연구팀은 RA95 계열의 레트로 알돌라제와 그 진화된 개량형에 대해 50회의 반복 시뮬레이션을 수행하여 활성 부위인 라이신과 그 공유 결합 중간체의 구조적 다양성을 분석했습니다. 그 결과, 초기 계산 설계에서 활성이 낮은 효소의 경우 PLACER가 매우 다양한 구조적 세트를 생성하여 사전 조직화가 부족함을 시사했습니다. 반면, 활성이 더 높은 진화형 효소의 경우 구조적 세트가 점점 더 질서 있게 나타났습니다. 이는...사전 조직이 부족하다는 것은 초기 효소 설계의 주요 단점인 반면, PLACER는 효소 설계 작업을 안내하는 데 사용할 수 있는 신속한 평가 도구를 제공합니다.
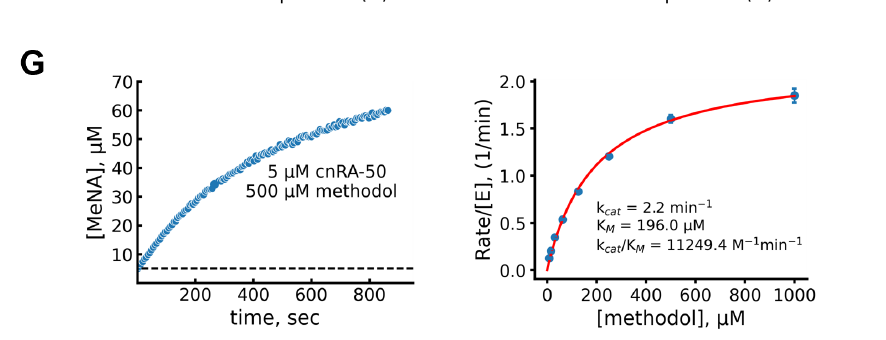
또한, 연구팀은 NTF2 유사 폴딩을 기반으로 새로운 유형의 알도스테론 역전 효소를 설계하고 PLACER를 사용하여 사전 조직화 정도와 kcat/KM 값 간의 상관관계를 평가했습니다. 그 결과, PLACER는 고도로 사전 조직화된 설계가 일반적으로 더 높은 촉매 효율을 갖는 것으로 예측했으며, 가장 활성이 높은 설계인 cnRA-50은 11,000 M⁻¹min⁻¹의 kcat/KM을 달성했습니다. 이는 기존 계산 설계보다 상당히 높은 수치이며, 최신 RFdiffusion 및 proteinMPNN 방법을 사용하여 생성된 설계의 활성에 근접하는 수준입니다.
연구팀은 다음과 같이 예측합니다.PLACER 기반 구조 집합 생성 방법은 분리된 상태나 단백질 환경에서 복잡한 비단백질 분자의 구조 모델링, 효소 설계 및 단백질-소분자 접합체 설계 평가에 널리 사용될 것입니다.
데이비드 베이커 교수: 계산 단백질 설계에 오랫동안 집중해 온 선구자
2024년 10월 9일, 저명한 단백질 설계 선구자인 데이비드 베이커 교수와 AlphaFold2 개발자인 데미스 하사비스, DeepMind의 존 M. 점퍼가 2024년 노벨 화학상을 수상했습니다.
데이비드 베이커 교수는 오랫동안 계산 단백질 설계에 집중해 왔으며, RoseTTAFold, RFdiffusion, ProteinMPNN과 같은 딥러닝 도구를 오픈소스로 제공하여 새로운 단백질 설계를 지원해 왔습니다. 또한 회사를 설립하여 이러한 기술의 산업화를 주도함으로써 이 분야의 진정한 세계적인 거장으로 자리매김했습니다. 그의 팀은 최근 연구에서 여러 새로운 분야에서 상당한 돌파구를 마련했습니다.
예를 들어, 신약 개발 시 연구자들은 종종 단백질을 핵심 약물 표적으로 삼아 구조적으로 안정한 단백질에 약물을 결합시켜 질병 진행을 억제합니다. 그러나 구조, 서열, 그리고 구조적 선호도가 명확하지 않은 자연 발생 무질서 단백질(IDP)을 표적으로 삼는 것은 여전히 어려운 과제입니다. 이러한 배경에서 2025년 8월, 데이비드 베이커 연구팀은 유도 적합 결합 전략에 기반한 로고스(Logos)라는 단백질 설계 전략을 제안했습니다. 이 전략은 39개의 무질서 아미노산 서열에 적응할 수 있는 결합 단백질을 설계하는 것입니다. 이는 더 많은 단백질이 신약 개발의 표적이 될 수 있음을 의미하며, 암과 알츠하이머병 연구를 가속화할 수 있는 잠재력을 가지고 있습니다.
논문 제목:본질적으로 무질서한 영역 결합 단백질의 설계
서류 주소:https://www.science.org/doi/10.1126/science.adr8063
2025년 9월 18일, 데이비드 베이커 연구팀은 모든 원자(all-atom) 간의 생체 분자 상호작용을 새롭게 설계할 수 있는 전 원자 확산 모델인 RFdiffusion3(RFD3)을 제안했습니다. 이 모델은 리간드, 핵산 및 기타 비단백질 클러스터의 맥락에서 단백질 구조를 생성할 수 있으며, 기존 방법보다 더 간단하고 효율적입니다. 일련의 컴퓨터 시뮬레이션 벤치마크에서 RFdiffusion3는 기존 방법보다 성능이 뛰어났으며, 계산 비용은 이전 방법의 10분의 1에 불과했습니다.
논문 제목:RFdiffusion3을 이용한 전 원자 생체 분자 상호작용의 새로운 설계
서류 주소:https://www.biorxiv.org/content/10.1101/2025.09.18.676967v1
천연 이온 채널은 생물학적 시스템에서 중요한 역할을 하며, 인공적으로 설계된 버전은 화학유전학 도구와 센서에 널리 사용되어 왔습니다. 단백질 설계를 통해 다공성 구조를 가진 막관통 단백질을 제작하는 데 사용되어 왔지만, 천연 이온 채널처럼 특정 이온을 표적으로 하는 정밀한 아미노산 측쇄를 가진 "선택적 필터"를 설계하는 것은 기술적 한계가 있었습니다. 2025년 10월, 데이비드 베이커 연구팀은 인공지능을 사용하여 새로운 칼슘 이온 채널을 처음부터 설계하는 최초의 연구를 진행했습니다. 이 연구는 우리가 부분적으로만 이해하고 있는 복잡한 생화학적 기능조차도 이제 AI를 사용하여 기본 원리를 기반으로 구축할 수 있음을 보여줍니다.
논문 제목:정의된 선택성 필터 형상을 통한 Ca² ⁺ 채널의 하향식 설계
서류 주소:https://www.nature.com/articles/s41586-025-09646-z
데이비드 베이커 교수와 그의 팀은 최근 업적을 살펴보면, 자연적으로 무질서한 단백질에 결합할 수 있는 로고스(Logos) 전략부터 원자 수준의 분자 상호작용 설계를 가능하게 하는 RFdiffusion3, 그리고 최초의 칼슘 이온 채널 신생(de novo) 구축에 대한 획기적인 연구에 이르기까지 단백질 과학의 지형을 놀라운 속도로 변화시키고 있습니다. 베이커 교수 팀은 전산 단백질 설계를 이론에서 현실로 끊임없이 발전시키고 있습니다. 그들의 연구는 생체 분자 설계의 경계를 확장할 뿐만 아니라 "알고리즘을 이용한 생명 기능 구축"의 미래를 더욱 명확하게 보여줍니다.
참조 링크:
1.https://www.biorxiv.org/content/10.1101/2024.09.25.614868v2
2.https://www.thepaper.cn/newsDetail_forward_31663354
3.https://www.biorxiv.org/content/10.1101/2025.09.18.676967v1
4.https://www.nature.com/articles/s41586-025-09646-z