Command Palette
Search for a command to run...
임상 MRI 데이터의 가치를 극대화하기 위해 UCL 팀은 다발성 경화증 병변의 정량화를 달성하기 위해 MindGlide 모델을 제안했습니다.
다발성 경화증(MS)은 중추 신경계의 백질에 염증성 탈수초 병변이 생기는 것을 특징으로 하는 만성 장애 질환입니다. 주로 젊은층과 중년층을 타깃으로 하기 때문에 '젊은층의 보이지 않는 살인자'라고도 불립니다. 관련 통계에 따르면 전 세계적으로 280만 명 이상이 영향을 받고 있습니다. 아시아에서는 10만 명당 1~5명이 MS를 앓고 있으며, 중국에서는 외상에 이어 젊은이와 중년층에게 두 번째로 흔한 장애 원인이 되었습니다. 2018년에 중국은 이 질병을 "제1 희귀 질병 목록"에 포함시켰습니다.
뇌 자기공명영상(MRI) 바이오마커는 MS의 임상 치료와 연구에 매우 중요합니다. 예를 들어, 다중 대조 MRI 스캔을 사용하여 질병 진행을 파악하는 것이 가능합니다. 그러나 여러 가지 대조도를 얻으려면 다양한 유형의 특수 스캐닝 장비가 필요하므로 시간이 많이 걸리고 노동 집약적이며 비용이 많이 들며 많은 병원에서는 이러한 조건을 갖추고 있지 않습니다. 따라서 MRI 분석을 어떻게 간소화할 것인가가 이 문제를 해결하는 열쇠가 되며, 특히 단일 대조도 뇌 용적 계산을 통해 여러 차례 대조도 획득의 필요성을 줄일 수 있을 뿐만 아니라 임상 시험 비용도 절감할 수 있다.
이를 바탕으로 런던대학교 연구팀은 MindGide라는 도구를 개발했습니다.MS 환자 치료 중에 얻은 MRI 스캔으로부터 주요 정보를 추출할 수 있습니다.예를 들어, 뇌의 손상된 부위, 뇌 위축, 플라크와 같은 미묘한 변화가 있습니다. MindGide는 기존 MRI 스캔에는 이상적인 영상 대비가 부족하다는 것을 보여줍니다.새로운 병변이나 미묘한 뇌 조직 손상을 발견할 가능성이 여전히 있습니다.또한 이를 통해 의료진이 MS 환자의 치료 효과를 해석하고 평가하는 능력을 향상시키는 데에도 도움이 될 것으로 기대됩니다.
관련 연구는 "다발성 경화증 연구를 위해 임상 MRI 아카이브를 재활용하여 기존 스캔 데이터에서 새로운 통찰력을 얻는 방법"이라는 제목으로 Nature Communications에 게재되었습니다.
연구 하이라이트:
*단일 MRI 대조도에서 임상적으로 관련성 있는 여러 MRI 바이오마커를 추출할 수 있으며 MindGlide는 여러 핵심 영역에서 최첨단 기술을 능가합니다.
* 일반적으로 이러한 작업에 사용되지 않는 제한된 MRI 데이터와 단일 대조도를 사용해도 임상적으로 의미 있는 조직 분할 및 병변 정량화를 달성할 수 있습니다.

서류 주소:
https://go.hyper.ai/fDEgm
오픈소스 프로젝트인 "awesome-ai4s"는 100개가 넘는 AI4S 논문 해석을 모아 놓았으며, 방대한 데이터 세트와 도구도 제공합니다.
https://github.com/hyperai/awesome-ai4s
데이터 세트: 모든 데이터는 MS 환자로부터 수집됩니다.
모델의 신뢰성과 타당성을 검증하기 위해 이 연구에서는 다양한 훈련 데이터 세트와 외부 검증 데이터 세트를 사용했으며, 데이터는 전적으로 MS 환자로부터 얻었습니다.이 연구는 몬트리올 신경학 연구소의 국제 진행성 MS 연합 데이터베이스의 지원을 받았습니다.관련 교육 데이터는 주로 MS-stat 시험, ORATORIO 시험에서 추출되었으며, 영국의 3개 병원에서 얻은 소아 재발-완화 MS 환자의 일상 치료 데이터 세트와 2개의 오픈 소스 병변 분할 데이터 세트(MS-30 및 ISBI)에서도 추출되었습니다.
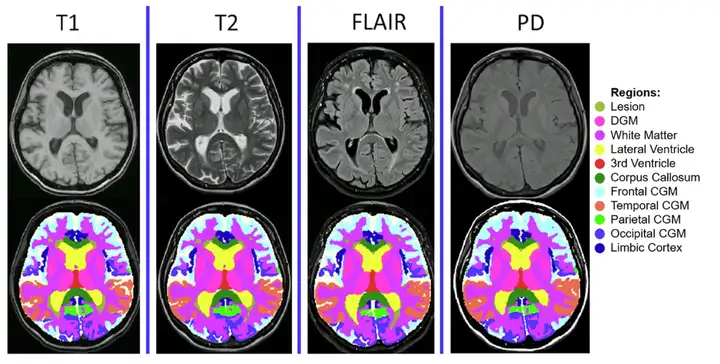
*MindGlide는 병원 기록 보관소에서 일반적으로 사용되는 MRI 대비도 및 관련 조직 강도(T1 가중, TI 가중, 양성자 밀도(PD), T2-유체 감쇠 역전 회복(FLAIR))를 사용하여 2D 및 3D 스캔을 포함한 MRI를 처리합니다.
모델 학습 단계 동안,연구진은 8,550개의 실제 이미지와 합성 이미지 데이터 세트를 사용하여 MindGide를 훈련시켰습니다.그중 2,871명의 환자(재발-완화형 MS 환자(RRMS) 1,082명, 이차 진행형 MS 환자(SPMS) 1,453명, 원발 진행형 MS 환자(PPMS) 336명 포함)로부터 총 4,247개의 실제 MRI 스캔 이미지(TI 가중 이미지 2,092개, FLAIR 이미지 2,155개 포함)가 수집되었습니다.스캔은 1.5 및 3 테슬라 자기장에서 592개의 전문 MRI 스캐너를 사용하여 수집되었습니다.연구자들은 훈련을 확대하기 위해 추가로 4,303개의 합성 스캔을 생성했습니다.
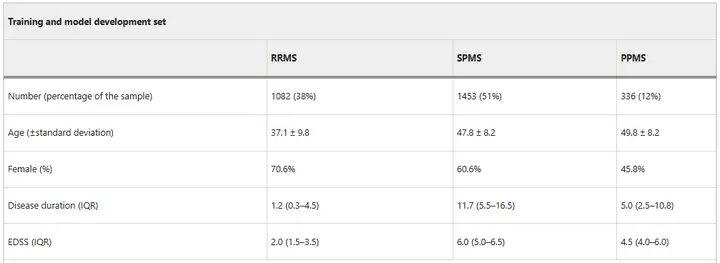
모델 검증 단계에서 연구자들은 외부 검증 세트를 사용했습니다.마인드글라이드는 14~64세 연령대를 대상으로 보편적인 사용을 위해 테스트되었으며, 여기에는 두 건의 진행성 MS 임상 시험과 소아 재발-완화 MS 환자 실제 그룹이 포함되었습니다.외부 검증 데이터 세트에는 186대의 MRI 스캐너에서 얻은 1,001명의 환자(PPMS 시험 699명, SPMS 시험 141명, RRMS 시험 161명)가 포함되었습니다.
안에,PPMS 데이터 세트에는 11,015개의 MRI 스캔이 포함되어 있습니다.(TI 가중 2,756개, T2 가중 2,754개, FLAIR 2,749개, PD 2,756개), 모든 슬라이스의 두께는 3mm(1mm x 1mm x 3mm)였습니다.SPMS 데이터 세트에는 763개의 스캔이 포함되어 있습니다.(378 TI 가중, 385 T2 가중), 슬라이스 두께가 다름(T1 가중의 경우 1mm x 1mm x 1mm, T2 가중의 경우 3mm x 1mm x 1mm)소아 RRMS 데이터 세트에는 1,478개의 스캔이 포함됩니다.(T1 가중 523개, T2 가중 475개, FLAIR 480개)에는 다양한 슬라이스 두께가 포함됩니다.
모델 아키텍처: 효율적인 3D 합성곱 신경망
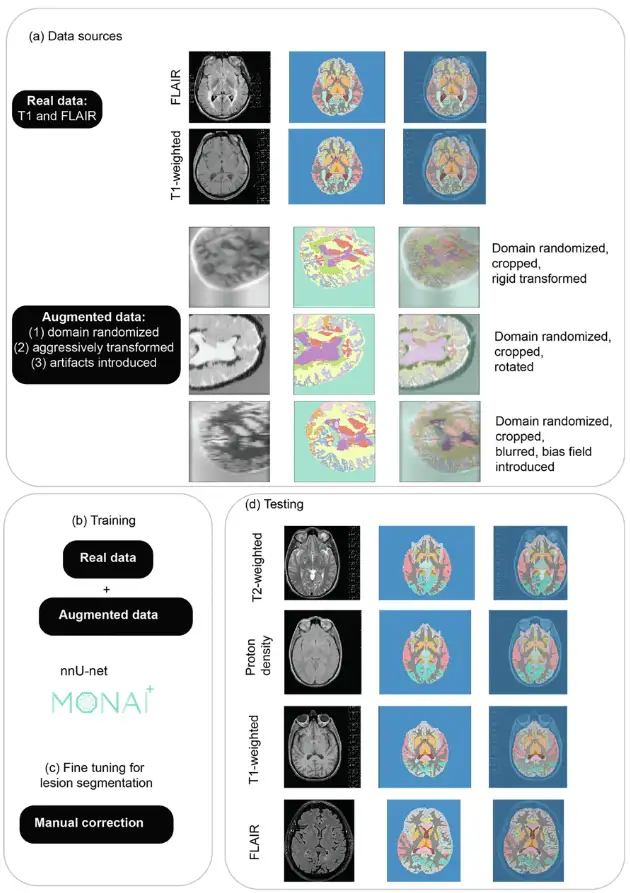
MindGlide는 U-Net 아키텍처를 기반으로 한 3D 합성곱 신경망(CNN)인 "nnU-Net"을 기반으로 개발되었습니다.하이퍼파라미터 튜닝의 비용이 많이 드는 과정을 생략하고 자동으로 자체 구성할 수 있는 기능이 있습니다. MindGide는 훈련을 통해 뇌의 회백질, 백질 영역, MS 병변을 동시에 분할하여 실제 MRI 변화에 적응하고 기존 영상 처리 소프트웨어의 인공물 문제를 해결할 수 있습니다. 전체적인 아키텍처와 전략은 아래 그림과 같습니다.
모델 학습을 위한 이미지 전처리의 경우, 연구진은 최소 전처리 파이프라인을 사용했는데, 이는 먼저 이미지 해상도를 1mm 등방성 폭셀로 정규화한 다음 nnU-Net에 따라 설계되었습니다. 그런 다음 연구원들은 훈련 중에 메모리와 계산 효율성을 최적화하기 위해 슬라이딩 윈도우 기술을 사용하여 128 x 128 x 64 폭셀 패치를 추출했습니다.
데이터 증강은 주로 무작위 수정을 통해 훈련 데이터의 다양성을 인위적으로 확장하고, 모델의 일반화를 강화하며, 과도한 적합을 줄이는 것을 포함합니다.연구자들은 두 가지 기술을 사용하여 적응성을 확장했습니다. 실제 스캔의 기하학과 이미지 강도를 왜곡하고 합성 스캔을 생성했습니다.그림 (a)에서 볼 수 있듯이, 도메인 무작위화는 강도 변화를 생성하고 다양한 MRI 대비에 대한 모델을 준비하는 데 사용됩니다.
합성 데이터는 SynthSeg 버전 2.0을 사용하여 생성되었으며, 연구자들은 훈련 중에 강화를 위해 MONAI 버전 1.2.0을 사용한 다음 훈련 데이터 세트의 레이블에서 직접 다양한 대비의 합성 스캔을 생성했습니다. 그림 (a)는 생성된 합성 데이터의 예를 보여주고, 그림 (b)는 실제 데이터와 증강된 데이터로 MindGide를 훈련하는 모습을 보여줍니다.
관련 보도에서 미디어는 직관적인 데이터를 사용하여 이 모델의 역량을 입증했습니다. 그것은 언급했다이전에는 신경방사선과 의사가 수동으로 해석하는 데 몇 주가 걸렸던 복잡한 검사 결과도 이제 MindGide를 사용하면 이미지 하나당 5~10초면 끝납니다.이를 통해 이전에는 분석할 수 없었던 이미지와 일상적인 MRI 스캔에서 새로운 가치를 얻을 수 있으며, 임상 시험과 일상적인 치료에서 다양한 치료법이 질병 진행에 미치는 효과를 테스트하기 위한 더욱 신뢰할 수 있는 기반을 제공합니다.
실험 결과: 다차원 비교를 통해 MindGide의 우수성이 입증되었습니다.
연구진은 MindGlide의 검증 효과를 평가하기 위해 이를 기존의 최첨단 기술인 WMH-SynthSeg와 SAMSEG와 비교했습니다.전자는 서로 다른 해상도와 대비의 스캔에서 백질 고신호와 뇌의 해부학적 구조를 동시에 분할할 수 있는 반면, 후자는 서로 다른 MRI 대비에서 병변과 뇌 구조를 견고하게 분할할 수 있습니다.
먼저, 실험은 세 가지의 일관성을 인간 전문가가 분류한 병변 분할 및 장애와 비교했으며, 그 결과는 아래 그림과 같습니다. MindGlide와 수동으로 표시된 실제 병변 간의 일치도가 더 높았습니다.중앙값 Dice 점수는 0.606, SAMSEG의 경우 0.504, WMH-Synthseg의 경우 0.385였습니다.
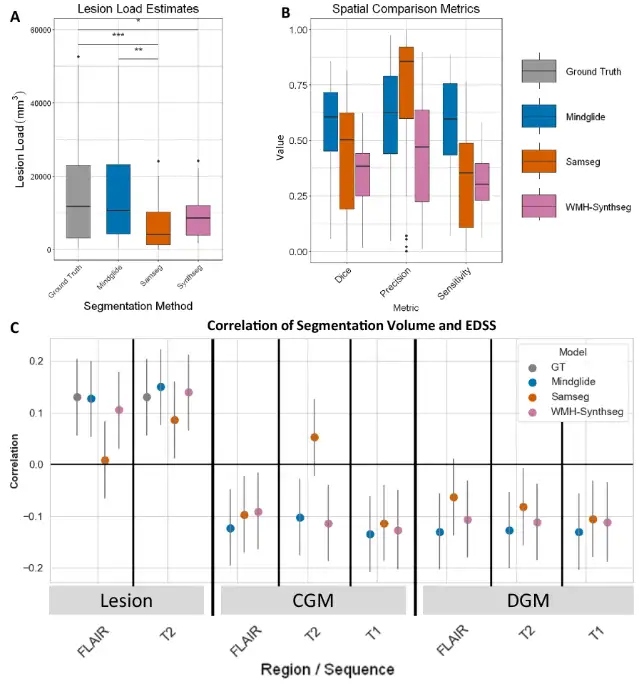
게다가,PPMS 데이터 세트에서는 MindGlide가 도출한 병변 부하와 EDSS(Expanded Disability Status Scale) 수치 간의 상관관계도 기존 기술보다 높습니다.
이후 연구진은 다양한 실험을 통해 병변 치료 효과에 대한 종단적 검증을 실시하여 MindGlide가 치료 효과를 감지하는 데 효과적임을 입증했습니다. 예를 들어, SPMS 및 PPMS 시험에서 치료군의 누적 병변 부피는 위약군보다 낮았습니다. 소아 환자군에서 MindGlide는 아래 그림에서 볼 수 있듯이 다양한 치료군에서 병변 부피의 변화를 성공적으로 감지했습니다.
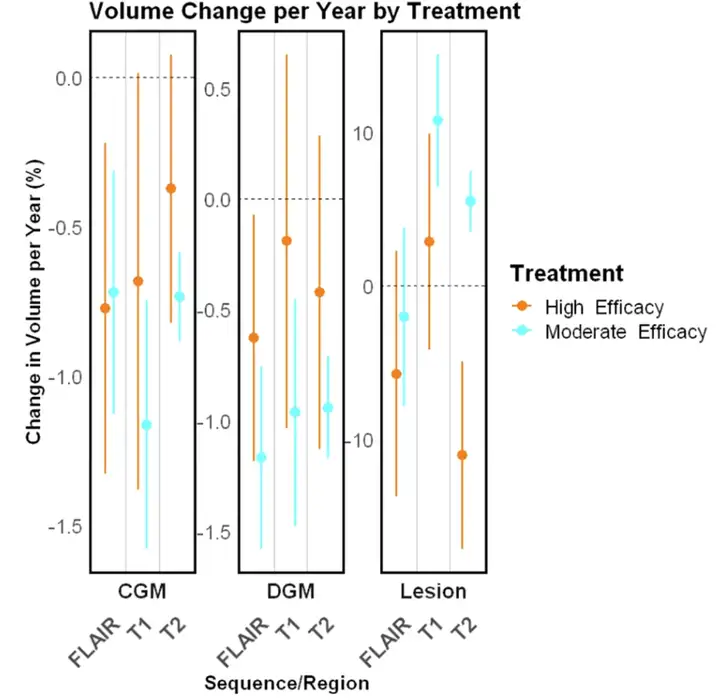
뇌 조직 손실에 대한 치료 효과를 테스트하는 중,MindGide는 치료군의 피질 GM 부피 감소율이 위약군보다 훨씬 낮다는 것을 보여주었습니다.다음 그림은 다양한 대조적 세분화 예를 보여줍니다.
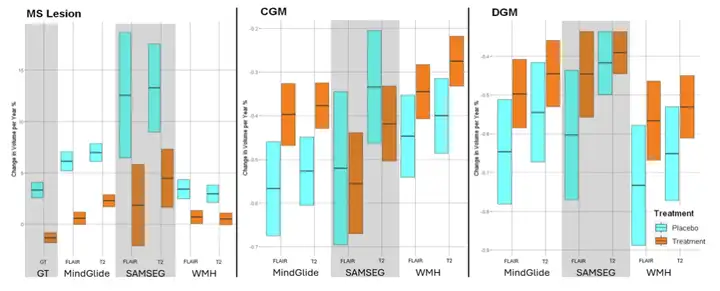
이후 연구진은 PPMS 임상 시험에서 MindGlide의 치료 효과를 다른 분할 도구와 실제 병변과 비교했습니다.실험 결과는 MindGide가 실제 결과와 매우 가깝다는 것을 보여줍니다. 이와 대조적으로, SAMSEG는 치료 효과를 과대평가하는 반면, WHM-Synthseg는 치료 효과를 과소평가합니다. 이는 MindGlide가 병변 부피 추정에서 더 높은 정확도를 가지고 있음을 나타냅니다.
아래 그림은 세 가지 영역별 뇌 부피 평가를 보여줍니다.결과에 따르면 MindGide 측정은 종단적 SAMSEG 또는 WHM-Synthseg에서 얻은 측정과 비교했을 때 치료 그룹 간에 더 나은 치료 효과를 보였습니다.
또한, 연구진은 일상적인 임상 치료 데이터 세트에서 WMH-Synthseg와 MindGlide를 시각적으로 검사한 결과, 특히 스캔 두께가 5mm를 초과할 때 전자가 상당한 실패율을 보인다는 것을 발견했습니다.시각적으로 평가한 433개 대조 중 WMH-Synthseg는 65개 스캔을 분할하지 못했지만, MindGide는 6개에서만 분할하지 못했습니다.아래에 예가 나와 있습니다.
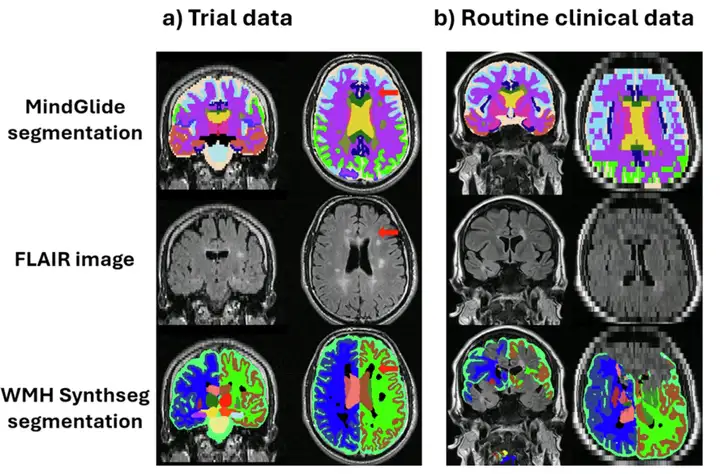
그 중 그림(b)는 WMH-Synthseg 분할이 실패한 일상 치료 임상 데이터 세트(RRMS)에서 두께 7mm의 슬라이스를 보여줍니다. 대부분의 분할 도구는 상위 또는 하위 획득 방향을 사용하도록 설계되어 있는 반면, MindGide는 어떤 방향으로 획득한 이미지의 분할을 허용하기 때문입니다.
결론적으로,MindGide는 기존 방식보다 여러 면에서 우수하며, 단일 MRI 대조도에서 여러 바이오마커를 추출할 수 있어 치료 효과를 효과적으로 모니터링할 수 있으며 다양한 임상 시나리오에 적합합니다.MS 연구와 임상적 의사결정에 대한 강력한 지원을 제공합니다.
AI는 MS 연구에 중요한 도구가 되었습니다.
최근 몇 년 동안 인공지능의 급속한 발전으로 신경 질환에 대한 응용이 가속화되었으며, 독특한 작동 메커니즘과 효율적인 방법 덕분에 의료계에서 인공지능을 통해 MS 연구를 수행할 수 있는 새로운 아이디어가 제공되었습니다. 우연히도 많은 연구소에서는 인간의 건강을 위협하는 주요 문제인 MS를 극복하기 위해 인공지능을 활용하려고 노력하고 있습니다.
예를 들어, 토론토 대학의 팡 류 교수 연구팀은 Science Advances에 "AMPA를 표적으로 하는 소분자 매개 흥분독성이 다발성 경화증 마우스 모델에서 치료적 효과를 보인다"라는 제목의 논문을 발표했습니다. 이 연구는 전통적인 이론적 관점을 극복하고 획기적인 소분자 화합물을 개발했습니다.이 약물은 AMPA 수용체 매개 흥분독성을 조절하는 새로운 메커니즘을 표적으로 삼아 작용합니다.이 연구에서는 인공지능을 사용하여 AMPA 수용체의 GluA 2 서브유닛을 표적으로 하는 소분자를 가상으로 스크리닝했습니다. 이를 통해 이러한 약물의 국제적 개발에서 빈틈을 메웠을 뿐만 아니라, 더 중요한 것은 MS 치료에 대한 완전히 새로운 아이디어를 제공했습니다.
서류 주소:
https://www.science.org/doi/10.1126/sciadv.adj6187
또한, NeuroImage에 게재된 연구에서는 MS 환자의 MRI 스캔에서 백질 병변과 41개의 신경 해부학적 구조를 동시에 분할하기 위한 새로운 오픈 소스 도구도 제안했습니다.이 방법은 위에서 언급한 SAMSEG 생성 모델을 기반으로 하며, 다양한 스캐닝 및 영상 프로토콜에 적응할 수 있으며, 병변을 미리 분할하지 않고도 위축을 평가할 수 있습니다.기존 도구의 일부 한계를 극복합니다. 관련 논문은 "다발성 경화증에서 전체 뇌 및 병변 분할을 동시에 수행하기 위한 대비 적응 방법"이라는 제목으로 출판되었습니다.
서류 주소:
https://www.sciencedirect.com/science/article/pii/S1053811920309563?via%3Dihub
이러한 모든 과학적, 기술적 성과와 최첨단 발견은 MS 연구에 있어서 인공지능의 가치를 보여줍니다. 아직 갈 길이 멀기는 하지만, 사람들에게 희망을 주기도 합니다. 위 논문의 제1 저자인 필립 괴블 박사는 인공지능을 사용하여 임상 실험을 진행하여 환자의 상태를 해결하는 것이 앞으로 5~10년 내에 현실이 될 수 있기를 바라고 있습니다.