Command Palette
Search for a command to run...
데이비드 베이커 팀의 새로운 성과! RFdiffusion은 원자 수준의 정밀 항체 De Novo 설계를 달성하기 위해 진화합니다.
19세기 후반, 독일의 세균학자 에밀 아돌프 폰 베링은 디프테리아 독소에 대한 광범위한 연구를 수행했습니다. 그 당시 디프테리아는 죽음의 신의 낫과도 같았고, 무자비하게 수많은 어린이의 목숨을 앗아갔습니다. 베링은 실험에서 토끼에게 미량의 디프테리아 독소를 주입하여 토끼의 반응을 관찰하고 독소와 싸울 방법을 찾고자 했습니다. 며칠 후, 그는 토끼들이 죽지 않았을 뿐만 아니라, 이후 디프테리아 독소 주사에 대한 내성까지 생겼다는 사실에 놀랐습니다. 추가 연구 결과, 디프테리아 독소를 중화할 수 있는 물질이 토끼 혈청에서 발견되었습니다.이것은 인간이 항체의 존재를 발견한 첫 번째 사례입니다.이 우연한 발견은 항체 연구의 응용에 대한 장을 열었고, 질병과 싸우기 위해 신체의 자연적 힘을 이용하는 것의 엄청난 잠재력을 보여주었습니다.
과학자들은 100년이 넘는 심층적 탐구 끝에 항체 연구 분야에서 노력을 계속해 왔지만, 특정 에피토프에 대한 새로운 항체를 생성하기 위해 전적으로 컴퓨터 설계에 의존하는 효율적인 경로를 아직 개발하지 못했습니다. 오늘,치료용 항체의 발견은 아직도 동물 면역이나 무작위 라이브러리 스크리닝이라는 두 가지 전통적인 방법에 주로 머물러 있습니다.점점 더 복잡해지는 질병 문제에 직면하여 이러한 기존 방법의 한계가 점점 더 두드러지고 있으며, 특정 표적을 표적으로 삼는 항체의 보다 효율적이고 정확한 설계를 달성하기 위한 새로운 획기적인 발견이 시급히 필요하며, 이를 통해 항체 연구에 새로운 희망이 생겨났습니다.
워싱턴 대학 생화학과 데이비드 베이커 교수와 그의 협력자로 구성된 팀은 기존 방법에 의존하여 항체를 발견하는 문제를 해결하기 위해 정밀하게 조정된 RF 확산 네트워크 계산 단백질 설계와 효모 디스플레이 스크리닝을 결합했습니다.우리는 원자 수준의 정밀도로 특정 에피토프에 결합할 수 있는 항체 가변 중쇄 VHH와 단일 사슬 가변 단편 scFv를 성공적으로 생성했습니다.항체 도메인의 신규 설계가 가능하다는 것이 입증되었습니다. 이 접근 방식은 새롭게 설계된 항체의 계산적 설계, 스크리닝, 분리 및 특성화를 위한 합리적인 프레임워크를 제공하여 구조와 에피토프 타겟팅에서 원자 수준의 정밀도를 달성합니다.
관련 연구 결과는 "RFdiffusion을 이용한 항체의 원자적으로 정확한 신규 설계"라는 제목으로 bioRxiv에 사전 인쇄본으로 게재되었습니다.

서류 주소:
https://doi.org/10.1101/2024.03.14.585103
오픈소스 프로젝트인 "awesome-ai4s"는 200개 이상의 AI4S 논문 해석을 모아 방대한 데이터 세트와 도구를 제공합니다.
https://github.com/hyperai/awesome-ai4s
항체 연구의 기술 혁신: AI의 획기적인 발전과 과제
항체는 단백질 치료제의 주요 범주로서 특이성이 높고 부작용이 낮아 종양, 자가면역질환 등의 분야에서 핵심적인 치료법이 되었습니다. 2025년 현재, 전 세계적으로 규제 기관의 승인을 받은 항체 약물은 160종 이상이며, 시장 규모는 지난 10년간 연평균 15%의 비율로 성장했습니다.향후 5년 내에 4,450억 달러에 이를 것으로 예상됩니다.
하지만,기존의 항체 개발 기술은 오랫동안 동물 면역과 무작위 라이브러리 스크리닝에 의존해 왔습니다.심각한 병목 현상에 직면해 있습니다. 동물 예방 접종에는 동물의 면역 체계를 자극하여 항체를 생성하기 위한 여러 차례의 항원 주사가 필요합니다.이 과정은 보통 6~12개월이 걸립니다.더욱이, 개별 동물의 면역 반응의 차이로 인해 막 단백질과 같은 복잡한 항원에 대한 매우 효과적인 항체를 얻는 것이 어렵습니다. 무작위 라이브러리 스크리닝 방법(파지 디스플레이 기술 등)은 스크리닝 범위를 확장할 수 있지만, 펼쳐진 단백질이나 당화된 에피토프 등 항원에 대한 면역 반응을 자극하기 어렵고, 스크리닝된 항체의 친화도가 일반적으로 낮습니다.
기존 기술의 한계를 극복하기 위해 계산 설계와 인공지능이 점차 항체 연구 개발의 새로운 방향으로 자리 잡았습니다. 초기 연구에서는 기존 항체 프레임워크에 잔류물을 삽입하고, 보완 결정 영역(CDR 루프)의 형태를 최적화하고, Rosetta 알고리즘을 사용하여 상호작용 인터페이스를 변환함으로써 항체 성능을 성공적으로 개선했습니다. 예를 들어,2018년 연구에서는 계산 설계를 통해 항-PD-1 항체의 친화력을 20배 증가시켰습니다.
최근 몇 년 동안 딥러닝 기술은 항체 시퀀스 생성을 더욱 촉진했습니다. 2023년, 스탠포드 대학의 한 팀은 신경망을 사용하여 새로운 코로나바이러스 변종에 대한 광범위 중화 항체를 설계했고, 이들의 시험관 내 활동성은 기존 방법보다 3배 더 높았습니다. 2024년에데이비드 베이커 팀에서 개발한 RFdiffusion 모델은 사전 설정된 백본 구조가 필요 없이 결합 단백질의 새로운 설계를 가능하게 합니다.이 기술은 단백질 접힘의 물리적 과정을 시뮬레이션하여 표적 에피토프의 모양과 매우 상보적인 결합 인터페이스를 생성하고, 인플루엔자 바이러스 헤마글루티닌에 대한 새로운 억제제를 성공적으로 설계했습니다. 그러나 이 연구는 α-나선 및 β-폴드와 같은 규칙적인 2차 구조를 가진 에피토프에만 적용할 수 있는 반면, 항체는 일반적으로 결합을 달성하기 위해 복잡한 고리 구조(예: CDR-H3)에 의존하기 때문에 항체 설계에 직접 적용하는 것은 여전히 어렵습니다.
구조적으로 정밀한 항체를 처음부터 설계하는 것, 즉 알려진 항체와 상동성이 없는 항체를 설계하는 것은 여전히 해결되지 않은 문제로 남아 있으며, 핵심 과제로는 동적 구조 시뮬레이션 부족, 고품질 데이터 부족, 긴 실험 검증 주기 등이 있습니다.
항체의 결합 과정에는 유연한 CDR 루프의 구조적 변화가 수반되며, 기존 알고리즘으로는 이러한 동적 상호작용을 정확하게 시뮬레이션하는 데 어려움이 있습니다. 동시에 항체-항원 복합체에 대한 구조적 데이터의 부족으로 인해 딥러닝 모델의 일반화 능력이 제한됩니다. 계산적 설계를 통해 초기 R&D 시간을 크게 단축할 수 있지만, 발현 정제와 활성 테스트에는 여전히 몇 주가 걸리므로 기술 폐쇄 루프에서 병목 현상이 발생합니다.미래의 획기적인 발전을 위해서는 물리적 모델과 생성적 AI 도구를 통합하는 하이브리드 알고리즘 개발이 필요할 수 있습니다.단일 세포 시퀀싱과 극저온 전자 현미경 데이터는 교차 규모 데이터베이스 구축을 기반으로 통합되며, "건식 및 습식 폐쇄 루프" R&D 모델을 기반으로 한 로봇 자동화를 통해 실시간 반복이 달성됩니다.
동물 면역에서부터 컴퓨터 설계에 이르기까지 항체 기술의 혁신은 생물의학 분야의 패러다임 전환일 뿐만 아니라, 여러 학문 분야의 국경 간 잠재력을 반영하기도 합니다. AI와 합성생물학의 발전으로 항체를 완전히 처음부터 설계한다는 비전이 점차 실현될 가능성이 있으며, 이는 정밀 의학의 새로운 장을 열어줄 것입니다.
최근 계산 항체 설계 분야에서 중요한 획기적인 발전이 이루어졌다는 점은 주목할 만합니다. 2025년 3월, 데이비드 베이커의 팀은 RFdiffusion이라는 새로운 AI 단백질 생성 도구를 개발했습니다(이전 명칭: 새로운 RFdiffusion).CDR 루프와 같은 항체 가변 영역에 맞게 특별히 최적화된 모델의 새로운 버전이 출시되었습니다.연구팀은 2024년 3월 연구에서 나노바디와 같은 단쇄 기능성 항체 단편을 생성하는 데 성공했지만, 항체 구조의 복잡성으로 인해 당시 버전(일반적인 RFdiffusion이라고 함)은 여전히 더 복잡한 항체 구조를 설계하는 데 한계가 있었습니다.
1년이 넘는 알고리즘 반복을 거쳐 새로운 RFdiffusion은 이제 항체-항원 복합체 구조 데이터베이스 교육을 도입하여 천연 인간 항체에 더 가까운 보다 완전한 단일 사슬 가변 단편 scFv를 생성할 수 있습니다. 이 진행 상황은AI는 템플릿이 필요 없이 완전한 항원 결합 도메인을 갖춘 항체 중쇄 및 경쇄의 조정된 설계를 달성했습니다.항체 설계에 새로운 희망을 가져다 줍니다.
새로운 RFdiffusion: 원자 수준의 정밀도를 갖춘 De novo 항체 설계
연구팀은 RFdiffusion을 항체 설계에 적용하기 위해 이를 기반으로 몇 가지 미세 조정을 했습니다. 아래 그림에서 보듯이, 학습 과정에서는 AlphaFold2/RF2 프레임워크를 사용하여 단백질 골격을 표현하고, 프레임워크가 인식할 수 없을 때까지 일련의 "시간 단계(T)"를 통해 단백질 프레임워크에 노이즈를 추가합니다. 각 시간 단계에서 RFdiffusion은 실제 구조 X₀와 예측된 구조 pX₀ 사이의 평균 제곱 오차 mse를 최소화하여 최적화된 잡음 제거 구조를 예측합니다. 이 독특한 훈련 방법을 거친 후, RFdiffusion은 추론 시점의 무작위 잔류물 분포로부터 점진적으로 새로운 단백질 구조를 생성할 수 있습니다.
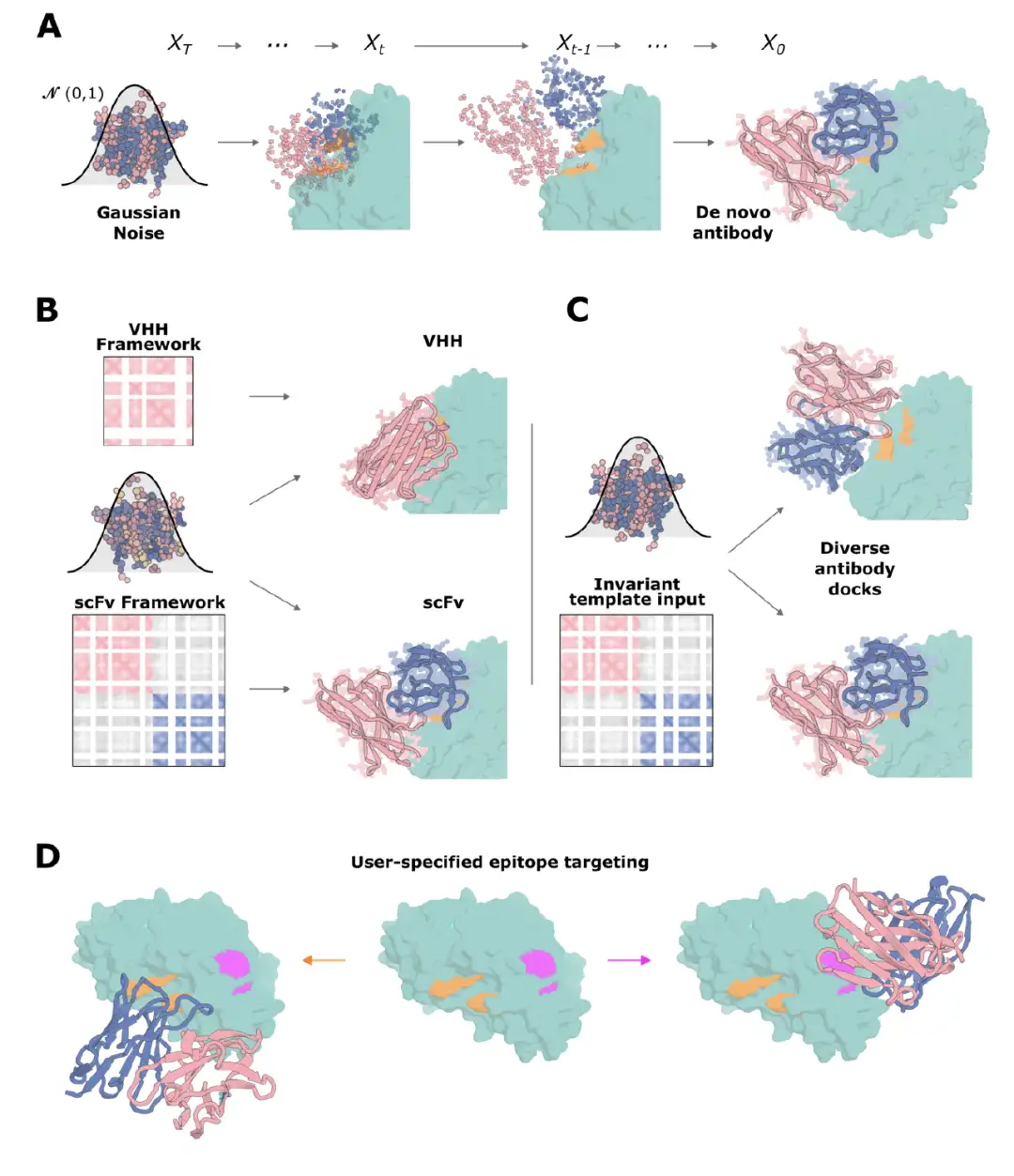
이후, 이 연구에서는 새로운 RFdiffusion을 적용하여 단일 도메인 항체 VHH를 설계했습니다. VHH는 낙타과 중쇄 항체의 가변 도메인을 기반으로 설계되었으며, 크기가 작기 때문에 이러한 설계를 인코딩하는 유전자를 단일 사슬 가변 단편 scFv나 항원 결합 단편 Fab보다 조립하기가 더 쉽고 저렴합니다.
VHH는 CDR 루프가 3개로 기존 항체의 6개보다 적지만, VHH의 평균 상호작용 표면적은 기존 항체와 매우 유사합니다.이는 VHH를 설계하는 접근 방식이 항체 설계에도 적용 가능하다는 것을 시사합니다.
VHH를 설계하기 위해 연구진은 널리 사용되는 키메라 VHH 프레임워크를 기반으로 선택하여 Clostridium difficile 독소 B(TcdB), 인플루엔자 H1 헤마글루티닌 HA 등 일련의 질병 관련 표적을 타겟팅하고 ProteinMPNN을 통해 표적 컨텍스트에서 CDR 루프 시퀀스 설계를 수행한 다음 미세 조정된 RoseTTAFold2 네트워크를 사용하여 스크리닝했습니다. 인플루엔자 HA를 설계할 때, 실험 설계 조건을 계산 매개변수와 일관되게 만들기 위해 연구자들은 곤충 세포에서 발현된 상업적으로 생산된 단량체 HA 제품을 사용하여 친화도 측정을 수행했습니다.
결과는 다음과 같습니다RF 확산을 통해 표적 에피토프와 특이적으로 상호작용하는 VHH를 설계할 수 있습니다.아래 그림은 각각 RSV 부위 III, 인플루엔자 HA, RBD 및 TcdB에 대한 가장 높은 친화도 결합제를 보여줍니다. CDR 루프는 자연 VHH의 루프와 상당히 다르며, 이는 해당 설계가 훈련 데이터 세트의 범위를 벗어났음을 나타냅니다. TcdB의 경우, 표적 에피토프는 Frizzled-7 인터페이스이고 PDB에는 이 부위를 표적으로 하는 항체나 VHH가 없습니다. 게다가 TcdB VHH는 CSPG4 노크아웃 세포에서 TcdB의 독성을 중화시켰습니다.
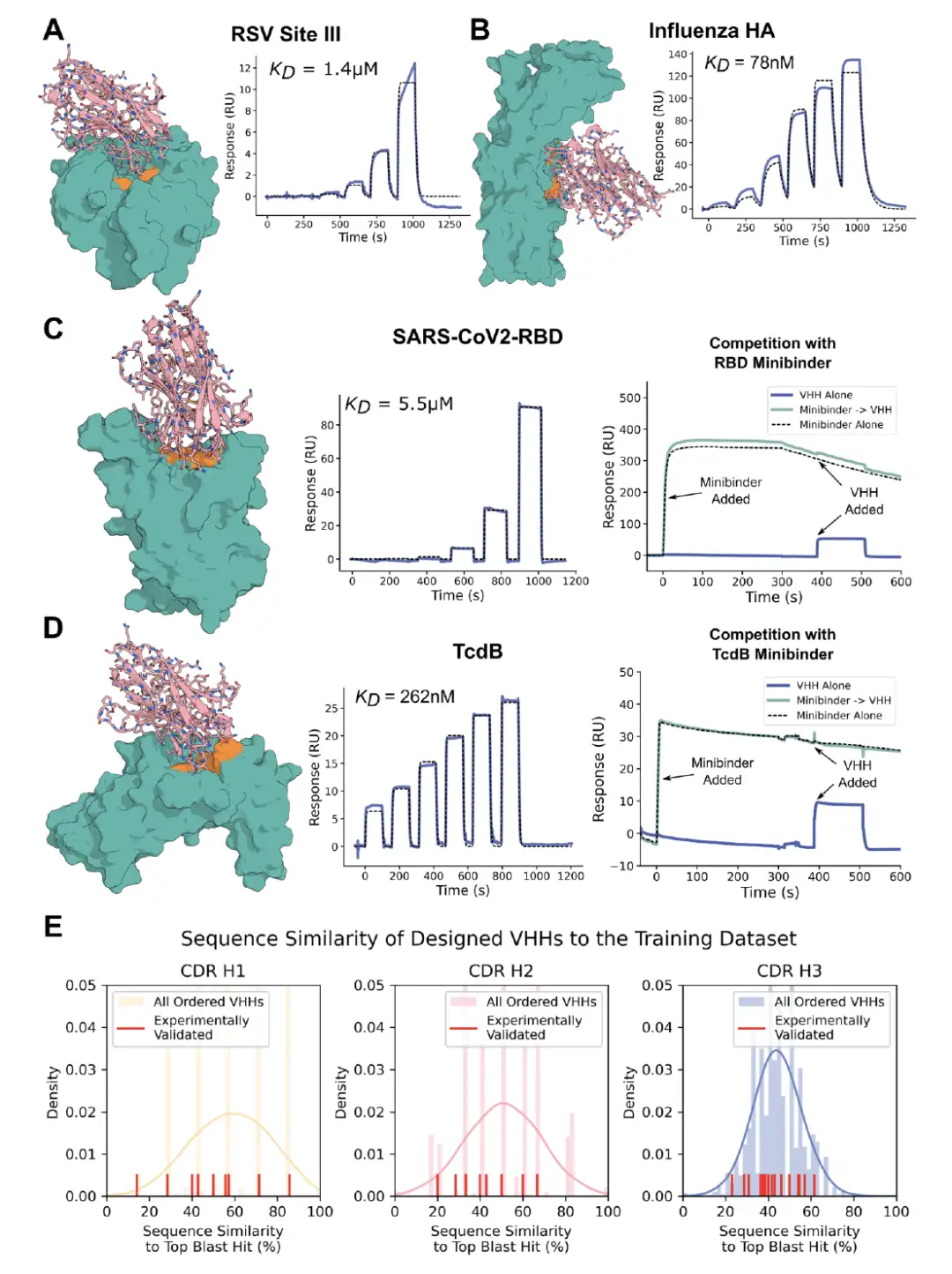
* 그림 AC: RSV III 부위, 인플루엔자 HA, RBD, TcdB를 타겟으로 하는 VHH 디자인의 테스트 결과
* 그림 E: VHH 설계와 훈련 데이터 세트의 차이점
연구진은 RFdiffusion이 단일 사슬 가변 단편 scFv 포맷으로 중쇄와 경쇄를 설계할 수 있는 능력을 더욱 탐구했습니다. VHH와 달리 scFv의 설계는 더 복잡하며 6개의 CDR을 모두 구성하고 중쇄와 경쇄 모두에 도킹 패턴을 만들어야 합니다. 그러나 scFv의 유전자 합성은 어려움에 직면해 있다. 한편, scFv 서열은 길고 기존의 올리고뉴클레오타이드 쌍을 사용하여 조립하기 어렵습니다. 반면, scFv는 높은 서열 상동성을 가지고 있어 특정 페어링이 어렵습니다.
이를 위해 연구진은 중쇄와 경쇄의 구축을 달성하기 위한 단계적 조립 프로토콜을 개발했습니다.이들은 디자인 모델별로 구체적으로 페어링되거나, 유사한 대상 바인딩 모드를 가진 디자인 하위 집합으로 결합되고 혼합될 수 있습니다.실험 결과, 서로 다른 디자인의 중쇄와 경쇄 쌍을 결합하여 생성된 새로운 scFv는 원래 디자인과 유사한 빈도로 표적 에피토프에 결합할 수 있는 것으로 나타났습니다. 더욱이, 동일한 결합 방향을 갖는 설계된 앙상블에서 중쇄와 경쇄의 CDR은 서로 다른 영역과 상호작용하며 구조적 정밀도를 잃지 않고 결합될 수 있는 반면, 무작위적 페어링에서는 예상한 결합자가 생성되는 경우가 거의 없습니다.
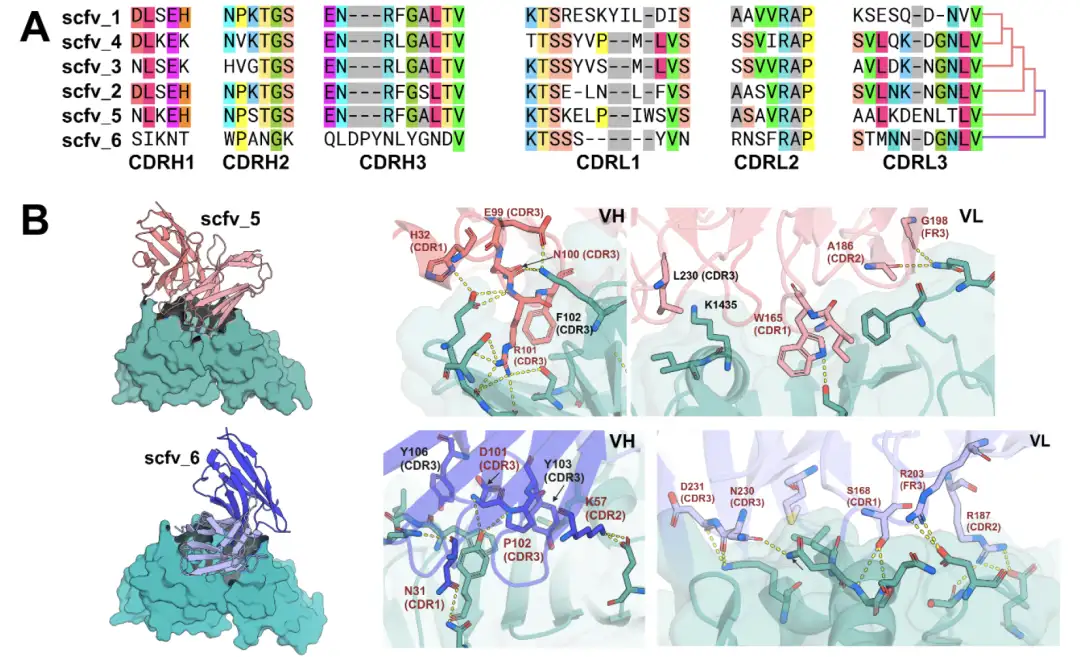
* 그림 A: TcdB에 결합하는 6개 scFv의 다중 시퀀스 정렬
* 그림 B: AlphaFold3는 TcdB 수용체 결합 도메인과 복합체를 이루는 scFv5 및 scFv6의 구조를 예측합니다.
데이비드 베이커: 항체와 RF 확산의 진화
이 연구는 실제로 데이비드 베이커의 연구 결과의 빙산의 일각에 불과합니다. 실제로 계산생물학의 최전선에서 데이비드 베이커의 팀은 인공지능 기반 단백질 설계를 통해 바이러스 타겟팅부터 질병 치료까지 일련의 획기적인 성과를 달성했습니다.

그 중에서도 RFdiffusion 모델은 항체 약물 개발의 패러다임을 바꾸는 데 중요한 기반이 되었습니다. 2021년, 데이비드 베이커의 팀은 AlphaFold2 프레임워크를 기반으로 RosettaFold를 개발했습니다.핵심 기능은 알려진 단백질의 3차원 구조를 예측하는 데 국한됩니다.
* RoseTTAFold 오픈소스 주소:
https://github.com/RosettaCommons/RoseTTAFold
연구팀은 곧 진짜 혁명은 '번식'이 아니라 '생성'에 있다는 것을 깨달았습니다. 그래서 그들은 확산 모델과 단백질 접힘 알고리즘을 결합하여 2023년에 첫 번째 세대의 RFdiffusion을 출시했습니다. 이 모델은 역공학의 열쇠를 얻는 것과 같습니다. 기존 방식에서는 아미노산 서열에서 구조를 추론해야 합니다.RF 확산은 목표 기능 요구 사항에 따라 새로운 단백질 골격을 역으로 생성할 수 있습니다.초기 시험에서 인플루엔자 헤마글루티닌에 결합하는 나노바디를 성공적으로 설계했지만, 생성된 항체의 CDR 루프 영역에는 여전히 구조적 편차가 있었고, 극저온 전자 현미경 검사에서 결합 계면에서 1.2Å의 평균 제곱근 편차가 나타났습니다.
* 서류 주소:
https://www.science.org/doi/10.1126/science.abj8754
이러한 한계로 인해 2024년에 동적 구속 시스템이라는 핵심 업그레이드가 도입되었습니다.연구팀은 항원-항체 결합 부위의 물리적, 화학적 매개변수 제약 조건을 모델에 추가하여, 구조적 안정성을 고려할 뿐만 아니라 분자 간의 동적 상호 작용도 시뮬레이션하는 생성 과정을 구현했습니다.
업그레이드된 RFdiffusion은 새로운 코로나바이러스 스파이크 단백질 항체 설계에서 매우 우수한 성능을 보였습니다. 구축된 유연한 링 구조는 바이러스 표면에 보존된 에피토프를 정확하게 고정했으며, 이는 실험을 통해 검증되었습니다.결합 친화도는 0.8nM에 이르며, 이는 천연 항체보다 15배 강력합니다.더욱 주목할 만한 점은 이 모델이 "치료 불가능한" 표적에 도전하기 시작한다는 것입니다. IL-23 수용체를 위해 설계된 소형 항체는 아미노산이 58개에 불과하지만 80°C의 고온과 펩신 환경에서도 활성을 유지하여 항체의 경구 투여를 처음으로 실현했습니다.
* 서류 주소:
https://www.biorxiv.org/content/10.1101/2024.03.14.585103v2
2025년에 RFdiffusion은 멀티모달 융합 단계에 들어갔습니다. 연구팀은 단일 세포 시퀀싱 데이터와 극저온 전자 현미경 구조 라이브러리를 통합하여 모델이 환자의 면역 레퍼토리 특성에 따라 개인화된 항체를 직접 맞춤화할 수 있도록 했습니다. 최근 사례에서는 약물 저항성 폐암 환자의 종양 신항원이 시스템에 주입되었습니다.RFdiffusion은 36시간 내에 12개의 후보 항체를 생성했으며, 그 중 3개는 유기체 모델에서 상당한 종양 사멸 효과를 보였습니다.이 모델은 더 이상 항체 설계에만 국한되지 않습니다. 심해 중정맥 박테리아의 기계적 감지 이온 채널과 인간 항체를 융합하여 종양 미세환경의 pH 변화를 감지할 수 있는 스마트 약물을 만드는 등 종간 단백질 요소의 합성을 탐구하고 있습니다.
* 서류 주소:
https://www.nature.com/articles/s41586-024-08393-x
RFdiffusion이 '단백질 3D 프린터'에서 '생명 기능 설계자'로 변모하면서 합성생물학의 경계를 새롭게 정의하고 있는 것을 볼 수 있습니다. 더욱 흥미로운 점은 이러한 진화가 끝나지 않을 것이라는 점이며, 항체 기술의 혁신이 생물의학 분야를 새로운 차원으로 끌어올리고 있다는 점입니다.