Command Palette
Search for a command to run...
항암화학요법 저항과 종양 재발에 맞서 싸우세요! 산둥대 연구팀, AI 활용해 유방암 줄기세포에 대한 강력한 방어력 구축

유방암은 여성 악성 종양 중 사망 원인 1위이며, 의학계의 주요 관심사였습니다. 현재 세포독성 화학요법은 유방암 환자에게 가장 흔한 전신 치료법입니다. 어느 정도 증상을 완화할 수는 있지만 암세포가 재발하거나 전이될 가능성도 있습니다.
이전 연구에서는 다음과 같은 사실이 밝혀졌습니다.유방암 줄기세포(BCSC)는 유방암이 화학요법과 방사선요법에 저항하는 원인입니다. BCSC는 유방암 세포의 일부에 불과하지만, 놀라울 정도로 무한한 증식 잠재력과 종양을 유발할 수 있는 능력을 가지고 있습니다. 더욱 충격적인 것은 화학요법 과정 자체가 비BCSC 세포를 BCSC로 변환하는 과정을 촉진하여 종양 재발 및 전이 위험을 증가시킬 수 있다는 것입니다.
BCSC의 화학요법에 대한 반응 메커니즘을 깊이 이해하는 것은 유방암 환자의 예후를 개선하는 데 매우 중요하다는 것을 알 수 있습니다. 임상적으로는 기존 치료 옵션을 최적화하기 위해 BCSC를 식별하고 억제할 수 있는 방법이 시급히 필요합니다.
이러한 도전에 직면하여,산둥대학의 루하이취안, 쑨롱, 장카이, 산시 의대의 메이치는 헬릭스 매트릭스 등의 연구팀과 협력하여 획기적인 진전을 이루었습니다. 그들은 머신 러닝 기술을 사용하고 mRNA 분석을 기반으로 원발성 유방암 환자의 샘플에서 암줄기세포의 특성을 평가하는 새로운 방법인 BCSC 시그니처를 성공적으로 개발했습니다.이 연구는 BCSC 조절에 있어서 폴리아민 동화작용의 핵심적 역할을 밝혀낼 뿐만 아니라, 유방암의 임상적 치료를 위한 새로운 전략과 방향을 제시합니다.
해당 연구는 "폴리아민 동화작용은 화학요법으로 유발된 유방암 줄기세포 강화를 촉진한다"라는 제목으로 국제적으로 유명한 학술지인 Advanced Science에 게재되었습니다.
연구 하이라이트:
* 연구원들은 기계 학습 방법을 사용하여 유방암 환자 샘플에서 암 줄기세포성을 평가하기 위해 mRNA 기반 BCSC 시그니처를 개발했습니다.
* 이 연구에서는 폴리아민 동화작용이 BCSC 조절에 중요한 역할을 한다는 것을 발견했습니다. 화학요법은 HIF-1에 의해 조절되는 폴리아민 동화 경로를 활성화하여 BCSC의 풍부함을 촉진합니다.
* 본 연구에서는 화학요법으로 유도된 HIF-1 전사 활성, 폴리아민 대사 수치 및 BCSC 농축을 병용 시 효과적으로 억제할 수 있는 새로운 특정 HIF-1 억제제인 Britannin을 발견했습니다.

서류 주소:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202404853
TCGA 데이터 세트를 사용하여 피어슨 상관 분석과 머신 러닝 알고리즘 간의 연관성 구축
유전자 발현 수준에 따른 원발성 유방암 환자 샘플의 줄기세포 특성을 정량적으로 평가하기 위해,이 연구에서는 TCGA(암 게놈 아틀라스 컨소시엄)의 침습성 유방암에 대한 데이터를 사용했습니다. BRCA1(BRCA2) 데이터 세트는 단변량 로지스틱 회귀(OCLR) 머신 러닝 알고리즘을 사용하여 mRNA 발현과 mRNA 줄기 세포 지수(mRNAsi)를 상관시키는 데 사용되었으며, 이를 통해 mRNA 기반 BCSC 특징을 개발했습니다.
이 연구에서는 또한 2,032명의 유방암 환자 데이터 세트를 기반으로 Kaplan-Meier 곡선을 생성했는데, 이는 부분적으로는 원발 종양에서 BCSC P-Sig와 N-Sig의 발현을 기준으로 계층화되었고, 부분적으로는 화학요법을 받은 1,372명의 유방암 환자 데이터 세트를 기반으로 했습니다.
구체적으로, 아래 그림 A에서 볼 수 있듯이, 이 연구에서는 먼저 피어슨 상관 계수 r>0.70을 갖는 81개 유전자와 피어슨 상관 계수 r<-0.70을 갖는 91개 유전자를 식별하고 이를 각각 BCSC 양성 시그니처(P-Sig)와 음성 시그니처(N-Sig)로 정의했습니다.
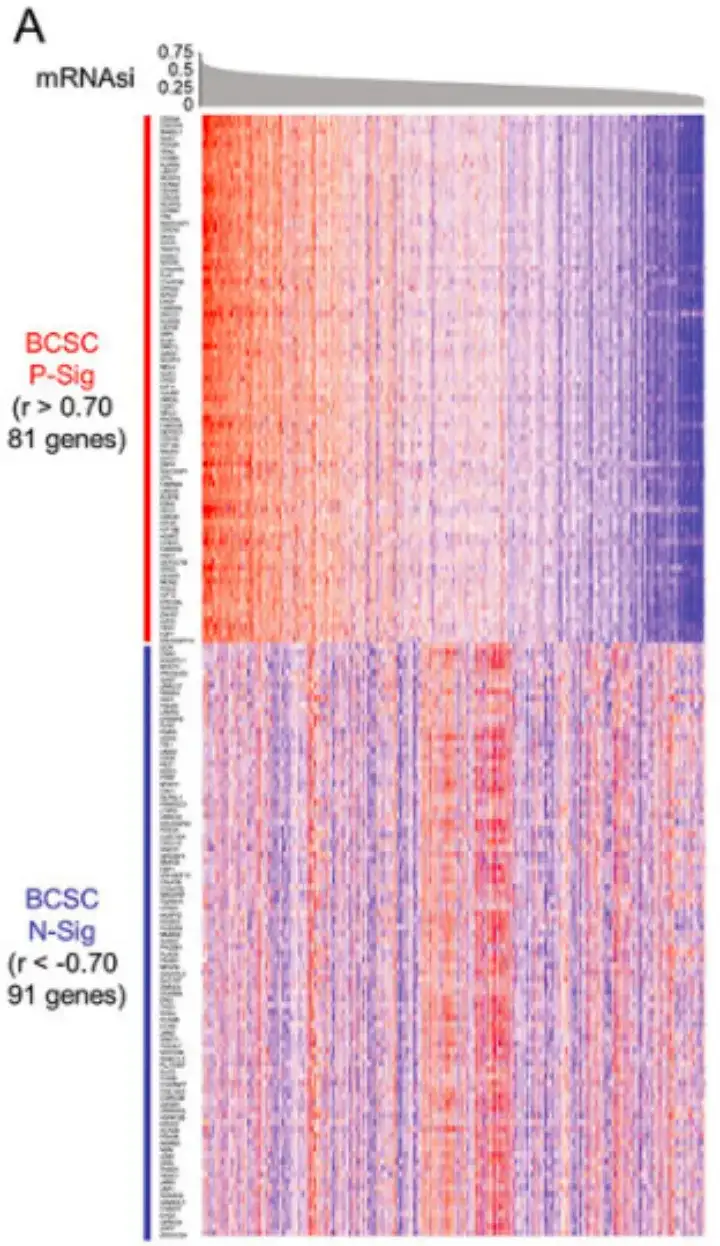
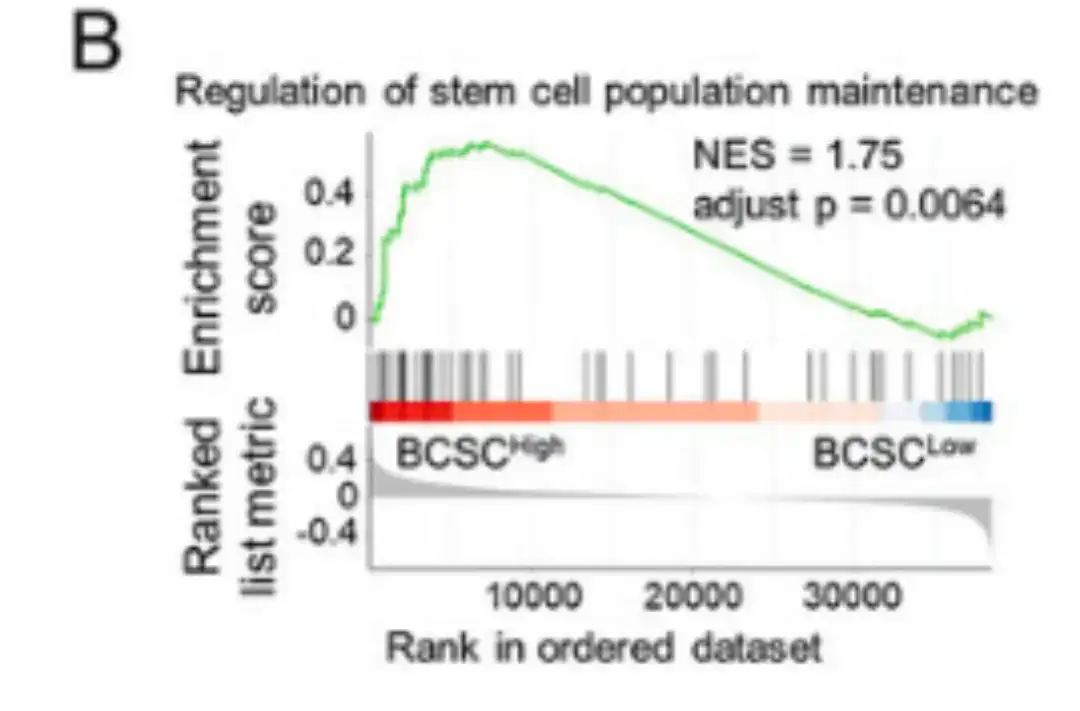
이후, 아래 그림 B에 표시된 대로, 이 연구에서는 BCSChigh와 BCSClow 데이터 세트를 비교하고 BCSC 특징의 발현을 기준으로 그룹을 계층화하여 순위 기반 유전자 세트 풍부 분석(GSEA)을 수행했습니다.
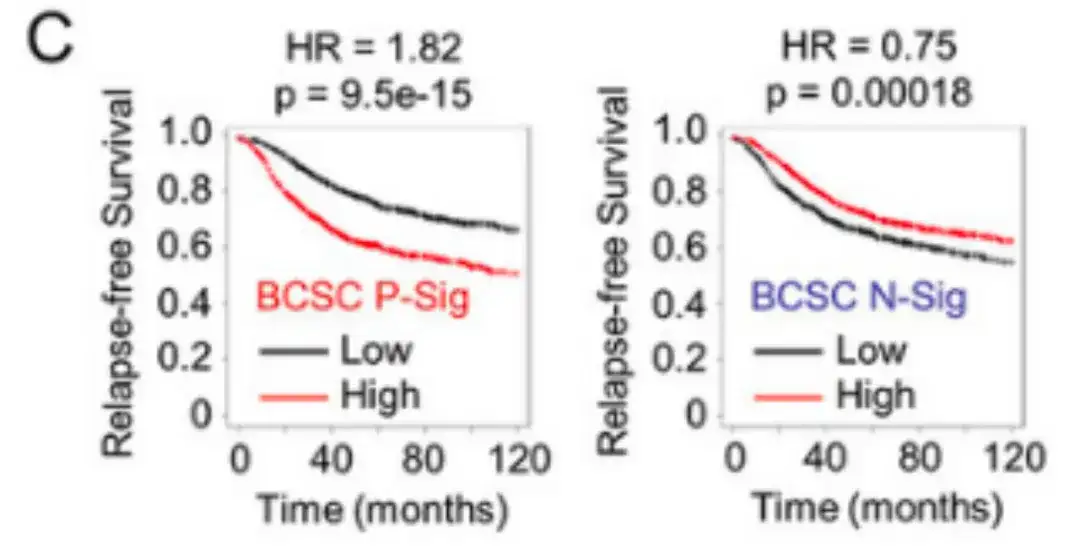
연구진은 2,032명의 환자를 대상으로 BCSC 발현과 재발 없는 생존기간(RFS) 간의 상관관계를 분석한 결과, BCSC P-Sig 발현이 중앙값보다 높은 환자의 경우 RFS가 유의미하게 감소한 반면, BCSC N-Sig 발현이 중앙값보다 높은 환자의 경우 RFS가 증가한 것을 발견했습니다(아래 그림 C 참조).
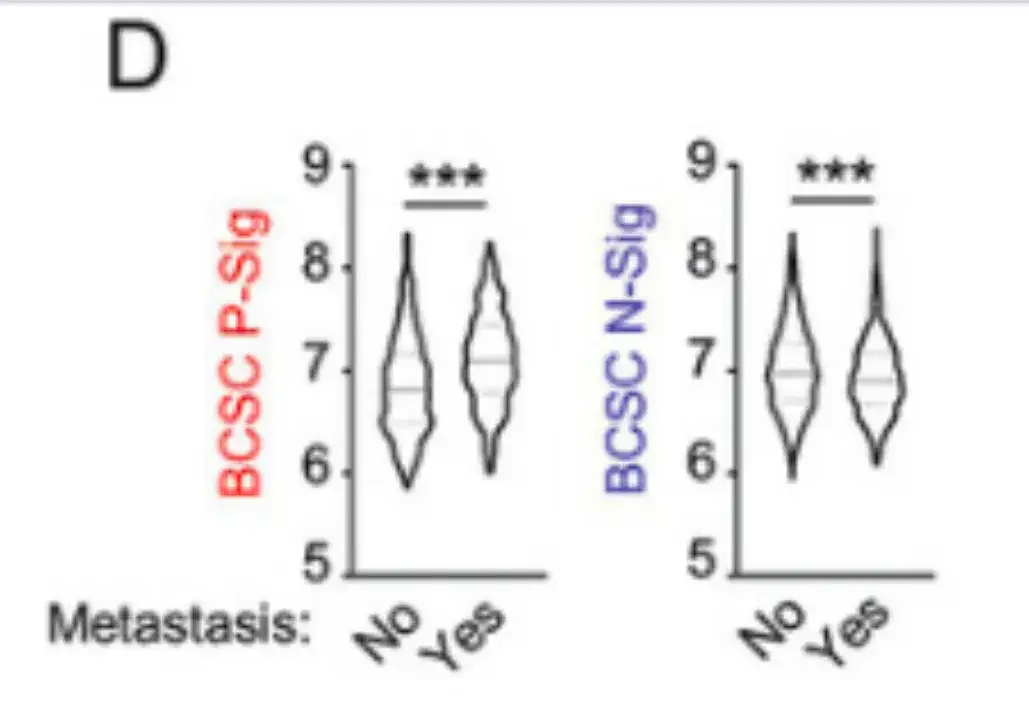
이 연구에서는 또한 국제 유방암 컨소시엄의 분자 분류 데이터베이스(METABRIC)에 있는 1,979명의 유방암 환자의 데이터를 분석했습니다.결과는 아래 그림 D에 나타나 있습니다. 5년 이내에 전이가 발생한 환자는 전이가 발생하지 않은 환자에 비해 원발 종양에서 BCSC P-Sig 발현이 더 높고 BCSC N-Sig 발현이 더 낮았습니다.
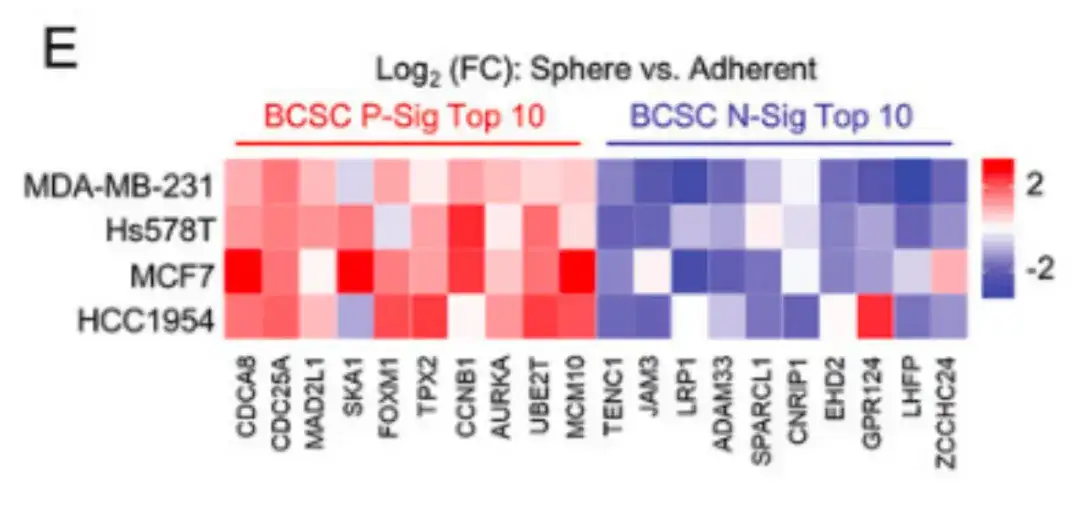
또한, 아래 그림 E에서,이 연구에서는 또한 다양한 유방암 세포주에서 BCSC의 특성을 검증했습니다.맘모스피어 배양 배지에서 배양한 유방암 세포는 표준 폴리스티렌 조직 배양 접시에서 배양한 세포에 비해 BCSC P-Sig의 발현이 더 높고 BCSC N-Sig의 발현이 더 낮았습니다.
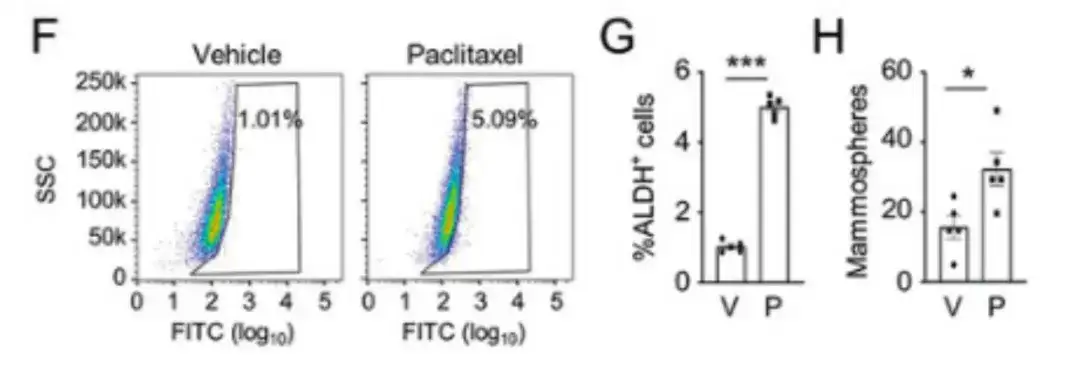
화학 요법 약물이 BCSC 인구에 어떤 영향을 미치는지 평가하려면이 연구에서는 인간 유방암 세포인 MDA-MB-231을 암컷 중증 복합 면역 결핍(SCID) 마우스의 유방 지방 패드(MFP)에 주입하고 마우스에 파클리탁셀을 투여했습니다. 그림 F, G 및 H에서 볼 수 있듯이, 파클리탁셀은 ALDH+ 세포의 비율과 유방구 형성 세포의 수를 상당히 증가시켰습니다.
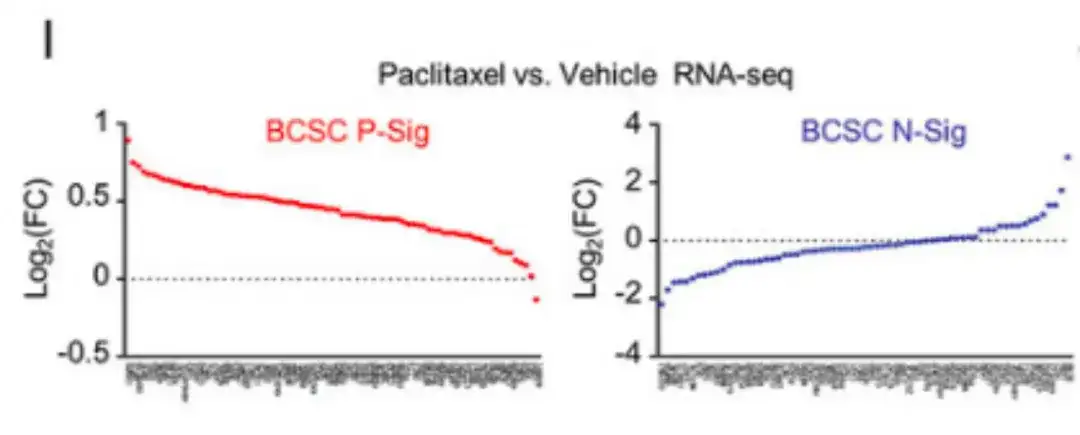
한편, 아래 그림 I에서 RNA-seq 분석은 파클리탁셀 치료가 대부분의 BCSC P-Sig 유전자의 발현을 증가시키고 대부분의 BCSC N-Sig 유전자의 발현을 감소시켰음을 보여주었습니다.
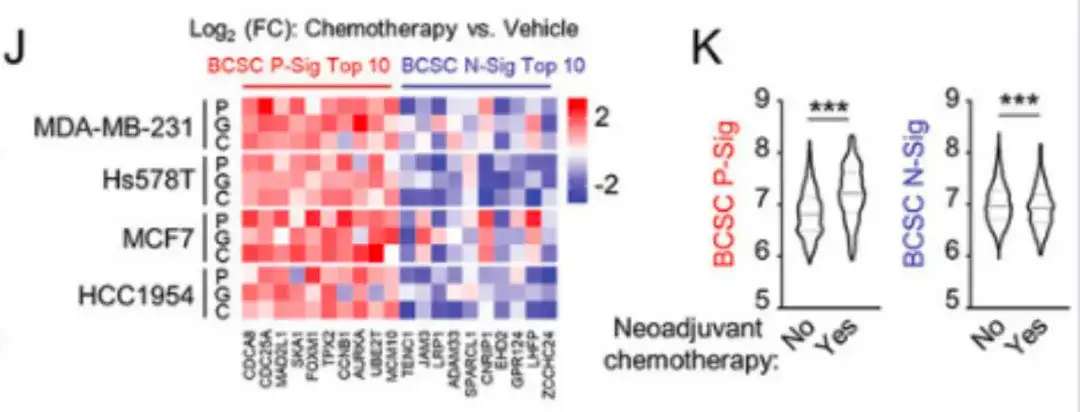
아래 그림 J에서 볼 수 있듯이, 이 연구에서는 파클리탁셀 외에도 FDA 승인 화학 요법 약물인 젬시타빈과 카보플라틴을 사용하여 유방암 세포를 치료했습니다.이들 약물은 BCSC P-Sig 유전자의 발현을 증가시키고 BCSC N-Sig 유전자의 발현을 감소시켰다.아래 그림 K에서 볼 수 있듯이, METABRIC 환자의 샘플에서도 신보조 화학요법을 받는 환자의 경우 원발 종양 조직에서 BCSC P-Sig 유전자의 발현이 더 높은 반면, BCSC N-Sig 유전자의 발현은 더 낮았음이 나타났습니다.
폴리아민 동화작용은 BCSC 풍부화와 양의 상관관계가 있으며 HIF-1 억제제인 Britannin은 폴리아민 생합성을 감소시키고 BCSC를 근절할 수 있습니다.
세포 대사 관점에서 화학 요법으로 유도된 BCSC 농축 메커니즘을 탐색하기 위해,이 연구에서는 TCGA BRCA 환자 21명을 BCSC 특징 발현에 따라 BCSChigh 그룹과 BCSClow 그룹으로 나누고, 아래 그림 A에서 볼 수 있듯이 두 그룹 간의 399개 대사산물 수준을 비교했습니다.
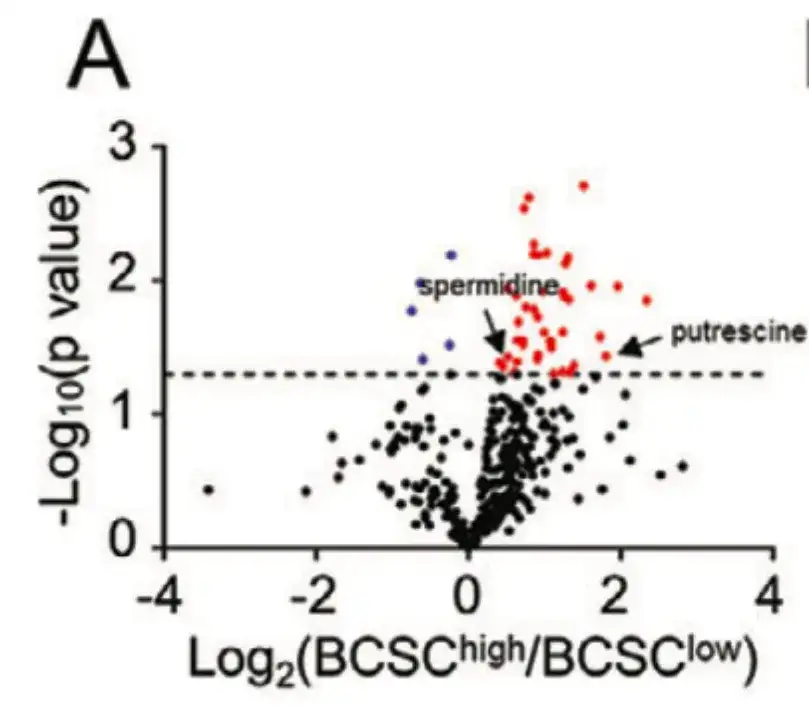
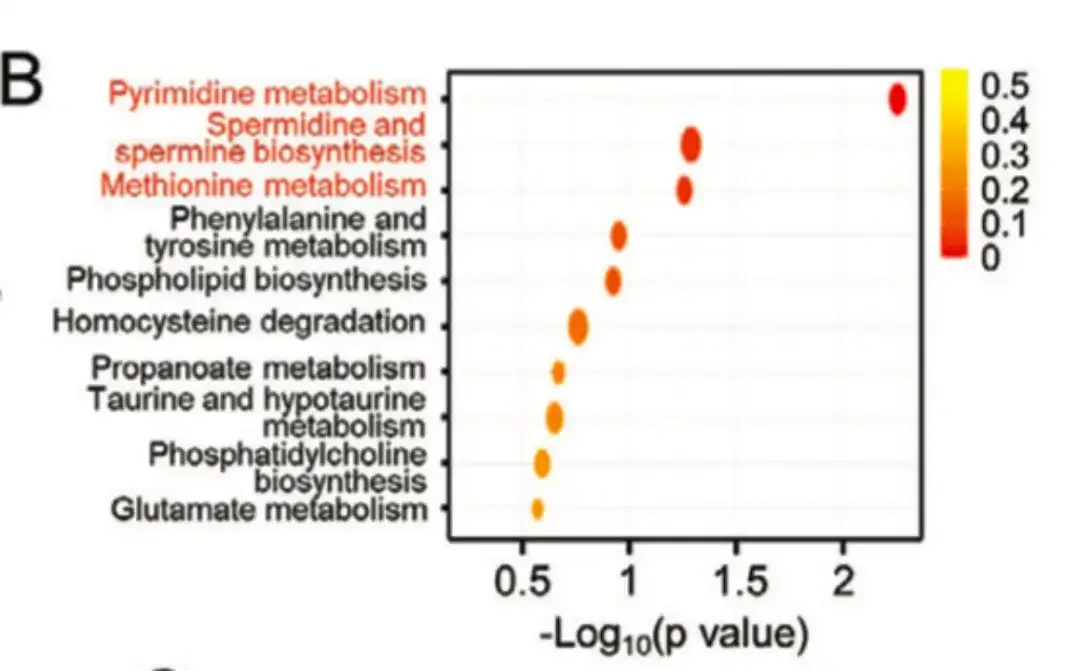
아래 그림 B에서 볼 수 있듯이, 이 연구는 대사 경로 농축 분석을 통해 폴리아민 동화 대사 관련 경로에서 농축 수준이 다른 대사산물이 형성된다는 것을 보여주었습니다.
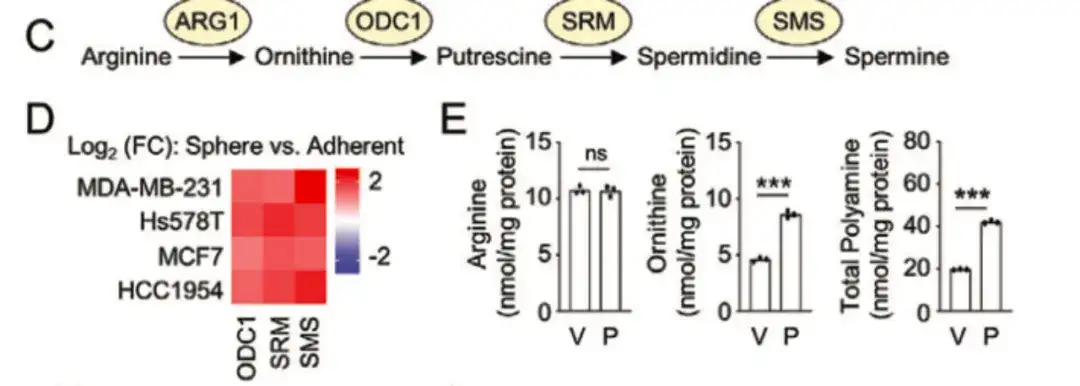
다음 그림 C, D에서,연구에 따르면 오르니틴 탈카르복실화효소 1(ODC1), 인간 스페르미딘 합성효소(SRM), 스페르민 합성효소(SMS)와 같은 폴리아민 생합성 경로의 핵심 효소가 BCSClow 그룹보다 BCSChigh 그룹에서 더 높게 발현되는 것으로 나타났습니다.그리고 비부착성 유방암 세포주에서 배양한 구형체 배양에서의 발현은 단층 배양에서의 발현보다 높았는데, 이는 폴리아민 생합성이 BCSC 표현형 조절에 중요한 역할을 한다는 것을 시사합니다. 한편, 아래 그림 E에서 볼 수 있듯이, 파클리탁셀 치료는 유방암 세포주에서 ODC1과 SRM의 발현을 증가시켰습니다.
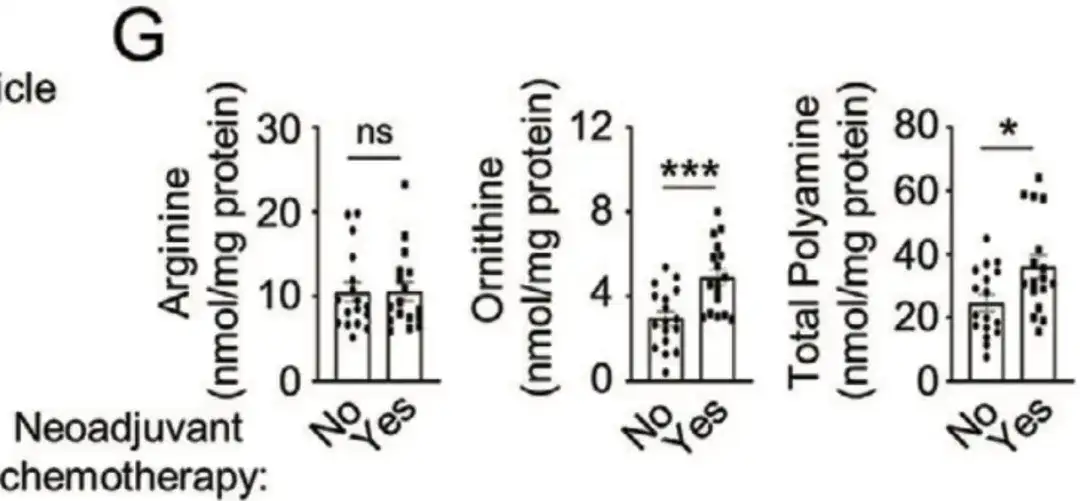
또한, 아래 그림 G에서,이 연구에서는 산둥대학 치루병원에서 감각이 둔화된 유방암 환자 34명의 샘플도 수집했습니다.세포 분석 결과, 신보조 화학요법을 받은 환자의 오르니틴과 폴리아민 수치가 상당히 높은 것으로 나타났습니다. 이러한 연구들은 모두 폴리아민 합성 증가가 화학요법으로 유도된 BCSC 풍부화를 촉진한다는 것을 보여줍니다.
화학 요법이 유방암에서 폴리아민 동화작용을 촉진하는 분자 메커니즘을 추가로 분석하기 위해 연구에서는 다음 사실을 발견했습니다.저산소 유도 인자(HIF-1α) 억제는 파클리탁셀을 매개로 한 ALDH+ 및 구형체 형성의 증가를 약화시켰습니다.아래 그림 AC에서 볼 수 있듯이, HIF-1은 파클리탁셀로 유도된 BCSC 농축을 조절하는 데 핵심적인 역할을 한다는 것을 나타내며, 대부분의 BCSC P-Sig 유전자의 발현을 감소시키고 대부분의 BCSC N-Sig 유전자의 발현을 증가시켰습니다.
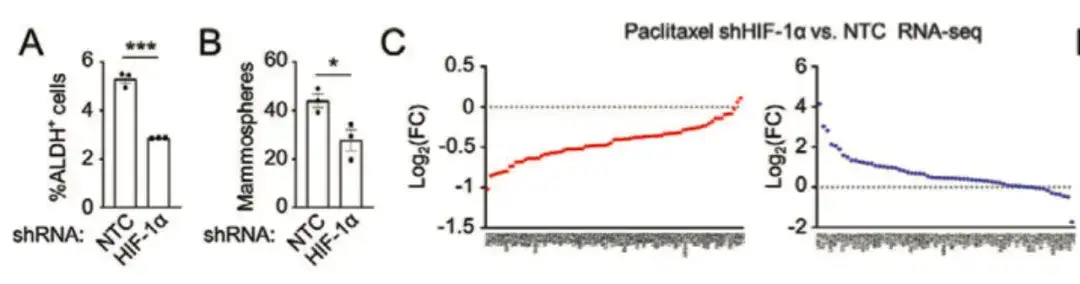
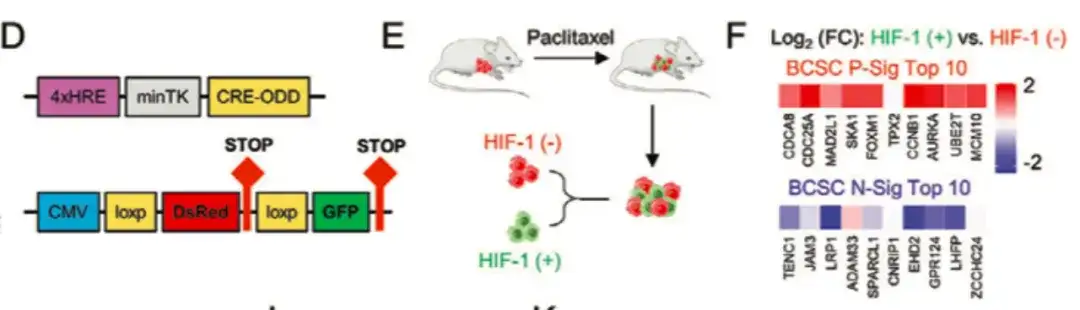
아래 그림 DG에 표시된 것처럼 BCSC 표현형을 조절하는 데 있어 HIF-1의 역할을 추가로 조사하기 위해 이 연구에서는 HIF-1 발현 형광 추적 시스템을 MDA-MB-231에 형질 전환시켰습니다. 파클리탁셀로 치료한 쥐의 종양 조직을 수집하여 세포를 DsRed+/GFP− (HIF-1−) 및 GFP+ (HIF-1+) 세포 집단으로 나누었습니다.DsRed+/GFP− 세포 집단과 비교했을 때, 높은 HIF-1 발현 및 전사 활성을 보이는 GFP+ 세포 집단은 BCSC P-Sig 유전자 발현이 증가하고 BCSC N-Sig 발현이 감소했습니다. 한편, GFP+ 세포의 종양 형성 능력은 무처리군이나 DsRed+/GFP− 세포보다 유의하게 높았습니다.
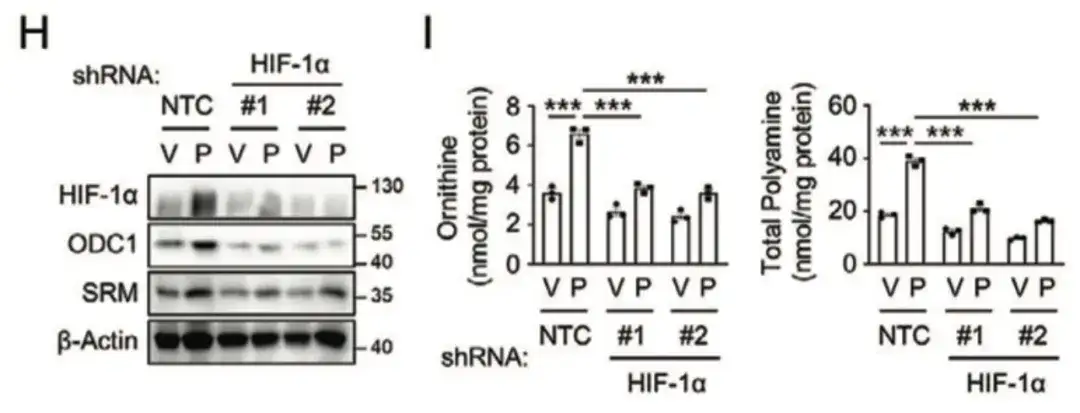
아래 그림 H와 I에서, 이 연구는 HIF-1α 억제가 파클리탁셀로 유도된 ODC1과 SRM 발현을 차단한다는 것을 발견했는데, 이는 파클리탁셀이 HIF-1 의존적 방식으로 폴리아민 동화작용을 촉진한다는 것을 나타냅니다.
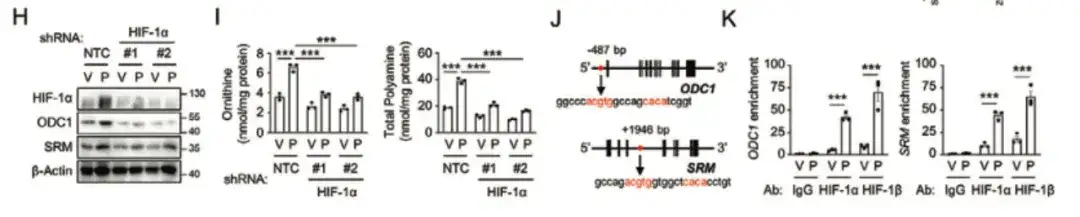
마지막으로, 이 연구에서는 HIF-1이 전사를 통해 ODC1과 SRM 유전자를 활성화하여 폴리아민의 동화작용을 촉진하고, 이로 인해 화학요법으로 유도된 BCSC가 풍부해지는 것을 발견했습니다(아래 그림 LQ 참조).

아래 그림 A에 표시된 것처럼, 이 연구에서는 HIF-1 전사 활동 리포터 시스템을 사용하여 SUM159 세포에 전달하고 4,320개의 천연 화합물을 포함하는 천연물 라이브러리에서 새로운 HIF-1 억제제를 선별했습니다. 연구 결과Inula aucheriana의 브리타닌은 복용량 의존적 방식으로 HIF-1의 전사 활동을 효과적으로 억제했습니다. 브리타닌과 파클리탁셀을 병용하면 파클리탁셀로 인한 세포 내 아르기닌과 폴리아민 수치의 증가를 용량 의존적으로 차단할 수 있습니다.아래 그림 BF와 같습니다.
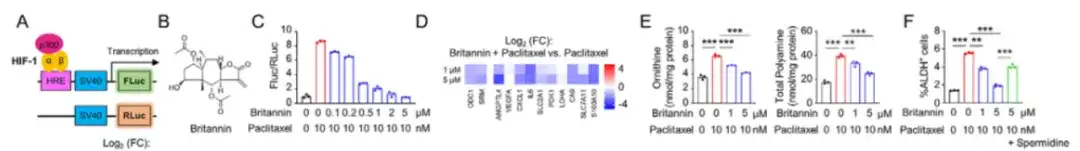
아래 그림 HK에서처럼, 브리타닌이 HIF-1 전사 활성을 억제하는 메커니즘을 조사하기 위해 이 연구에서는 MDA-MB-231 세포에 HIF-1 전사 활성 리포터 시스템을 공동으로 형질 전환시켰습니다.연구 결과에 따르면 브리타닌은 파클리탁셀로 유도된 HIF-1α TAD 활성 리포터 시스템을 용량 의존적 방식으로 약화시킬 수 있으며, 브리타닌은 전사 활성 인자 p300을 차단함으로써 HIF-1의 전사 활성을 억제할 수 있는 것으로 나타났습니다.
아래 그림 LQ에서, 연구에서는 SCID 마우스에 2×106 MDA-MB-231 세포를 주입하고 마우스를 파클리탁셀 단독 또는 브리타닌과 병용하여 치료했습니다. 연구 결과에 따르면, 복합 치료를 통해 생쥐의 모양과 무게에 영향을 주지 않고도 원발 종양의 성장을 상당히 억제할 수 있는 것으로 나타났습니다. 또한, 약물 치료를 중단한 지 100일 후에도 10마리 중 3마리의 쥐는 종양이 재발하지 않았습니다.이는 파클리탁셀과 브리타닌을 쥐에게 병용 치료하면 BCSC를 완전히 근절할 수 있음을 시사합니다.

AI는 병리학적 진단에 도움이 되며 HER2 표적 치료가 핵심이 될 수 있습니다.
오늘날 유방암 진단은 영상 결과에만 의존하는 것이 아니라, 병리학적 진단도 대체할 수 없는 역할을 합니다. HER2(인간 상피 성장 인자 수용체 2)의 발현 상태는 유방암 치료에 있어서 중요한 고려 사항입니다. AI는 병리학적 단면 분석에서 HER2의 발현 수준을 식별하는 데 도움을 줄 수 있으며, 이후 표적 치료에 대한 참고 자료를 제공할 수 있습니다.
원리는 간단해 보이지만, 실제로 구현하기는 쉽지 않습니다. 예를 들어, AI 기술을 활용해 유방암에서 HER2 해석의 정확도와 반복성을 높이기 위해서는 많은 훈련이 필요하며, AI 시스템은 지속적으로 디버깅을 거쳐 의료진의 진단 결과와 비교해야 합니다. 이를 바탕으로 연구진은 HER2 음성과 양성의 구별에 초점을 맞추고, AI를 HER2 발현의 하한에 집중시켜 다양한 이질성 HER2 저발현 유방암 진단에 있어 AI의 가치를 평가했습니다.
사실은,산둥대학교의 루이 하이취안 교수는 2022년 초 생물의학 저널인 Theranostics에 표지 논문을 발표하여 A2BR을 표적으로 삼고 화학요법과 병용하면 유방암 줄기세포의 증식을 막고 화학요법 후 유방암 환자의 생존율을 높일 수 있다는 사실을 밝혔습니다.
논문 링크:
https://www.thno.org/v12p2598.htm

이번에 루하이취안 교수는 브리타닌을 병용하면 HIF-1의 폴리아민 동화작용을 억제하고 BCSC를 근절할 수 있다는 것을 다시 한번 밝혀냈는데, 이는 의심할 여지 없이 유방암 치료에 새로운 아이디어를 제공했습니다.미래에 AI는 유방암 치료에 있어서 전례 없는 중요한 역할을 할 것이며, 의료 및 건강 분야에서의 응용은 점점 더 큰 잠재력을 보여주고 있습니다. 기술의 끊임없는 발전과 심층적 응용을 통해 AI는 유방암은 물론 암 치료에도 없어서는 안 될 파트너가 되어 환자에게 더 큰 힘과 희망을 가져다 줄 것입니다.