암세포의 증식을 억제할 수 있습니다! 후이후 약학대학과 천진의과대학이 공동으로 새로운 종양 억제 단백질 분해제 dp53m을 개발했습니다.

아마 많은 사람들이 모를 수도 있겠지만,사실, 우리 각자의 몸에는 암세포가 있습니다.인체는 매일 수십억, 심지어 수십억 개의 세포가 생성되고 교체됩니다. 이러한 대사 과정 중에 DNA 복제는 필연적으로 잘못될 수 있는데, 예를 들어 정상 세포를 그 자리에서 암세포로 바꾸는 유전자 돌연변이가 발생할 수 있습니다. 하지만,인체에는 몇몇 종양 억제 단백질이 존재합니다.p53과 같은 이러한 단백질은 세포 주기를 조절하고 암세포의 세포사멸 또는 노화를 유도함으로써 암 발생을 억제할 수 있습니다. 이는 우리 대부분이 암세포와 "평화롭게 공존"할 수 있는 중요한 이유이기도 합니다.
"게놈의 수호자"로 알려진 종양 억제 단백질 p53은 TP53 유전자에 의해 암호화되며 암 발생을 예방하는 데 중요한 역할을 합니다.그러나 TP53은 R175, G245, R248, R273 및 R282와 같은 몇 가지 일반적인 특정 핫스팟에서 미스센스 돌연변이를 겪을 수 있으며, 그 결과 p53 돌연변이가 발생하고 정상적인 종양 억제 단백질 기능이 상실됩니다. 또한 일부 p53 돌연변이체의 우성적 부정적 효과로 인해 돌연변이체 p53은 원래의 종양 억제 기능을 상실할 뿐만 아니라 정상 야생형 p53(p53-WT)의 종양 억제 활성을 방해하여 종양 발생 위험이 증가합니다.
다른 여러 p53 돌연변이와 비교했을 때,돌연변이 p53-R175H 단백질은 종양 형성, 전이 및 약물 내성의 가능성이 더 높습니다.p53-R175H를 표적으로 삼는 약물을 개발하고 표적 약물이 p53-R175H를 정확하게 식별하여 분해할 수 있도록 하는 것은 암 발생을 억제하는 효과적인 전략입니다. 그러나 대부분의 돌연변이 p53 단백질에는 소분자 약물 활성 부위가 없기 때문에 돌연변이 p53 단백질을 정확하게 인식하고 영향을 미칠 수 있는 표적 약물을 설계하는 것이 매우 어렵습니다.
이와 관련하여,시안교통리버풀대학교 후이후 약학대학 우시진 교수, 천진의대 종합병원 셰송보 교수, 종디안성 교수와 함께"p53-R175H 핫스팟 돌연변이로 인한 암의 정밀 치료를 위한 설계된 DNA 앱타머 기반 PROTAC"이라는 제목의 논문이 Elsevier에 게재되었습니다.
본 연구에서는 선택적인 p53-R175H 분해제인 dp53m을 개발했습니다.이 분해제는 돌연변이 p53-R175H 단백질을 특이적으로 인식하고 세포 내의 자연적인 단백질 분해 시스템인 유비퀴틴 프로테아제 시스템을 활용하여 표적 단백질의 표적 분해를 달성하고 돌연변이 p53 단백질의 기능적 발현을 억제합니다.
분해제는 상당한 항암 효능을 가지고 있으며 뚜렷한 독성 반응은 나타나지 않습니다. 또한 dp53m은 항암제인 시스플라틴과 시너지 효과를 발휘하여 암세포의 시스플라틴에 대한 민감도를 높이는 데 도움이 되며, 이는 암 치료에 매우 중요합니다.
연구 하이라이트:
- 연구진은 MD 시뮬레이션의 안내를 받아 비핵심 염기를 변형하고 반복적 분자 도킹 유도 포스트 SELEX 방법을 통해 RNA 앱타머를 DNA 앱타머(p53m-DA)로 유도했습니다.
- dp53m의 구성 요소인 p53m-DA는 p53-R175H 단백질을 특이적으로 인식할 수 있습니다. CRBN은 단백질 분해에 관여하므로 dp53m은 p53-R175H 단백질을 특이적으로 인식하고 분해할 수 있습니다.

서류 주소:
https://pubmed.ncbi.nlm.nih.gov/38811338
오픈소스 프로젝트인 "awesome-ai4s"는 100개가 넘는 AI4S 논문 해석을 모아 놓았으며, 방대한 데이터 세트와 도구도 제공합니다.
https://github.com/hyperai/awesome-ai4s
SELEX 엔지니어링 이후: 돌연변이 p53-R175H를 특이적으로 인식하는 고성능 DNA 앱타머 구축
연구자들은 p53에 대한 연구에서 R175H 돌연변이가 p53의 구조적 상태를 변화시켜 DNA 결합 기능에 영향을 미친다는 것을 발견했습니다. 다양한 억제제 소분자와 앱타머를 조합하면 p53-R175H의 활성을 부분적으로 회복시킬 수 있지만, 그 영향에 대한 분자적 메커니즘은 보고된 바가 없습니다.
이 연구에서는 분자 시뮬레이션 방법을 처음으로 사용하여 p53-R175H의 기능을 회복하는 앱타머의 내재적 분자 메커니즘을 탐구했습니다.정상 p53-WT와 비교했을 때, 돌연변이 p53-R175H에서는 L3와 C-나선의 거리가 가깝고, L2와 L3의 거리가 더 컸습니다. 이러한 위치에서의 구조적 변화는 p53-R175H 돌연변이가 전형적인 기능을 잃는 주된 이유일 수 있으며, 또한 해당 앱타머와 관련 PROTAC 분자의 특정 인식에 대한 구조적 기초를 제공합니다.
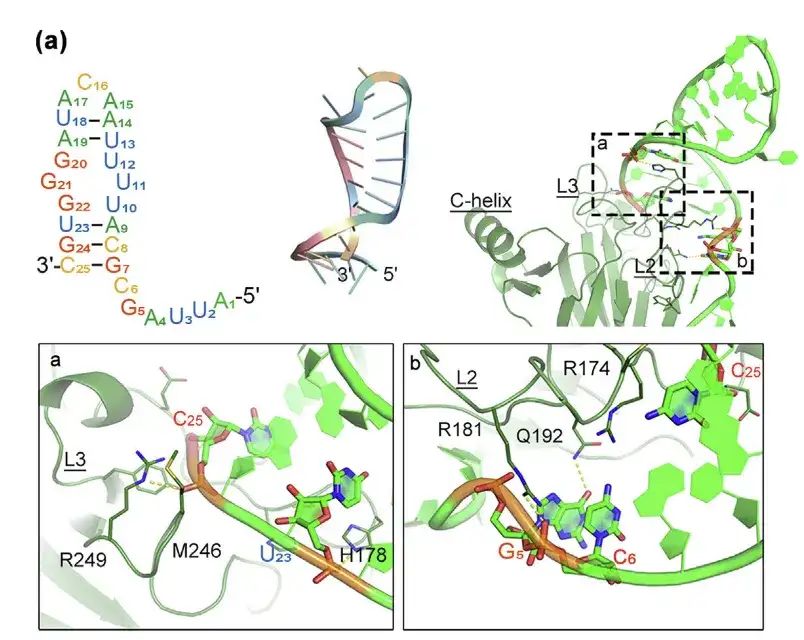
- 분자 모델링을 이용한 p53m-RA 구조 및 p53-R175H 단백질과의 상호작용 예측
- 결합 인터페이스는 영역 a와 b에 표시됩니다.
이전 연구에서는 p53-R175H(p53m-RA)를 표적으로 하는 RNA 앱타머가 p53-R175H에 대해 높은 친화성을 갖는 것으로 나타났지만, 혈청에서 매우 불안정하여 실제 적용에 제한이 있었습니다.
참고문헌:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9884801
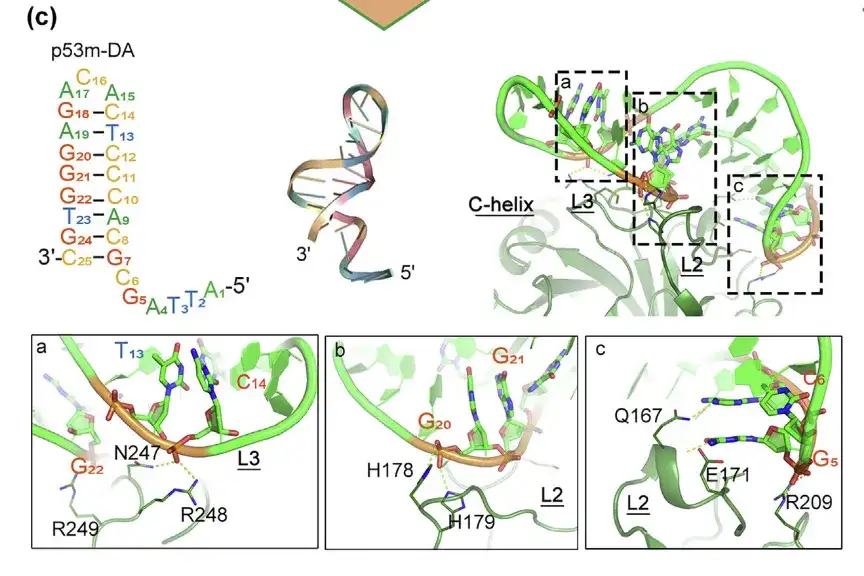
SELEX 이후 최적화된 p53m-DA 및 p53-R175H와의 상호 작용
결합 인터페이스는 a, b, c 영역에 있습니다.
연구진은 압타머의 구조적 안정성과 친화성을 높이기 위해 MD 시뮬레이션의 안내에 따라 비핵심 염기를 변형하고 SELEX 이후 과정을 통해 RNA 압타머를 DNA 압타머(p53m-DA)로 설계했습니다.
이 연구의 분자 시뮬레이션의 계산 능력은 다음과 같습니다. 오픈베이즈 공급
결과는 p53m-DA의 짝을 이룬 영역의 구조가 주요 홈이고, 짝을 이루지 않은 루프 영역은 부차 홈이라는 것을 보여주었습니다. 주요 홈은 L2의 H178, H179, E171 및 Q167과 결합하는 데 중요한 역할을 하며, 부차 홈은 L3의 N247, R248 및 R249와 상호 작용하는 데 중요한 역할을 합니다.또한, p53m-DA는 시뮬레이션 내내 이중 가닥 나선형 형태를 지속적으로 유지했으며, 이는 구조가 안정적임을 나타냅니다.
L2와 L3는 돌연변이 단백질에 존재하는 영역입니다.
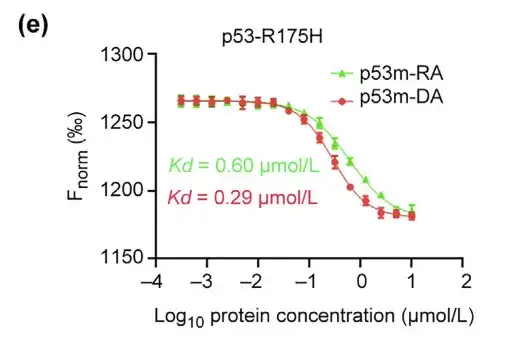
연구진은 p53-R175H에 대한 p53m-DA의 친화성과 선택성을 추가로 평가했습니다. MST 분석 결과, p53m-DA의 Kd는 0.29 lmol/L로 p53m-RA보다 약 2배 낮은 것으로 나타났습니다.
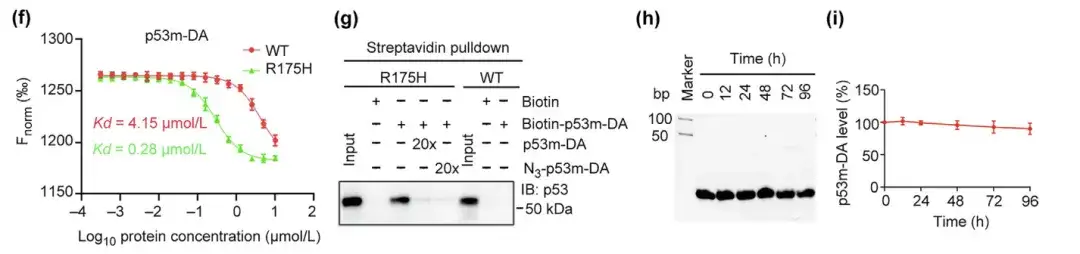
(f) p53-WT 및 p53-R175H에 대한 p53m-DA의 친화성
(g) 스트렙타비딘 풀다운 분석에 의한 p53m-DA의 p53-R175H에 대한 특정 결합
(h,i) p53m-DA의 혈청 안정성 평가 및 p53m-DA 잔류량 측정
게다가, 돌연변이 p53-R175H에 대한 p53m-DA의 친화도는 정상 p53-WT에 대한 친화도보다 14배 더 높았습니다. 스트렙타비딘 풀다운 분석에서 p53m-DA는 p53-R175H에 특이적으로 결합했지만 p53-WT와는 상호 작용하지 않았습니다. 이는 p53m-DA가 p53-R175H에 특이적임을 나타냅니다. 특히, p53m-DA의 혈청 안정성이 상당히 개선되었으며, 96시간 후에도 분해가 최소화되었습니다.
요약하자면,p53m-DA는 높은 특이성과 안정성을 갖춘 압타머입니다.
dp53m: 특정 p53-R175H 분해제
실험 1: DP53M 합성
앱타머 p53m-DA의 5' 말단은 p53-R175H와의 결합 부위 외부에 위치합니다. 연구진은 클릭 반응을 사용하여 알키닐 탈리도마이드(CRBN E3 리가제의 리간드)를 N3-p53m-DA의 5' 끝에 결합시켰습니다. 그 결과, 단백질 분해를 표적으로 하는 키메라 PROTAC(dp53m이라고 명명)은 p53-R175H에 선택적으로 결합할 수 있었습니다. dp53m 구조는 아래 그림과 같습니다.
*PROTAC : E3 리가제 리간드, POI를 표적으로 하는 리간드, 리간드 사이의 화학적 링커로 구성됨
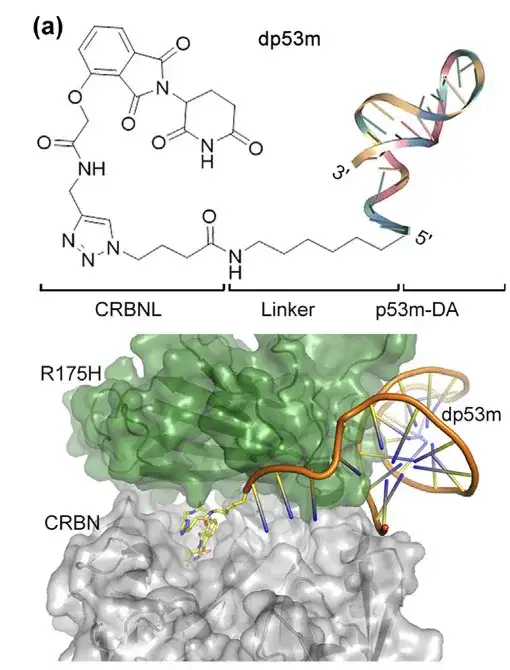
(a) dp53m의 구조는 단백질-단백질 도킹 및 분자 동역학 계산을 사용하여 시뮬레이션되었습니다.
하단: p53-R175H 및 CRBN과의 결합 인터페이스
실험 2: dp53m은 돌연변이 p53-R175H를 특이적으로 인식하고 분해할 수 있습니다.
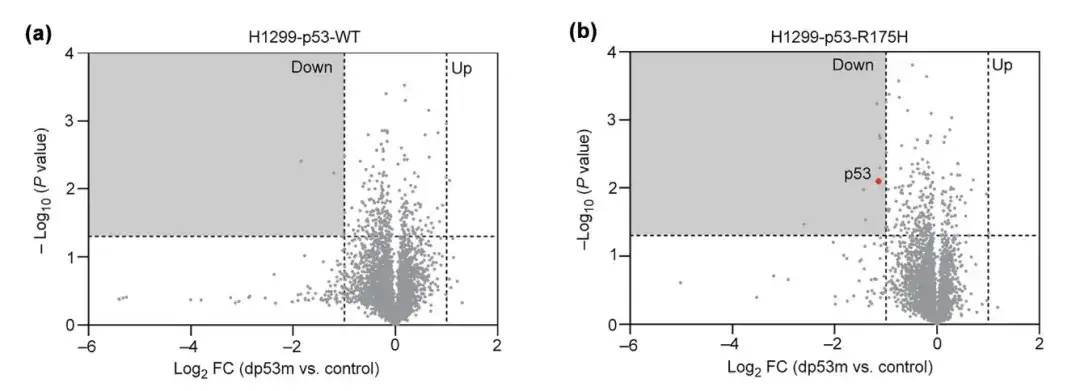
dp53m의 p53-R175H에 대한 세포 특이성을 조사하기 위해 H1299 세포에서 과발현된 p53-R175H와 p53-WT를 PBS 또는 dp53m으로 16시간 동안 처리하고 단백질 변화 수준을 모니터링했습니다. 결과는 dp53m이 p53-R175H를 상당히 분해하지만 p53-WT는 분해하지 않는다는 것을 보여주었습니다.
*PBS는 인산완충식염수이며 대조군으로 사용됩니다.
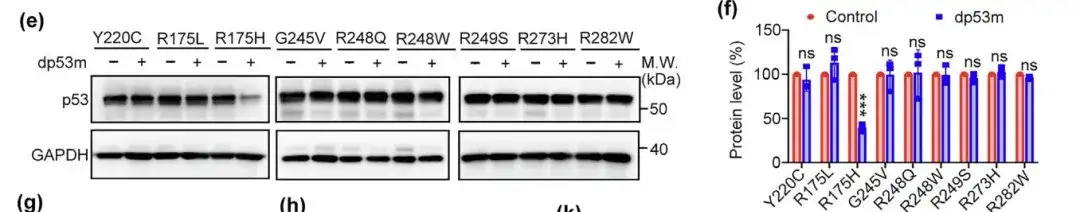
또한 연구진은 Y220C, R175L, G245V, R248Q, R248W, R249S, R273H 및 R282W와 같은 다른 핫스팟 돌연변이체에 대한 dp53m의 분해 잠재력도 평가했습니다. 결과는 dp53m이 p53-R175H만 효과적으로 분해한다는 것을 보여주었습니다.p53-R175H 분해에 대한 특이성이 입증되었습니다.
p53WT와 비교하여 dp53m 처리로 인해 p53-R175H의 폴리유비퀴틴화가 증가했습니다. 연구에 따르면 dp53m의 분해는 프로테아제 억제제 MG132, CRBN 리간드 또는 CRBN을 표적으로 하는 siRNA에 의해 차단될 수 있는 것으로 나타났습니다.dp53m에 의한 p53-R175H의 분해는 유비퀴틴-프로테아좀 메커니즘을 통해 일어나는 것으로 추정됩니다.
요약하자면,dp53m은 특정 p53-R175H 분해자이며, 분해 과정은 유비퀴틴-프로테아좀 메커니즘을 통해 발생합니다.
dp53m은 암세포의 증식과 이동, 종양 성장을 억제합니다.
실험 1: dp53m은 p53-R175H에 의해 유도된 암세포의 증식과 이동을 억제한다
연구진은 H1299-p53-WT, H1299-p53-R175H, A549, Detroit 562 및 SKBR3 세포를 각각 PBS, p53m-DA 또는 dp53m으로 처리하고 생존력 검정을 수행한 후 세포에서 집락 형성을 관찰했습니다.
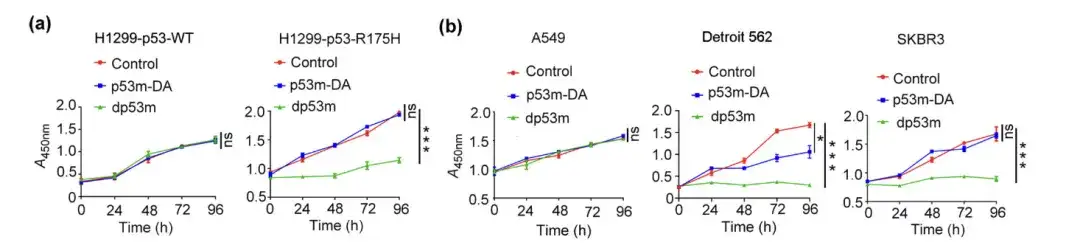
PBS, p53m-DA 또는 dp53m으로 처리한 H1299-p53-WT, H1299-p53-R175H, A549, Detroit 562 및 SKBR3 세포의 생존력 분석
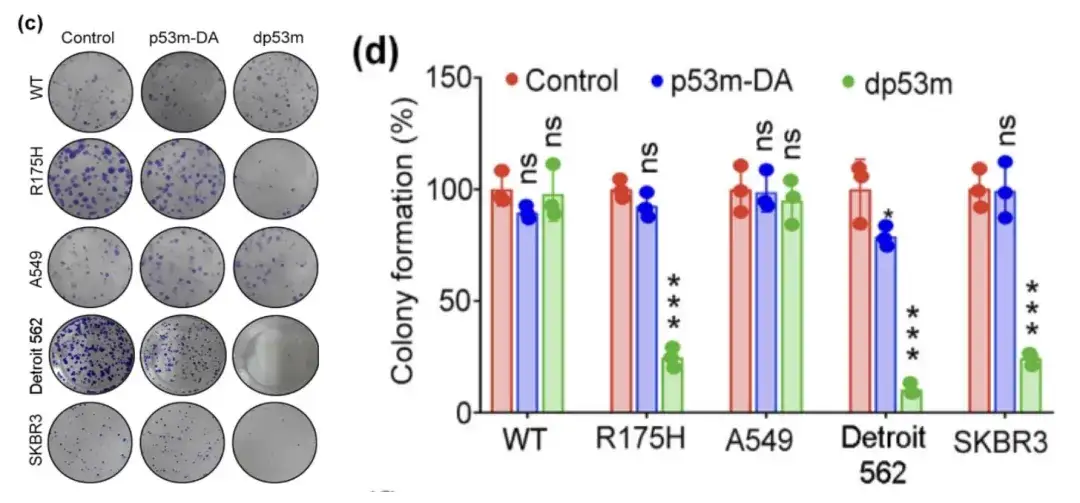
* dp53m은 H1299-p53-R175H, Detroit 562 및 SKBR3 세포에서 콜로니 형성을 억제합니다.
* H1299-p53-WT 및 A549 세포에서는 유의한 효과가 관찰되지 않았습니다.
위 그림은 dp53m이 p53-R175H(H1299-p53-R175H, Detroit 562 및 SKBR3)를 발현하는 암세포에서 상당한 증식 억제 효과를 나타내는 반면, p53-WT를 발현하는 세포는 기본적으로 영향을 받지 않는다는 것을 보여줍니다.이는 dp53m이 p53-R175H 돌연변이를 지닌 암세포에서 큰 치료적 잠재력을 가지고 있음을 시사합니다.
실험 2: dp53m은 생체 내에서 p53-R175H로 유도된 종양의 성장을 억제합니다.
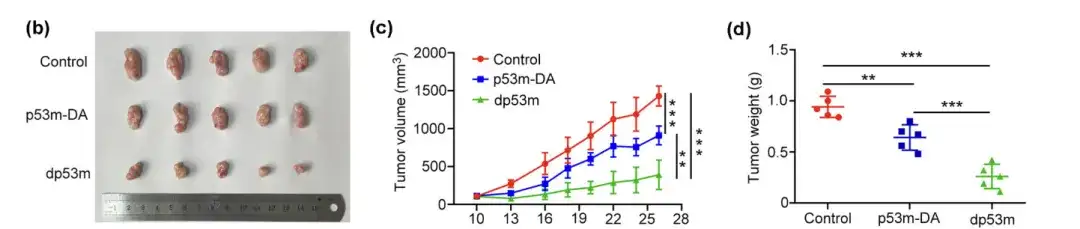
(b) 치료 후 분리된 종양의 거시적 모습
(c) 지정된 시간에 측정된 종양 부피
(d) 최종 종양 무게 결정
연구진은 종양이 있는 BALB/c 마우스를 무작위로 세 그룹으로 나누고 대조군으로 p53m-DA, dp53m 또는 식염수를 정맥 주사했습니다. 대조군이나 p53m-DA와 비교했을 때,dp53m은 종양 성장을 현저히 억제했습니다.
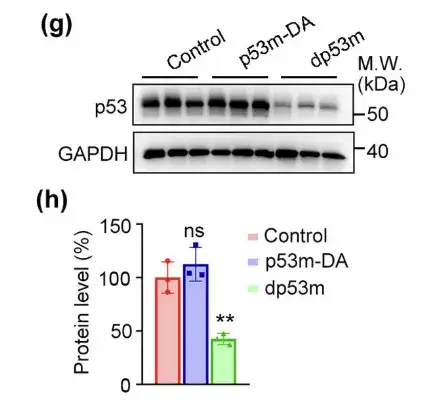
예상대로,dp53m은 종양에서 p53-R175H의 발현 수준을 효과적으로 감소시켰습니다.
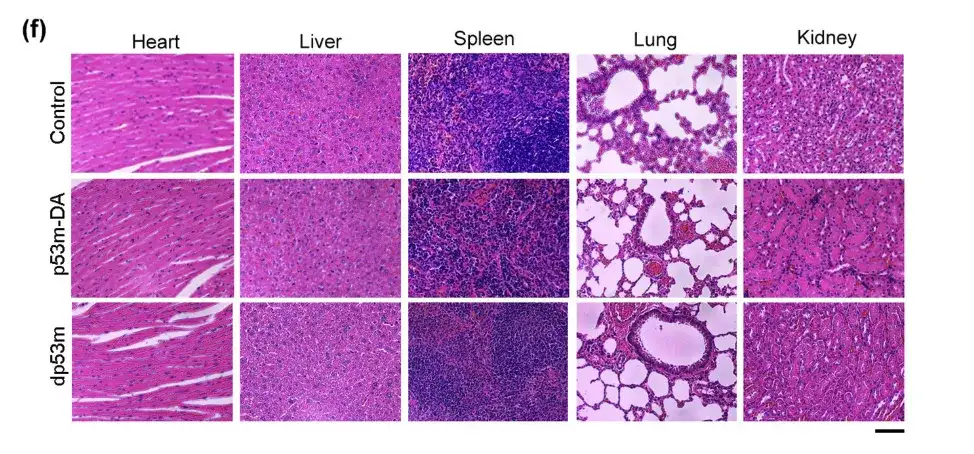
위 그림에서 세 그룹의 쥐 사이에서 심장, 간, 폐, 비장, 신장 조직의 조직학적 특징은 유의미한 차이가 없었습니다.이는 생체 내에서 dp53m으로 인한 독성이 없음을 시사합니다.
요약하자면,dp53m은 뚜렷한 독성 없이 p53-R175H로 유도된 종양의 성장을 억제할 수 있습니다.
또한, p53-R175H 돌연변이가 시스플라틴과 같은 항암제에 대한 저항성과 관련이 있다는 점을 고려하여, 연구진은 dp53m이 시스플라틴의 항종양 활성에 미치는 영향도 분석했습니다. 결과는 dp53m과 시스플라틴 사이에 강력한 상승적 상호작용이 있다는 것을 보여주었습니다.즉, dp53m은 p53-R175H 암세포의 시스플라틴에 대한 민감도를 높일 수 있습니다.이는 암 치료에 있어서 "무적의 파트너"를 제공합니다.
항암방어선 강화, 과학자들 함께 희망의 길 만든다
암은 통제되지 않는 세포 성장으로 인해 발생하는 질병입니다. 전 세계적으로 인구 고령화, 환경 오염 심화, 생활 습관의 변화로 인해 발병률이 크게 증가하고 있습니다. 국제암연구소(IARC)의 자료에 따르면, 전 세계적으로 새로운 암 발생 건수는 2020년 약 1,929만 건에서 2040년 약 3,023만 건으로 56.71% 증가할 것으로 추산됩니다.
연구자들은 암과의 세계적인 싸움에서 중요한 역할을 합니다. 이 연구에 참여한 3명의 저자는 다음과 같습니다.시안 교통 리버풀 대학 후이후 약학대학의 우시진 선생님, 톈진 의과대학 종합병원의 셰송보 교수, 종디안성 교수는 이 분야의 뛰어난 대표자입니다.
그 중에서도 우시진 교수는 새로운 표적 약물의 연구 개발에 주력하고 있습니다. 그의 현재 연구는 모델링, 약물구조 분석, 도킹 및 분자 동역학(MD)과 같은 시뮬레이션 방법을 사용하여 새로운 치료제를 찾기 위해 컴퓨터 지원 약물 설계 및 발견을 사용하는 데 중점을 두고 있습니다. 그는 2022년 연구에서 SOST 발현이 상향 조절되면 유방암 환자의 예후가 좋지 않고, SOST가 하류 신호 전달 경로를 활성화하여 유방암 세포의 증식과 뼈 전이를 촉진한다는 사실을 발견했습니다. 이 연구에서는 컴퓨터 스크리닝을 통해 SOST와 STAT3의 상호작용을 방해하여 STAT3 인산화를 억제하고 유방암 골 전이를 감소시킬 수 있는 후보 치료 화합물인 S6를 확인했습니다.
서류 주소:
https://pubmed.ncbi.nlm.nih.gov/36581888
또한, 주요 연구 방향이 표적 단백질 분해 및 약물 전달인 셰 송보 교수는 2023년 연구에서 앱타머를 "표적 탄두"로 사용하여 "약물 투여가 불가능한" 단백질의 분해를 유도하는 새로운 전략을 제안했습니다. 이 개념을 확인하기 위해 연구진은 발암성 뉴클레오린(NCL)을 표적으로 선택했고 결국 일련의 NCL 분해제를 만들어냈습니다. dNCL#T1은 유비퀴틴 프로테아제 시스템에 의존하는 방식으로 NCL 분해를 유도했으며, 이는 NCL로 인한 유방암 세포 증식을 억제할 수 있습니다. 이 연구는 단백질 분해에 대한 새로운 관점을 제공했을 뿐만 아니라, 암과 같은 질병에 대한 치료제 개발을 위한 튼튼한 기반을 마련했습니다.
서류 주소:
https://pubmed.ncbi.nlm.nih.gov/36608275
마지막으로 종디안성 교수는 폐암의 조기 진단, 항암 화학요법, 표적 치료, 항혈관신생 치료 분야에서도 심층적인 연구를 수행했으며, 90편 이상의 학술 논문을 발표했습니다. 그는 2024년 연구에서 CBX4가 PHGDH 발현과 세린 생합성을 상향 조절하여 폐선암(LUAD)의 증식을 촉진하는 동시에 ZEB2 전사를 억제하여 LUAD 전이를 억제한다는 것을 발견했습니다. 이번 연구 결과는 CBX4와 후성유전학적 요인 간의 상호작용을 이해하는 데 도움이 되며, LUAD에 대한 잠재적인 치료 접근 방식에 대한 통찰력을 제공합니다.
서류 주소:
https://www.nature.com/articles/s41419-024-06745-z
우시진 선생님, 셰송보 교수님, 종디안성 교수님 외에도 묵묵히 헌신하고 열심히 일하고 있는 과학자와 의사분들이 많이 계십니다. 과학과 기술이 계속 발전함에 따라 암이 더 이상 인류에게 악몽이 되지 않는 날이 오기를 기대합니다.