Command Palette
Search for a command to run...
3대 고형종양을 직접 공격하세요! 상하이 교통대, 암 생존 예측 정확도 향상 위한 딥러닝 시스템 출시

세계보건기구(WHO)가 2022년에 발표한 보고서에 따르면암과 같은 비전염성 질환(NCD)이 감염성 질환을 제치고 세계 1위의 사망 원인이 되었습니다.중국 국가암센터가 발표한 최신 데이터에 따르면, 2022년에 중국에서 약 482만 4700명의 신규 암 환자가 발생하고, 257만 4200명의 신규 암 사망자가 발생할 것으로 예상됩니다.
오랫동안 사람들은 암을 두려워해 왔습니다. 하지만 실제로 만성질환인 암의 1/3은 예방이 가능하고, 1/3은 조기발견, 조기진단, 조기치료를 통해 완치가 가능하며, 1/3은 불치병이지만 적절한 치료를 통해 삶의 질을 높이고 생존기간을 연장할 수 있습니다. 이 중 예방은 주로 자신의 면역력을 높이고, 정기적인 신체 검진을 통해 개인 건강에 주의를 기울이는 것을 포함합니다. 암이 진단된 후에는 예후 분석이 매우 중요합니다.
암 예후는 암 환자의 가능한 진행 과정과 결과를 예측하는 것을 말합니다. 예후 분석은 암 환자의 생존 가능성을 높이는 데 도움이 됩니다.과거 연구자들은 공간 전사체학(ST) 기술을 기반으로 공간적 유전자 발현의 관점에서 종양 미세환경(TME)을 특성화하여 암 환자의 다양한 예후 하위 그룹을 구별했습니다. 그러나 ST는 비용이 많이 들고 실험 기간이 길어서 대규모 암 환자 집단에서 생존 예측에 적용하기 어렵습니다. 이에 비해 조직학적 영상은 비용 효율적이고 임상 환경에서 쉽게 접근 가능하며 종양 형태에 대한 풍부한 정보를 제공할 수 있어 분자 수준의 TME 분석보다 더 나은 대안이 되며 더 정확한 암 예후를 가능하게 합니다.
최근 상하이 응용수학 국가센터(상하이 교통대학 분원)의 유장성(생명과학 및 기술대학/의대 임상연구센터) 연구팀, 왕위광(자연과학대학/수리과학대학) 연구팀 및 공동연구진이 Cell Reports Medicine에 "조직학적 이미지로 묘사된 TME를 활용하여 딥러닝 시스템을 통한 암 예후 개선"이라는 제목의 논문을 발표했습니다.본 연구에서는 조직병리학 영상을 통한 공간 전사체 데이터 없이도 암 환자의 종양 미세환경 정보를 예측할 수 있는 딥러닝 시스템을 개발하여 정확한 암 예후를 달성했습니다.
연구 하이라이트:
- ST 데이터가 없는 암 환자의 조직병리학적 이미지에서 TME 정보 예측
- IGI-DL로 특징지어진 TME는 암 생존 예측의 정확도를 향상시킵니다.
- 생물의학 병리학 이미지의 대규모 공공 데이터베이스에서 유전자 공간 발현 정보의 사용을 크게 확장합니다.

서류 주소:
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00205-2
공식 계정을 팔로우하고 "종양 미세환경"에 답글을 남겨 전체 PDF를 받으세요.
데이터 세트: 3가지 고형 종양 유형의 조직 샘플 평가
이 연구에서는 세 가지 다른 데이터 세트를 사용하여 세 가지 다른 고형 종양 유형(대장암(CRC), 유방암, 피부 편평세포암(cSCC))의 조직 샘플에 대한 모델의 성능을 평가했습니다.
대장암의 경우,연구진은 상하이 교통대학교 의과대학에 소속된 루이진 병원의 10명의 대장암 환자의 10개 ST 데이터 세트에서 41,492개의 포인트를 사용했고, 아래 표에서 볼 수 있듯이 10× Visium을 사용하여 1인 환자 제외 검증 세트로 시퀀싱했습니다.

유방암의 경우,연구진은 아래 표에 나타난 바와 같이 기존 ST 기술을 사용하여 시퀀싱한 27명의 환자로부터 채취한 92개 조직 샘플에서 34,678개 지점을 남겨두는 환자 검증 세트로 사용했습니다.

피부 편평세포암의 경우,연구진은 아래 표에 나타난 바와 같이 기존 ST 기술을 사용하여 시퀀싱한 4명의 환자의 조직 샘플 12개에서 4,353개 지점을 남겨둔 환자 검증 세트로 사용했습니다.

모델 아키텍처: 새로운 딥러닝 시스템으로 암 예후 개선
이 연구에서 연구진은 조직학적 이미지에 나타난 TME를 이용해 암 예후를 개선할 수 있는 딥러닝 시스템을 개발했습니다.
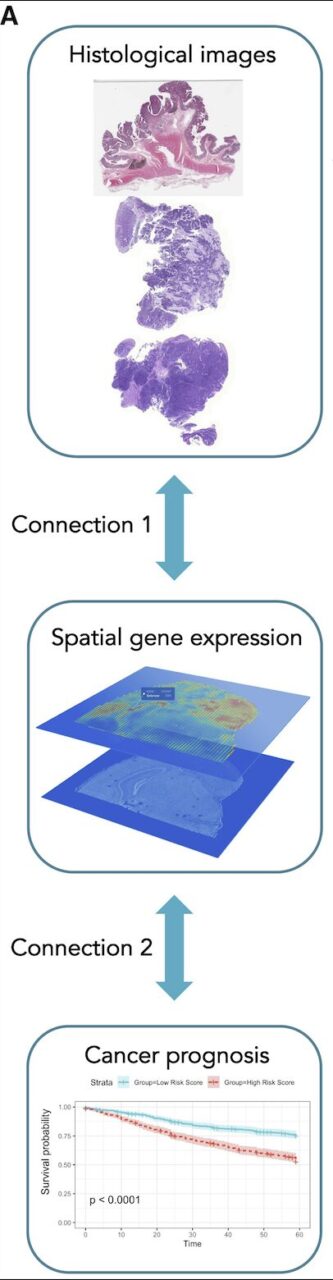
이 시스템은 두 부분으로 구성되어 있습니다.
첫 번째 부분(위 그림의 연결 1)은 합성 신경망과 그래프 신경망을 사용하여 H&E 염색된 조직학적 이미지를 유전자 발현 공간으로 투영하는 통합 그래프 및 이미지 딥 러닝(IGI-DL) 기반 모델입니다.
두 번째 부분(위 그림의 연결 2)에서 연구진은 슈퍼 패치 그래프와 IGI-DL을 사용하여 Cancer Genome Atlas(TCGA) 데이터 세트의 대장암 코호트와 유방암 코호트에서 노드 특징으로 예측된 공간적 유전자 발현을 사용하여 예후를 예측한 다음 외부 테스트 세트인 MCO-CRC(분자 및 세포 종양학 대장암)에서 이를 검증했습니다.
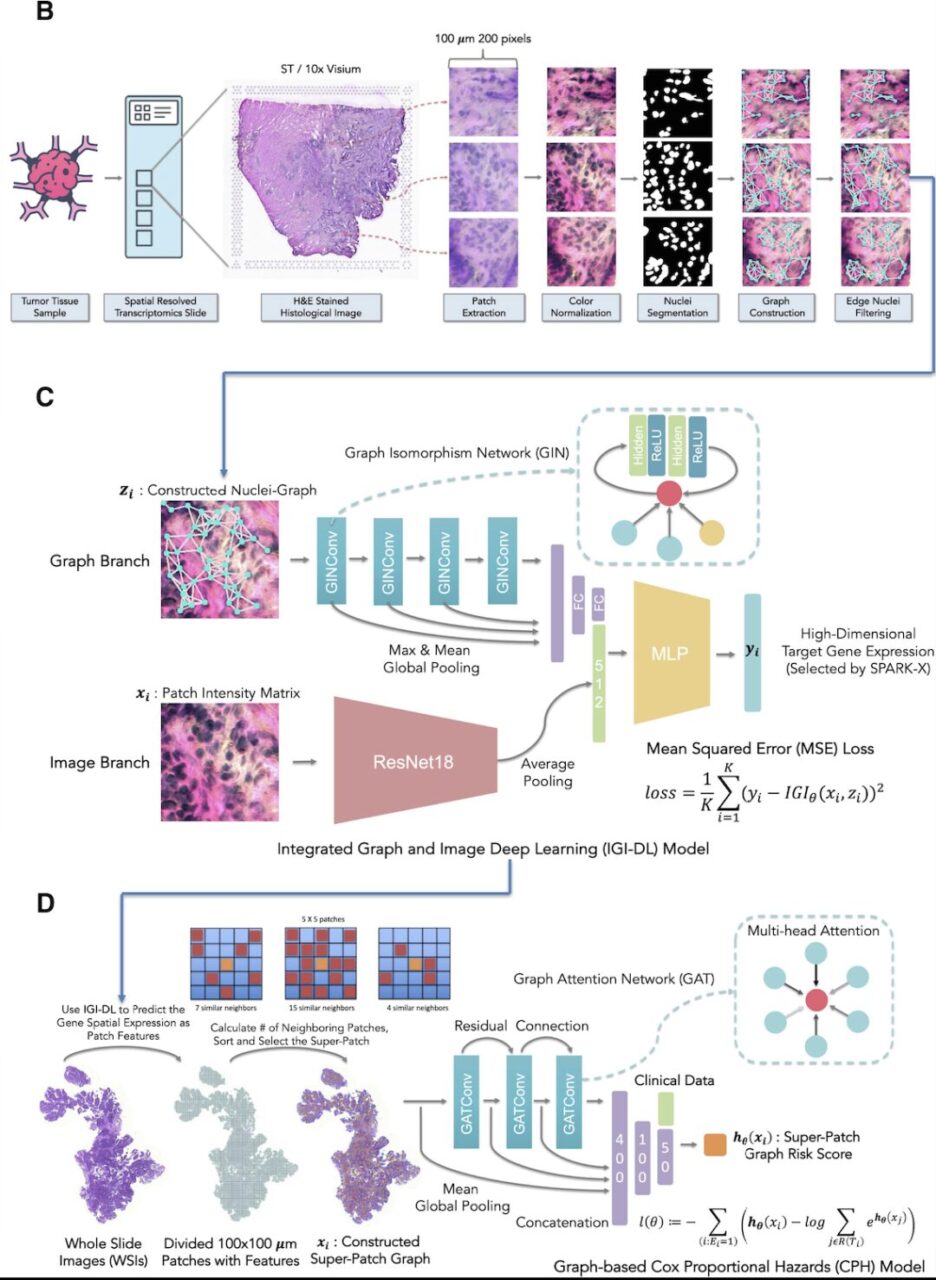
구체적으로, 이 시스템의 구축은 H&E 염색 조직학적 이미지 전처리, 공간적 유전자 발현 예측 모델, 예측을 기반으로 한 공간적 유전자 발현 슈퍼패치 그래프 생존 모델의 세 단계로 구성됩니다.
- H&E 염색 조직학적 이미지 전처리:먼저, H&E 염색된 조직학적 이미지를 각 지점의 좌표에 따라 0.5 μm/픽셀의 해상도로 200 × 200 픽셀의 여러 개의 겹치지 않는 패치로 분할했습니다.
- 공간 유전자 발현 예측 모델:연구진은 각 패치에 대해 핵 그래프를 구축했습니다. 여기서 Hover-Net24로 분할된 각 핵은 노드로 표시되고, 각 핵 쌍 사이의 거리는 에지 연결이 있는지 여부를 결정합니다. 연구진은 위 그림 C에 표시된 아키텍처를 기반으로 IGI-DL 모델을 사용하여 조직학 이미지의 각 지점에서 표적 유전자의 발현을 예측했습니다.
- 예측된 공간 유전자 발현을 기반으로 한 슈퍼 패치 그래프 생존 모델:연구진은 공간적 유전자 발현에 따른 TME를 기반으로 예후를 더욱 예측하기 위해 각 암 환자의 H&E 염색 전체 슬라이드 영상(WSI)에서 슈퍼 패치 그래프를 구축한 다음, 구축된 슈퍼 패치 그래프와 임상적 특성을 입력으로 사용하여 그래프 기반 생존 예측 모델을 구축했습니다.
연구 결과: IGI-DL 모델은 전반적으로 우수한 성능을 보였습니다.
전반적으로, 본 연구에서 구축한 IGI-DL 모델은 합성 신경망과 그래프 신경망의 장점을 통합하여 조직병리학적 이미지의 픽셀 강도와 구조적 특징을 최대한 활용하여 유전자 공간 발현 수준을 보다 정확하게 예측합니다.이 모델은 대장암, 유방암, 피부 편평세포암의 세 가지 유형의 고형 종양에서 좋은 성과를 보였으며, 기존 방법 5가지와 비교했을 때 평균 상관계수가 0.171 향상되었습니다.

대장암의 경우, 연구진은 IGI-DL이 예측한 179개 유전자의 피어슨 상관관계를 5가지 SOTA 모델과 비교했습니다.IGI-DL은 10명의 유지 환자에서 평균 피어슨 상관관계 0.343을 달성하여 평균 증가율 0.233으로 다른 모델보다 상당히 우수한 성과를 보였습니다.위의 그림과 같이.

유방암의 경우, 연구진은 IGI-DL이 예측한 187개 유전자의 피어슨 상관관계를 이전 모델과 비교했으며, IGI-DL은 27명의 유지 환자에서 평균 상관관계 0.231을 달성했습니다. 위 그림과 같이,IGI-DL 모델은 평균 0.142의 개선으로 모든 SOTA 모델보다 우수한 성과를 보였습니다.

피부 편평세포 암종의 경우, 연구진은 IGI-DL이 예측한 487개 유전자의 피어슨 상관관계를 이전 모델과 비교했습니다. IGI-DL은 유지된 환자 4명에서 평균 상관관계 0.198을 달성했는데, 이는 모든 모델 중에서 가장 좋은 성과였습니다.다른 SOTA 모델의 평균 성능은 0.131만큼 향상되었습니다.위의 그림과 같이.
위의 실험과 마찬가지로 플랫폼 간 및 암 간 성능 측면에서 최상의 SOTA 모델은 다양한 암 유형의 내부 검증 및 외부 테스트 세트에 대해 고정되어 있지 않습니다.그러나 IGI-DL 모델의 성능은 항상 다른 모델보다 우수하며, 평균 0.171의 개선을 보여 플랫폼 간 일반화 능력이 우수함을 보여줍니다.
또한 연구진은 IGI-DL의 교차 암 예측 성능을 조사했으며, 대장암을 기반으로 학습된 모델은 피부 편평 세포 암의 내부 검증 세트와 외부 테스트 세트에서 각각 0.204와 0.143의 평균 상관관계를 보이며 좋은 성과를 보였습니다. 그러나 대부분의 교차 암 예측 성능은 단일 암 유형에 대해 훈련하고 테스트했을 때보다 낮았습니다.이 결과는 종양 영역의 공간적 유전자 발현이 특정 암 특이성을 가지고 있으며, 교차 암 예측에는 본질적인 어려움이 있음을 시사합니다.

예후 예측 성능과 관련하여, 암 게놈 아틀라스 유방암(TCGA-BRCA) 코호트에서 공간 유전자 발현을 노드 특징으로 하는 슈퍼 패치 그래프 생존 모델은 5배 교차 검증에서 0.747의 평균 일관성 지수(C-지수)를 달성할 수 있습니다. TCGA-CRC(암 게놈 아틀라스 대장암) 코호트에서 생존 모델은 5배 교차 검증에서 C-지수가 0.725로, 위 그림에서 볼 수 있듯이 다른 예후 모델보다 우수합니다.
이 생존 예후 모델은 초기 환자(1기 및 2기)의 예후를 예측하는 데에도 정확도가 우수하며, 예측된 위험 점수는 모든 단계의 환자와 초기 환자를 위한 독립적인 예후 지표로 사용될 수 있습니다. 1,000명 이상의 환자 데이터를 포함하는 외부 테스트 세트 MCO-CRC에서 생존 예후 모델은 안정적인 이점을 유지했으며 일반화 능력이 있었습니다.
유방암과 췌장암이 먼저: AI를 활용해 예후 개선
암 진단 및 치료 과정에서 암 예후 분석을 통해 과도한 치료와 의료 자원의 낭비를 효과적으로 방지하고, 의료진과 그 가족이 의학적 결정을 내리는 데 과학적 근거를 제공할 수 있습니다. 이는 최근 몇 년 동안 암 연구에서 뜨거운 주제가 되었습니다.
유방암 결과를 개선하기 위해 2020년 Salesforce 연구원들은 University of Southern California의 Lawrence J. Ellison Institute의 임상의들과 협력했습니다.머신러닝 시스템 ReceptorNet 출시이 알고리즘은 저렴하고 쉽게 접근 가능한 조직 이미지를 통해 호르몬 수용체 상태를 예측할 수 있습니다. 이는 임상의가 유방암 환자에게 적절한 치료 방향을 결정할 때 중요한 바이오마커입니다. 시스템의 정확도는 92%에 도달했습니다.

2024년 2월, 켄터키 대학교, 마카오 과학기술대학교, 마카오 대학교 및 광저우 의과대학 제1 부속병원의 연구원들은 신경망 모델을 사용하여정확한 예후 평가 시스템인 MIRS(전이 및 면역유전학적 위험 점수)가 확립되었습니다.종양 전이 및 면역 유전체 위험 점수는 유방암 환자에게 거의 보편적으로 적용 가능한 예측 도구를 제공하며 유방암 환자를 위한 치료 옵션에 대한 새로운 방향을 제시합니다. (자세한 보고서는 여기를 클릭하세요: 세계에서 가장 흔한 암을 목표로 중국 학자들이 유방암 예후 점수 시스템 MIRS를 구축했습니다)
또한 췌장암은 소화관에서 발생하는 악성 종양 중 가장 흔한 암으로, 진단 후 5년 생존율은 10%에 불과합니다. 환자 생존율을 높이는 데 있어 중요한 단계는 환자의 예후 위험을 정확하게 예측하여 목표 지향적인 치료 계획을 설계하는 것입니다. 조직병리학은 종양의 특성을 미세한 수준에서 분석할 수 있는 종양학의 일상적인 검사이며 종양 진행 위험을 평가하는 중요한 방법입니다. 그러나 슬라이스의 크기가 크고 조직 구성이 복잡하기 때문에 평가 결과는 주관적인 요소에 의해 쉽게 영향을 받습니다.

2023년, 난징정보과학기술대학과 인공지능학원 스마트헬스케어연구소 연구팀은"다중 작업 및 주의 기반 췌장암 전체 슬라이스 이미지에 대한 다중 조직 분할 모델"이라는 제목의 연구 논문을 발표했습니다.췌장암 병리학적 단면의 8가지 범주에 대한 조직 분할이 연구되었습니다. 주의 메커니즘을 도입하고 계층적이고 공유된 다중 작업 구조를 설계함으로써 관련 보조 작업을 사용하여 모델 성능이 크게 향상되었습니다.
본 연구에서 제안한 모델은 상하이 창하이 병원의 데이터세트를 이용하여 학습 및 테스트를 거쳤으며, TCGA 공개 데이터세트를 이용하여 외부 검증을 거쳤습니다. 내부 테스트 세트의 F1 점수는 0.97보다 높았고, 외부 검증 세트의 F1 점수는 0.92보다 높았습니다. 일반화 성능은 기준선 방법보다 상당히 우수했습니다.
AI가 병리학 전문가를 대체할 수는 없지만, 병리 진단의 편의성을 높이고 병리학자의 업무 효율성을 더욱 개선하기 위한 보조 진단 기술로 활용된다는 점을 강조할 필요가 있습니다. 장기적인 관점에서 볼 때 AI는 디지털 바이오마커 감지, 의료 영상 분석, 질병 경과 예측 등 여러 분야에서 여전히 발전할 여지가 많습니다.
참고문헌:
1.https://news.un.org/zh/story/2018/09/1017602
2.https://mp.weixin.qq.com/s/VE68FKL6kwpO1IFsbR-LVA
3.https://ins.sjtu.edu.cn/articles/286
4.https://www.cdstm.cn/theme/khsj/khzx/khcb/202012/t20201214_1039028.html