Command Palette
Search for a command to run...
세포 노화를 예방하고 노화 관련 질병을 예방하기 위해 에든버러 대학은 세포 노화를 예방하는 3가지 "AI 노화 방지 처방"을 발표했습니다.
내용을 한눈에 보기:연구에 따르면 세포 노화는 암, 2형 당뇨병, 골관절염, 바이러스 감염 등의 질병과 밀접한 관련이 있는 것으로 나타났습니다. 노화 세포를 제거하는 약물이 점차 연구 개발의 주요 분야가 되고 있습니다. 그러나 잘 규명된 분자 표적이 부족하기 때문에 노화 방지 화합물(세놀리틱스)은 거의 발견되지 않았습니다. 최근 국제 학술지인 Nature Communications에 연구 결과가 게재되었는데, 연구자들은 세 가지 새로운 유형의 세놀리틱스를 발견했습니다.
키워드:Senolytics 머신러닝 XGBoost
본 기사는 HyperAI WeChat 공개 플랫폼에 처음 게재되었습니다~
고대부터 사람들은 불로불사를 추구해 왔습니다. 놀라운 점은 최근 들어 노화 방지, 장수와 같은 주제가 신비롭고 환상적이었던 건강제품의 세계에서 대중이 인정하는 의학 및 건강의 세계로 옮겨가고 있다는 것입니다. 일반적으로 노화는 신체 기능이 천천히 약해지는 과정이라고 믿어진다. 이 과정은 되돌릴 수 없으므로 인간은 자연의 흐름에 맡기고 모든 것을 운명에 맡길 수밖에 없습니다. 그러나 많은 사람들이 이해하지 못하는 것은세계보건기구는 이미 2018년에 노화를 국제질병규약에서 치료 가능한 질병으로 선언했습니다.
노화의 광범위한 정의 내에서 세포 노화는 최근 과학자들의 뜨거운 연구 방향 중 하나입니다. 세포 노화는 세포 분열이 중단되는 현상을 특징으로 합니다.일반적으로 인간의 면역 체계는 노화된 세포를 효과적으로 제거할 수 있지만, 나이가 들면서 이 제거 기능이 점차 약해집니다. 시력이 악화되고 운동 능력이 제한되는 것 외에도 암, 알츠하이머병 및 기타 질병을 일으킬 가능성이 매우 높습니다.
2015년, 메이요 클리닉의 제임스 L. 커클랜드 박사와 다른 연구자들은 노화 세포를 제거할 수 있는 최초의 노화 방지 약물(세놀리틱스)을 발견했습니다.세놀리틱스는 노화 세포 사멸을 선택적으로 유도하는 소분자 화합물을 말합니다. 그 이름은 노화를 뜻하는 Senescence와 파괴를 뜻하는 Lytic에서 유래되었습니다.최신 연구에서 에든버러 대학과 칸타브리아 대학은 머신 러닝을 사용하여 세놀리틱스인 깅케틴, 페리플로신, 올레안드린을 발견하고 인간 세포주에서 노화 방지 효과를 검증했습니다.해당 연구는 "머신 러닝을 활용한 세놀리틱스 발견"이라는 제목으로 Nature Communications 저널에 게재되었습니다.

그림 1: 본 연구 결과는 Nature Communications에 게재되었습니다.
서류 주소:
https://www.nature.com/articles/s41467-023-39120-1#Sec2
실험 절차
데이터세트
실험적 데이터 세트는 학술 출판물과 상업 특허를 포함한 다양한 채널에서 나옵니다.먼저, 연구진은 알려진 세놀리틱스 58개를 추출한 다음, 기존의 두 화학 라이브러리인 LOPAC-1280과 프레스윅 FDA 승인-1280에서 다양한 비세놀리틱스를 추출했습니다. 해당 데이터 세트는 두 가지를 결합한 것입니다.총 2,523개의 화합물이 포함되었으며, 그 중 Senolytics는 2.3%를 차지했습니다.

그림 2: 머신 러닝 모델을 훈련하는 데 사용되는 화합물
에이:훈련 데이터는 다양한 출처에서 나옵니다.
비:훈련에 사용된 58가지 세놀리틱스 공급원과 각 공급원의 화합물 및 세포주 수를 포함합니다.
모델 학습
연구자들은 위의 데이터 세트를 사용하여 Senolytics(긍정적) 특성을 가진 화합물을 식별하는 모델을 훈련했습니다. 먼저, 연구자들은 데이터 세트에 대한 특징 선택을 수행했습니다.이 과정에서 그들은 랜덤 포레스트(RF) 모델을 사용하여 각 특징의 평균 지니 지수 감소를 계산하고 가장 중요한 165개 특징을 선택하여 특징 수와 모델의 복잡성을 줄였습니다.
- 지니 지수는 노드 내 샘플의 혼란 정도를 측정합니다. 값이 낮을수록 노드의 샘플이 더 순수해집니다.
두 번째로, 연구진은 전체 데이터 세트에서 가장 중요한 165개 특징과 다양한 샘플 데이터를 사용하여 여러 가지 세놀리틱 이진 분류 모델(세놀리틱 또는 비세놀리틱을 식별)을 개발했습니다.모델을 비교하고 제한된 수의 Senolytics 샘플을 최대한 활용하기 위해 연구진은 데이터 세트에 대해 5겹 교차 검증을 수행하고 정밀도, 재현율, F1 점수라는 세 가지 성능 지표를 사용하여 모델의 점수를 매겼습니다.
초기에 연구자들은 SVM(지원 벡터 머신)과 RF 모델에 초점을 맞추었지만, 실험 결과 그 성능이 만족스럽지 않다는 것이 드러났습니다.그들은 또한 로지스틱 회귀 분석기, 나이브 베이즈 분류기, SMOTE를 포함하여 다양한 복잡도의 다른 모델을 평가했지만, 결과는 이러한 모델의 성능이 SVM 및 RF 모델만큼 좋지 않다는 것을 보여주었습니다.
따라서 연구진은 RF 성능을 기반으로 XGBoost 모델을 개발했습니다.의사결정 트리 모델을 반복적으로 훈련하여 예측 능력을 향상시킵니다.그림 3b에서 볼 수 있듯이 XGBoost 모델은 정밀도, 재현율, F1 점수가 향상되었으며, 고려된 모든 모델 중에서 가장 좋은 성능을 보였습니다.
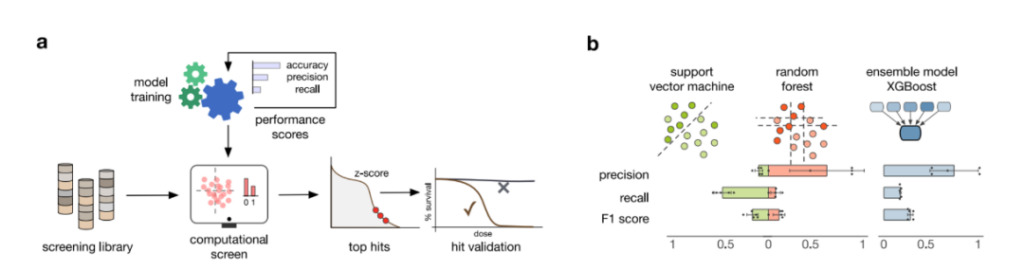
그림 3: 머신 러닝 모델 학습
에이:다양한 성과 지표를 사용하여 적합한 모델을 선별하고, 모델 학습, 화합물 선별 및 결과 검증 프로세스를 거칩니다.
비:3개의 머신러닝 모델의 성능. 막대형 차트는 5겹 교차 검증에서 계산된 평균 성능 지표를 보여줍니다. 오차 막대는 1표준편차를 나타냅니다.
이 실험적 데이터 세트의 주소는 나중에 HyperAI 공식 웹사이트와 동기화될 예정입니다.
https://doi.org/10.5281/zenodo.7870357
실험 결과
먼저, 연구진은 4,340개가 넘는 화합물을 검토하여 잠재적으로 노화 방지 활성이 있는 21가지 화합물을 찾아냈습니다. 그런 다음 그들은 이 21가지 화합물을 테스트했습니다.그림 4에서 볼 수 있듯이, 그중 세 가지는 노화 세포를 제거하는 효과가 있습니다. 페리플로신과 올레안드린(노화 세포를 제거할 수 있는지 아직 확인되지 않은 두 가지 심장 배당체)과 깅케틴(천연 무독성 비플라보노이드 화합물)입니다.
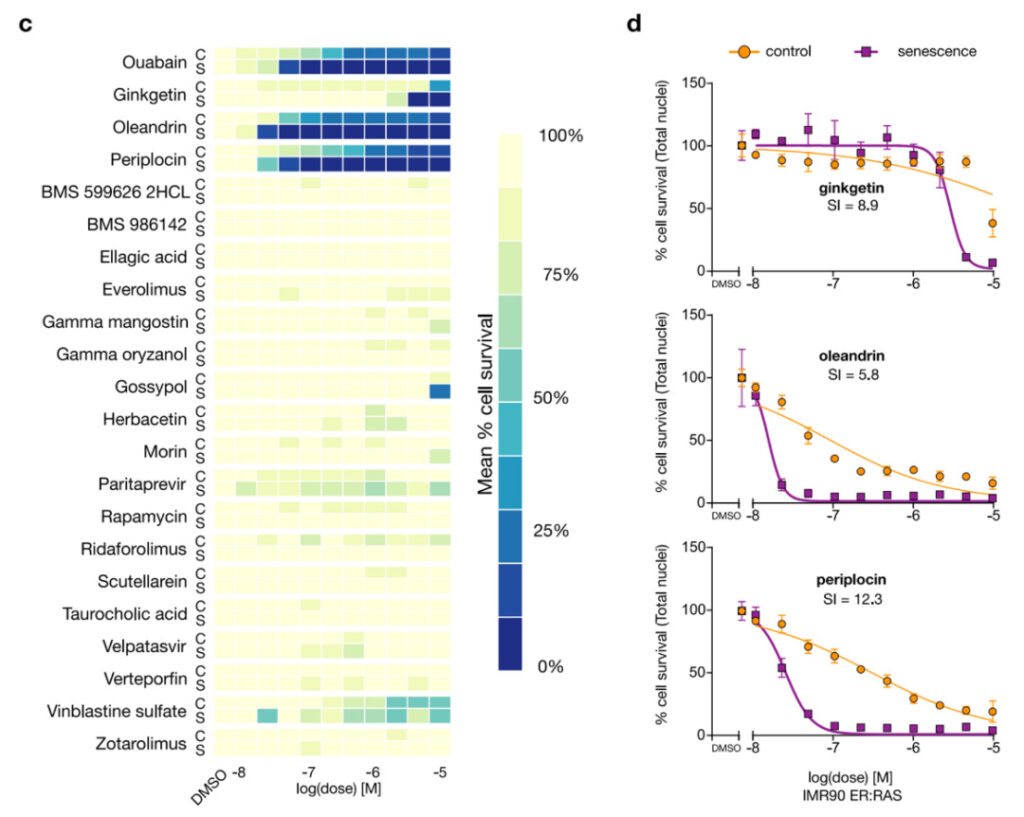
그림 4: 페리플로신, 올레안드린 및 깅케틴 노화세포를 정화하는 효과가 있습니다
기음:실험적 검증. 21가지 화합물 중 3가지, 즉 은행잎 추출물, 올레안드린, 페리플로신이 노화 방지 활성을 보였습니다. 열 지도는 n = 3 반복의 평균을 보여줍니다. 그림에서, 우아바인은 잘 알려진 세놀리틱스입니다.
디:새롭게 발견된 3가지 노화 방지 화합물의 용량-반응 곡선. SI는 노화방지지수입니다.
또한, 상기 실험 동안,연구자들은 또한 새롭게 발견된 올레안드린이 특히 낮은 농도에서 우아바인보다 노화 방지 효과가 더 강하다는 것을 발견했습니다.따라서 연구진은 10nM의 낮은 농도에서 페리플로신, 올레안드린, 우아바인의 노화 방지 활동을 비교했습니다.
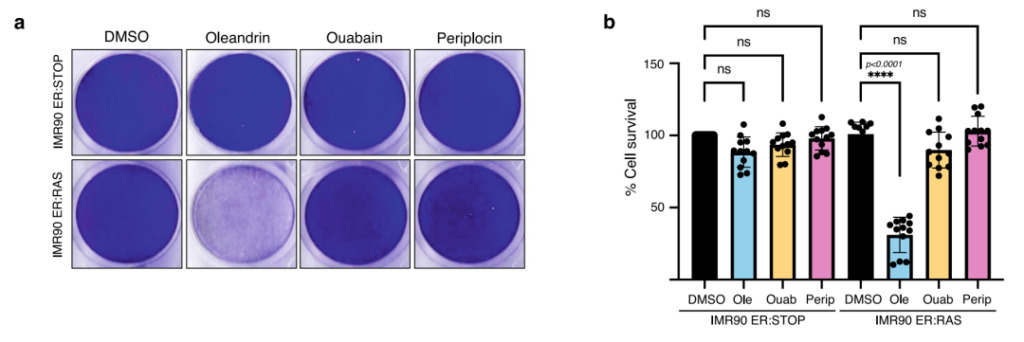
그림 5: 페리플로신, 올레안드린 및 페리플로신 저농도에서의 노화방지 성능 비교
에이:그림은 100 nM 4OHT가 존재하는 환경에서 배양된 IMR90 ER:RAS(노화 세포)와 IMR90 ER:STOP(대조군)의 조직 배양 접시를 보여줍니다. 다음 72시간 동안 세포는 10 nM 올레안드린, 우아바인, 페리플로신 및 DMSO(대조군)로 처리되었습니다.
비:세포 생존율은 정량 분석을 통해 평가되었습니다.
그림 5b에서 볼 수 있듯이, 낮은 농도의 와바인과 페리플로신은 IMR90-ER:STOP과 IMR90-ER:RAS에서 유의미한 세포독성을 나타내지 않았습니다.올레안드린으로 치료한 후, IMR90-ER:RAS의 노화 세포의 생존율이 현저히 감소하였는데, 이는 올레안드린이 낮은 약물 농도에서 더 강력한 노화 방지 활동을 한다는 것을 보여줍니다.위의 실험 결과를 바탕으로,머신러닝은 노화 방지 성분을 성공적으로 찾아냈으며, 기존 노화 방지 성분보다 노화 방지 효과가 강한 올레안드린도 찾아냈습니다.
AI 기반 약물 발견
AI는 신약 개발의 모든 단계에서 중요한 역할을 합니다. 현재 연구는 약물 발견과 전임상 개발 단계에 집중되어 있습니다. 이 연구는 약물 개발에 있어서 AI의 잠재력을 보여주는데, 특히 복잡한 생물학적 구조나 알려진 분자 표적이 거의 없는 질병을 다룰 때 더욱 그렇습니다. 저자 Diego Oyarzún은 다음과 같이 지적합니다."AI는 특히 신약 개발 초기 단계에서 새로운 신약 후보를 발견하는 데 매우 효과적입니다."
이 연구의 첫 번째 저자인 바네사 스메르-바레토는 데이터 과학자, 화학자, 생물학자 간의 긴밀한 협력의 중요성을 강조했습니다. 그녀는 이렇게 말했습니다:"이 연구는 데이터 과학자, 화학자, 생물학자 간의 긴밀한 협력을 통해 이루어졌습니다.우리는 이러한 학제간 협업을 활용하여 강력한 모델을 구축하고 모델 훈련에 공개된 데이터만 사용하여 스크리닝 비용을 절감했습니다."이 협력 모델은 AI 적용을 가속화할 수 있는 새로운 기회를 제공하며, 약물 연구 및 개발 분야의 혁신과 발전을 촉진할 것으로 기대됩니다.
현재 AI는 신약 연구 개발 분야에서 획기적인 발전을 이루었지만 여전히 데이터 품질과 신뢰성, 알고리즘 해석 가능성, 모델 일반화 능력 등 몇 가지 과제에 직면해 있습니다.기술의 지속적인 발전과 데이터 자원의 증가로 인해 약물 연구 개발에 있어 AI의 응용 전망은 여전히 매우 넓습니다.데이터 공유와 학제 간 협업을 강화함으로써 AI의 장점을 더 잘 활용하고, 새로운 약물의 발견과 개발을 가속화하며, 인간의 건강에 혜택을 가져올 수 있습니다.
참고문헌:
[1] http://zixun.69jk.cn/shwx/79532.html
[2]https://en.wikipedia.org/wiki/Cellular_senescence#노화세포의_특징
[3]https://newatlas.com/medical/machine-learning-algorithm-identifies-natural-anti-aging-chemicals/
[4]https://www.sohu.com/a/673349496_121124375
[5]https://www.ed.ac.uk/institute-genetics-cancer/news-and-events/news-2023/ai-algorithms-find-drugs-that-could-combat-ageing
[6]http://www.stcn.com/article/detail/904319.html
본 기사는 HyperAI WeChat 공개 플랫폼에 처음 게재되었습니다~