Command Palette
Search for a command to run...
Combattre La Résistance À La Chimiothérapie Et La Récidive Tumorale ! Une Équipe De Recherche De l'Université Du Shandong Utilise l'IA Pour Créer Une Défense Puissante Contre Les Cellules Souches Du Cancer Du Sein

Le cancer du sein est la première cause de mortalité parmi les tumeurs malignes féminines et a toujours été au centre des préoccupations de la communauté médicale. Actuellement, la chimiothérapie cytotoxique est le traitement systémique le plus courant pour les patientes atteintes d’un cancer du sein. Bien que cela puisse soulager la maladie dans une certaine mesure, les cellules cancéreuses peuvent néanmoins réapparaître ou métastaser.
Des études antérieures ont montré queLes cellules souches du cancer du sein (BCSC) sont la source de la résistance du cancer du sein à la chimiothérapie et à la radiothérapie. Bien que les BCSC ne représentent qu’une petite fraction des cellules cancéreuses du sein, elles possèdent un potentiel de prolifération illimité étonnant et la capacité d’initier des tumeurs. Ce qui est encore plus choquant, c’est que le processus de chimiothérapie lui-même peut également favoriser la transformation de cellules non-BCSC en BCSC, augmentant ainsi le risque de récidive tumorale et de métastase.
On peut constater qu’une compréhension approfondie du mécanisme de réponse du BCSC à la chimiothérapie est très importante pour améliorer le pronostic des patientes atteintes d’un cancer du sein. Sur le plan clinique, une méthode capable d’identifier et d’inhiber le BCSC est nécessaire de toute urgence pour optimiser les options de traitement existantes.
Face à ce défi,Lv Haiquan, Sun Rong, Zhang Kai de l'Université du Shandong et Mei Qi de l'Université médicale du Shanxi, en collaboration avec des équipes de recherche d'Helix Matrix et d'autres, ont réalisé une percée. En utilisant la technologie d’apprentissage automatique et en se basant sur l’analyse de l’ARNm, ils ont développé avec succès une nouvelle méthode, la signature BCSC, pour évaluer les caractéristiques des cellules souches cancéreuses dans des échantillons de patientes atteintes d’un cancer du sein primaire.Cette étude révèle non seulement le rôle central de l’anabolisme des polyamines dans la régulation du BCSC, mais fournit également de nouvelles stratégies et orientations pour le traitement clinique du cancer du sein.
L'étude a été publiée dans la revue de renommée internationale Advanced Science sous le titre « L'anabolisme des polyamines favorise l'enrichissement des cellules souches du cancer du sein induit par la chimiothérapie ».
Points saillants de la recherche :
* Les chercheurs ont développé une signature BCSC basée sur l'ARNm en utilisant des méthodes d'apprentissage automatique pour évaluer la souche cancéreuse dans des échantillons de patientes atteintes d'un cancer du sein.
* Cette étude a révélé que l’anabolisme des polyamines joue un rôle clé dans la régulation du BCSC. La chimiothérapie favorise l’enrichissement des BCSC en activant la voie d’anabolisme des polyamines régulée par HIF-1.
* Cette étude a découvert un nouvel inhibiteur spécifique de HIF-1, Britannin, qui peut inhiber efficacement l'activité transcriptionnelle de HIF-1 induite par la chimiothérapie, les niveaux de métabolisme des polyamines et l'enrichissement des BCSC lorsqu'il est utilisé en combinaison

Adresse du document :
https://onlinelibrary.wiley.com/doi/10.1002/advs.202404853
Utilisation des ensembles de données TCGA pour établir des associations entre l'analyse de corrélation de Pearson et les algorithmes d'apprentissage automatique
Évaluer quantitativement les propriétés des cellules souches d'échantillons de patientes atteintes d'un cancer du sein primaire en fonction des niveaux d'expression génétique,L’étude a utilisé les données du Cancer Genome Atlas Consortium (TCGA) sur le cancer du sein invasif. L'ensemble de données BRCA1 (BRCA2) a été utilisé pour corréler l'expression de l'ARNm avec l'indice des cellules souches de l'ARNm (ARNmsi) à l'aide de l'algorithme d'apprentissage automatique de régression logistique univariée (OCLR), développant ainsi une signature BCSC basée sur l'ARNm.
L'étude a également généré des courbes de Kaplan-Meier basées sur un ensemble de données de 2 032 patientes atteintes d'un cancer du sein, en partie stratifiées par l'expression de BCSC P-Sig et N-Sig dans les tumeurs primaires, et en partie basées sur un ensemble de données de 1 372 patientes atteintes d'un cancer du sein ayant reçu une chimiothérapie.
Plus précisément, comme le montre la figure A ci-dessous, cette étude a d’abord identifié 81 gènes avec des coefficients de corrélation de Pearson r>0,70 et 91 gènes avec des coefficients de corrélation de Pearson r<-0,70, et les a définis comme signature positive BCSC (P-Sig) et signature négative (N-Sig), respectivement.
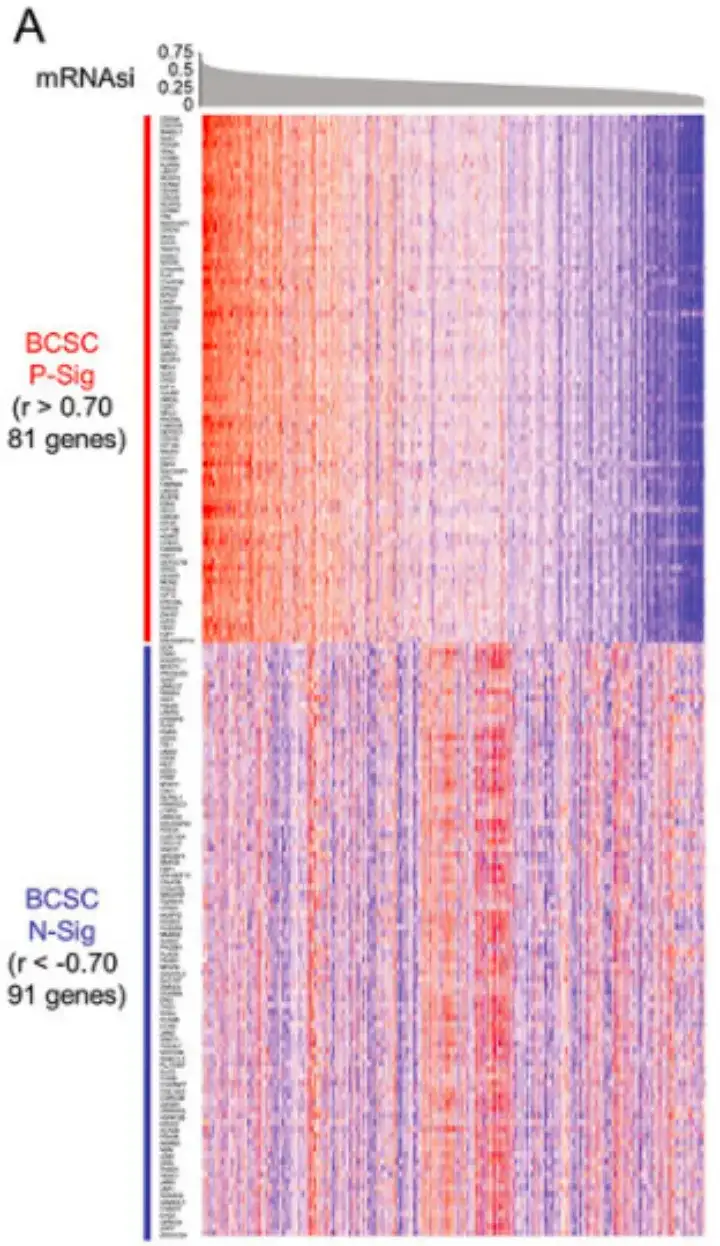
Par la suite, comme le montre la figure B ci-dessous, l’étude a réalisé une analyse d’enrichissement des ensembles de gènes basée sur le classement (GSEA) en comparant les ensembles de données BCSChigh et BCSClow et en stratifiant les groupes en fonction de l’expression de la signature BCSC.
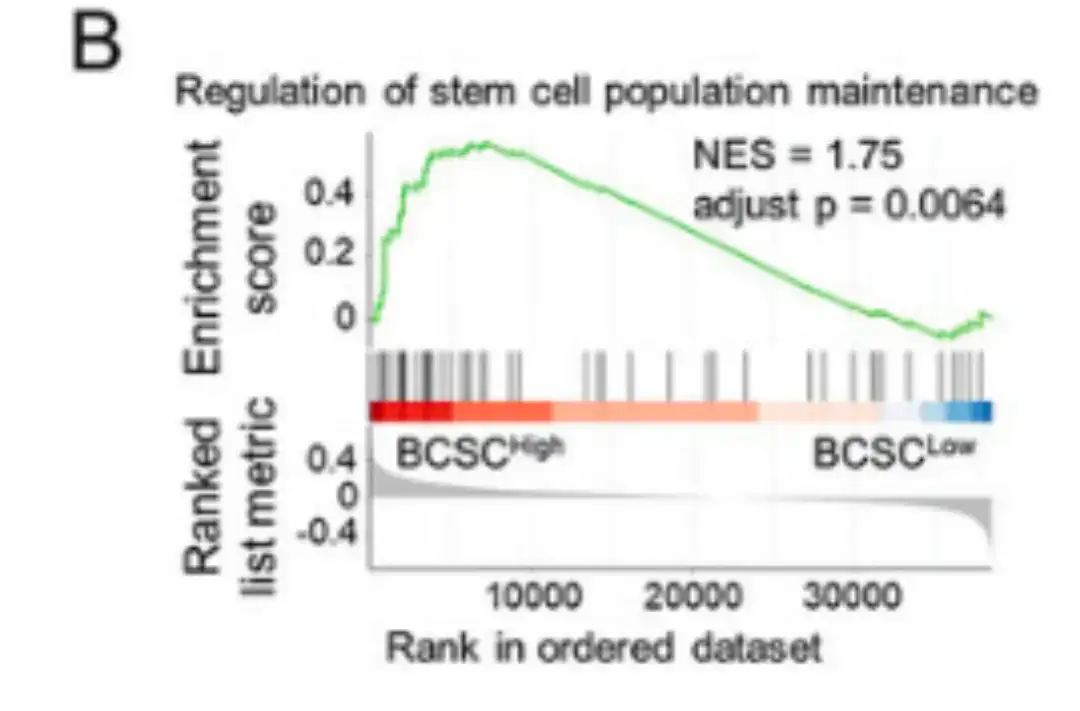
Après avoir analysé la corrélation entre l'expression de la signature BCSC et la survie sans récidive (RFS) chez 2 032 patients, les chercheurs ont constaté que les patients avec une expression BCSC P-Sig supérieure à la médiane avaient une RFS significativement réduite, tandis que les patients avec une expression BCSC N-Sig supérieure à la médiane avaient une RFS augmentée, comme le montre la figure C ci-dessous.
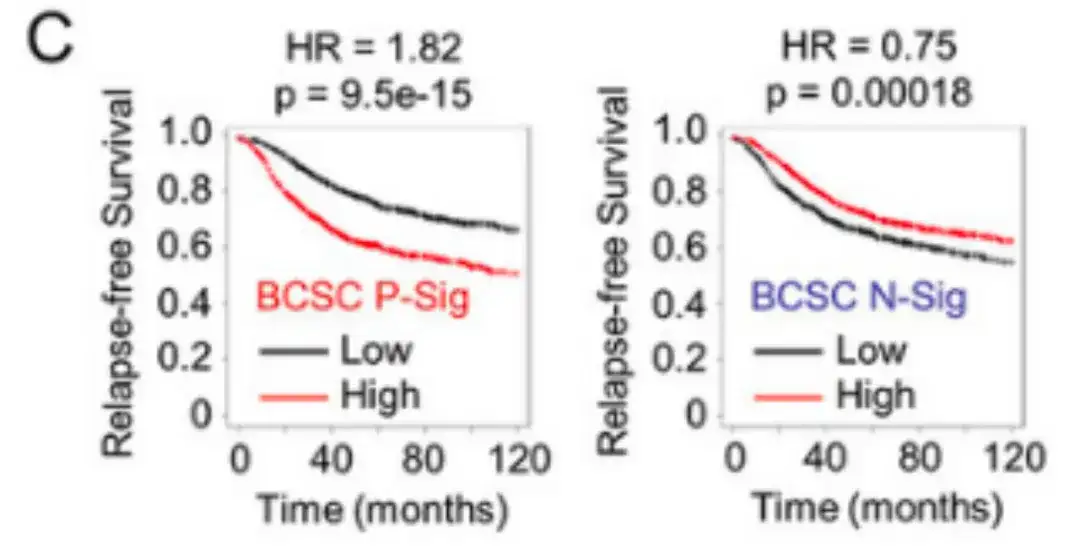
L'étude a également analysé les données de 1 979 patientes atteintes d'un cancer du sein dans la base de données de classification moléculaire du Consortium international du cancer du sein (METABRIC).Les résultats sont présentés dans la figure D ci-dessous. Les patients qui ont développé des métastases dans les 5 ans présentaient une expression BCSC P-Sig plus élevée et une expression BCSC N-Sig plus faible dans leurs tumeurs primaires par rapport aux patients qui n'ont pas développé de métastases.
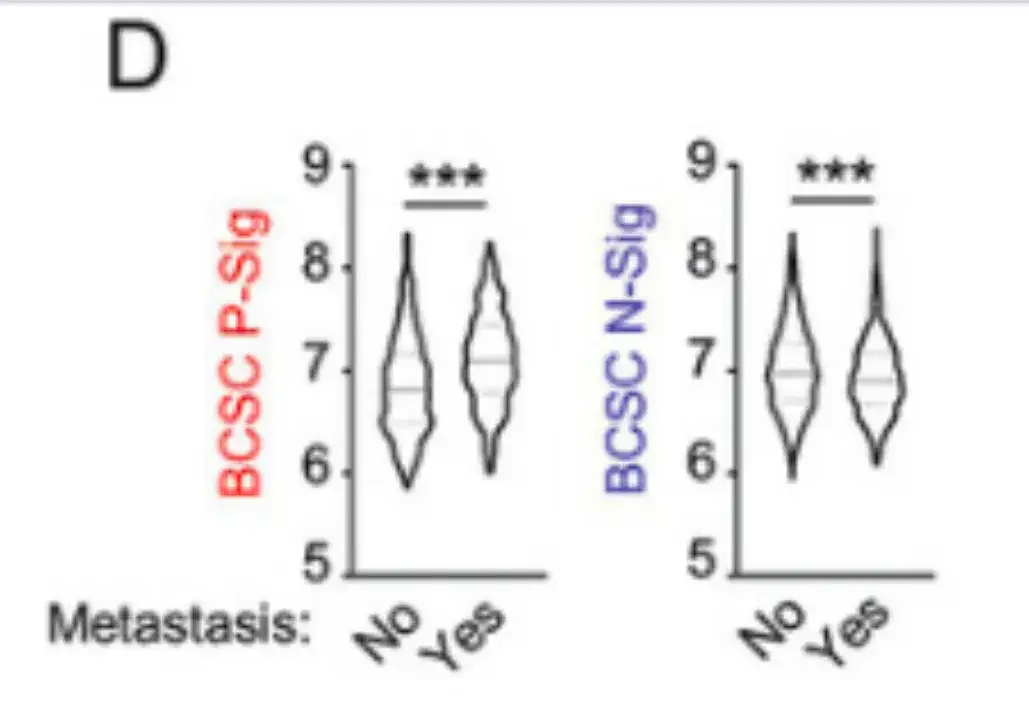
De plus, dans la figure E ci-dessous,L’étude a également vérifié les caractéristiques des BCSC dans plusieurs lignées cellulaires du cancer du sein.Les cellules cancéreuses du sein cultivées dans un milieu de culture mammosphère ont montré une expression plus élevée de BCSC P-Sig et une expression plus faible de BCSC N-Sig par rapport aux cellules cultivées dans des boîtes de culture tissulaire en polystyrène standard.
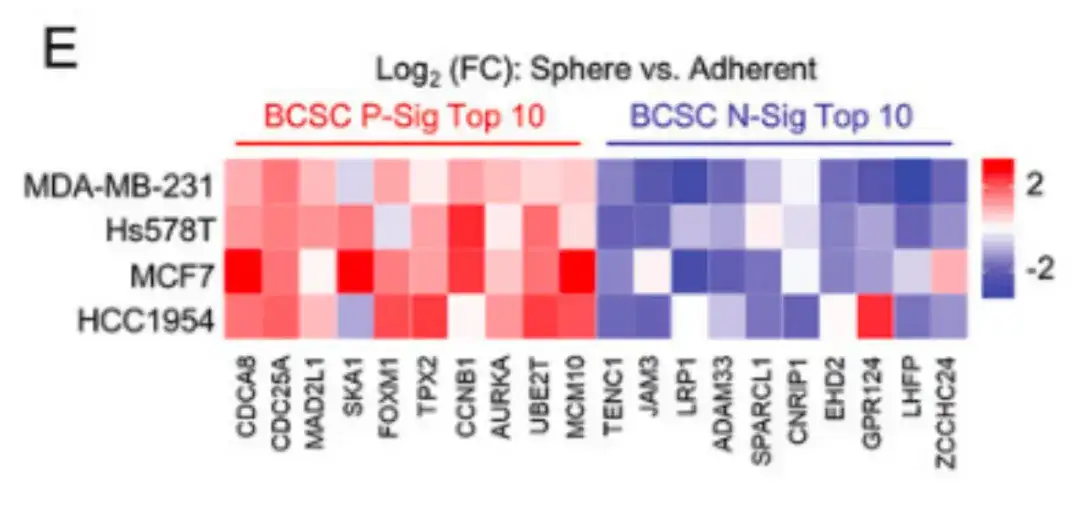
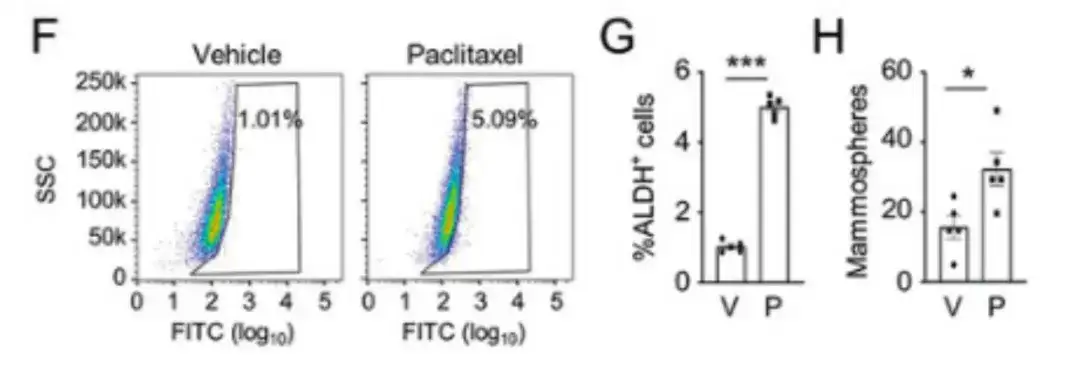
Pour évaluer l’impact des médicaments de chimiothérapie sur la population BCSC,L'étude a injecté des cellules cancéreuses du sein humaines, MDA-MB-231, dans le coussinet adipeux mammaire (MFP) de souris femelles atteintes d'immunodéficience combinée sévère (SCID) et a traité les souris avec du paclitaxel. Comme le montrent les figures F, G et H, le paclitaxel a augmenté de manière significative le pourcentage de cellules ALDH+ et le nombre de cellules formant des mammosphères.
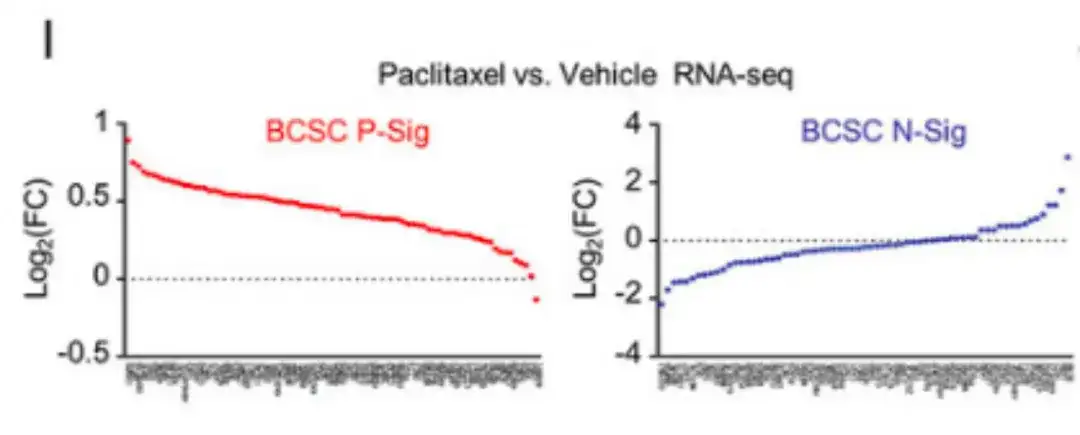
Pendant ce temps, dans la figure I ci-dessous, l’analyse de l’ARN-seq a montré que le traitement au paclitaxel augmentait l’expression de la plupart des gènes P-Sig du BCSC et diminuait l’expression de la plupart des gènes N-Sig du BCSC.
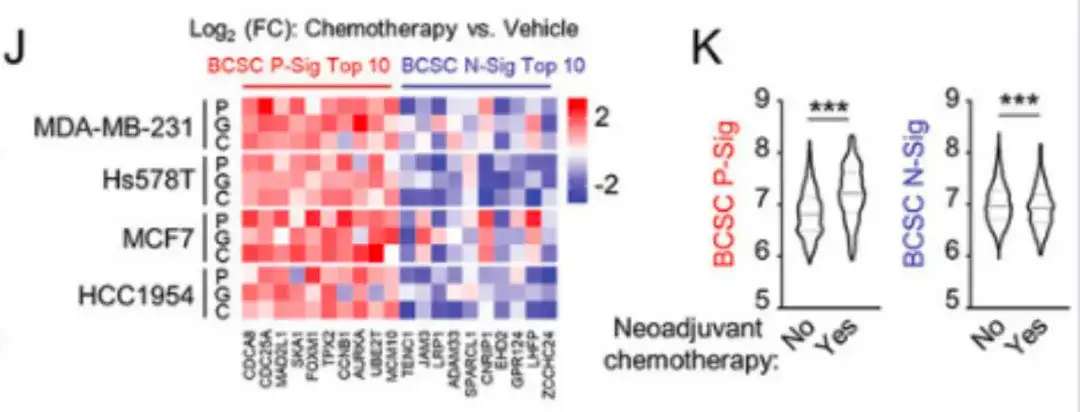
En plus du paclitaxel, dans la figure J ci-dessous, l’étude a également traité les cellules cancéreuses du sein avec des médicaments de chimiothérapie approuvés par la FDA, la gemcitabine et le carboplatine.Ces médicaments ont augmenté l’expression du gène P-Sig du BCSC et diminué l’expression du gène N-Sig du BCSC.Comme le montre la figure K ci-dessous, des échantillons de patients METABRIC ont également montré que chez les patients recevant une chimiothérapie néoadjuvante, l'expression du gène BCSC P-Sig dans le tissu tumoral primaire était plus élevée, tandis que l'expression du gène BCSC N-Sig était plus faible.
L'anabolisme des polyamines est positivement corrélé à l'enrichissement des BCSC, et l'inhibiteur de HIF-1 Britannin peut réduire la biosynthèse des polyamines et éradiquer les BCSC
Afin d'explorer le mécanisme d'enrichissement des BCSC induit par la chimiothérapie du point de vue du métabolisme cellulaire,Cette étude a divisé 21 patients atteints de TCGA BRCA en groupes BCSChigh et BCSClow en fonction de l'expression des signatures BCSC, et a comparé les niveaux de 399 métabolites entre les deux groupes, comme indiqué dans la figure A ci-dessous.
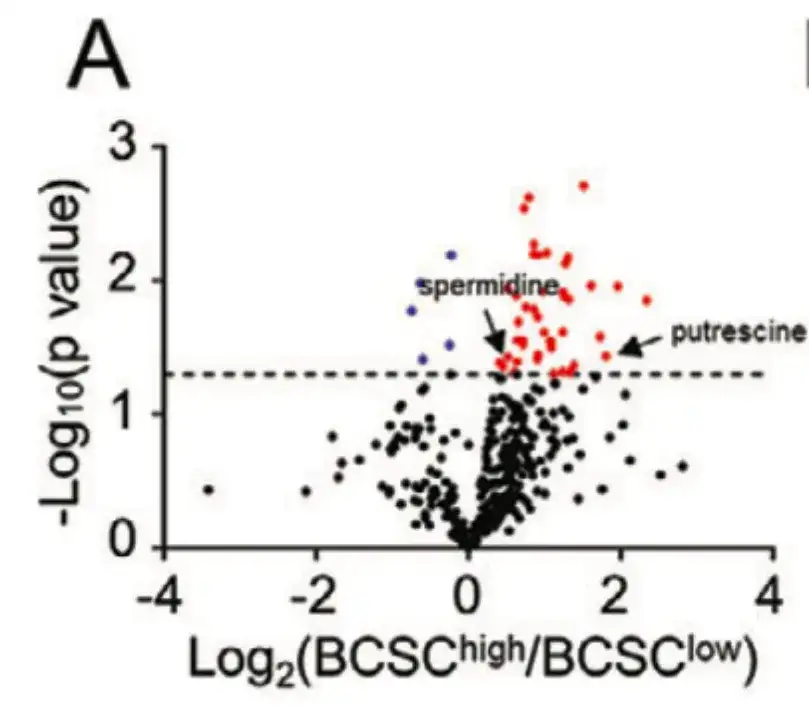
Comme le montre la figure B ci-dessous, cette étude a démontré, grâce à une analyse d’enrichissement des voies métaboliques, que des métabolites avec différents niveaux d’enrichissement étaient formés dans les voies liées au métabolisme anabolique des polyamines.
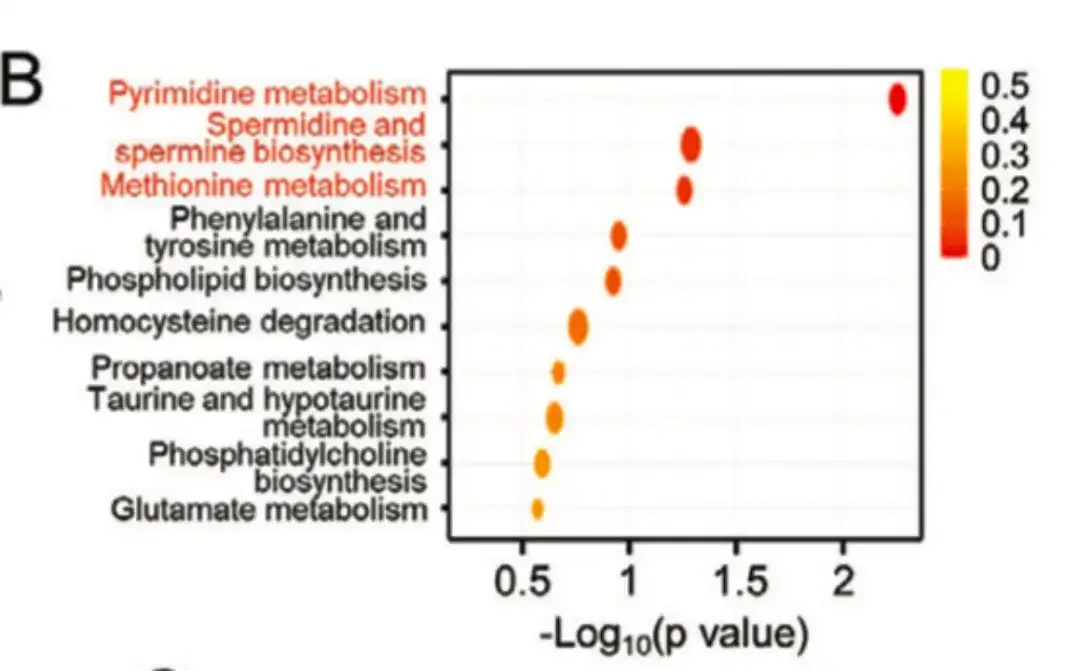
Dans la figure suivante C, D,L'étude a révélé que les enzymes clés de la voie de biosynthèse des polyamines, telles que l'ornithine décarboxylase 1 (ODC1), la spermidine synthase humaine (SRM) et la spermine synthase (SMS), étaient plus fortement exprimées dans le groupe BCSChigh que dans le groupe BCSClow.Et l'expression dans les cultures sphéroïdes cultivées sur des lignées cellulaires de cancer du sein non adhérentes était plus élevée que celle dans les cultures monocouches, suggérant que la biosynthèse des polyamines joue un rôle important dans la régulation du phénotype BCSC. Pendant ce temps, comme le montre la figure E ci-dessous, le traitement au paclitaxel a augmenté l’expression d’ODC1 et de SRM dans les lignées cellulaires du cancer du sein.
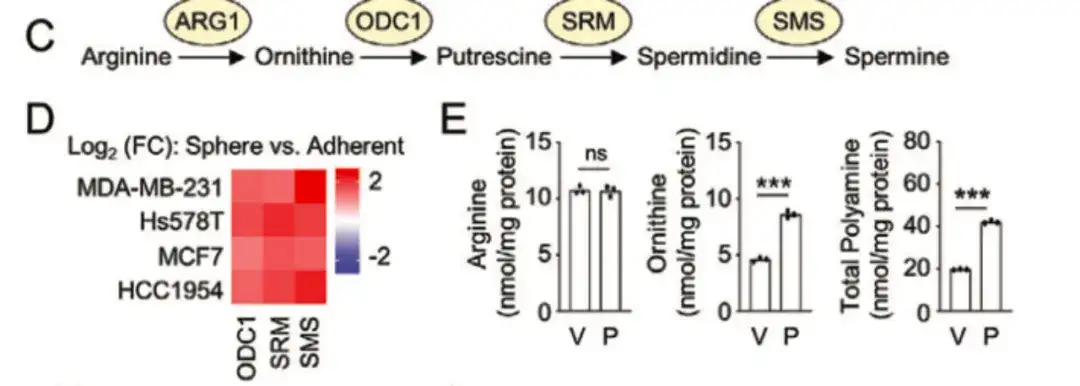
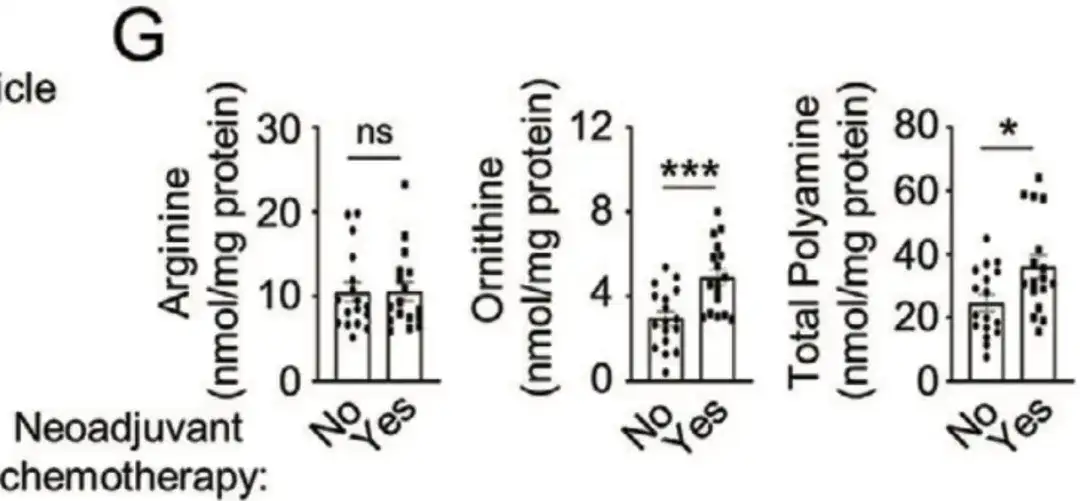
De plus, dans la figure G ci-dessous,L'étude a également recueilli 34 échantillons de patientes atteintes d'un cancer du sein désensibilisé de l'hôpital Qilu de l'université du Shandong.L’analyse des cellules a révélé que les patients recevant une chimiothérapie néoadjuvante présentaient des niveaux significativement élevés d’ornithine et de polyamines. Ces études indiquent toutes qu’un anabolisme polyamineux amélioré favorise l’enrichissement des BCSC induit par la chimiothérapie.
Afin d'analyser plus en détail le mécanisme moléculaire par lequel la chimiothérapie favorise l'anabolisme des polyamines dans le cancer du sein, l'étude a révélé queL'inhibition du facteur inductible par l'hypoxie (HIF-1α) a atténué l'augmentation médiée par le paclitaxel de l'ALDH+ et de la formation de sphéroïdes.Il a diminué l'expression de la plupart des gènes P-Sig des BCSC et augmenté l'expression de la plupart des gènes N-Sig des BCSC, indiquant que HIF-1 joue un rôle clé dans la régulation de l'enrichissement des BCSC induit par le paclitaxel, comme le montrent les figures AC ci-dessous.
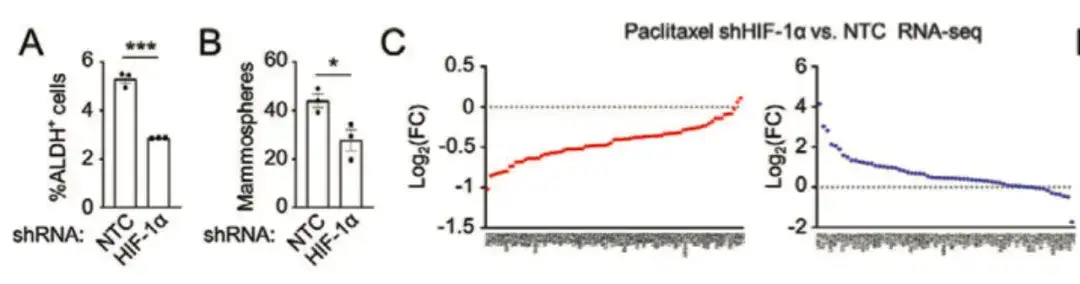
Pour étudier plus en détail le rôle de HIF-1 dans la régulation des phénotypes BCSC, comme le montre la figure DG ci-dessous, l'étude a également transfecté MDA-MB-231 avec le système de suivi de l'expression fluorescente HIF-1. En collectant des tissus tumoraux chez des souris traitées au paclitaxel, les cellules ont été divisées en populations de cellules DsRed+/GFP− (HIF-1−) et GFP+ (HIF-1+).Comparée à la population cellulaire DsRed+/GFP−, la population cellulaire GFP+ avec une expression élevée de HIF-1 et une activité transcriptionnelle présentait une expression accrue du gène BCSC P-Sig et une expression diminuée du gène BCSC N-Sig. Parallèlement, la capacité tumorale des cellules GFP+ était significativement plus élevée que celle du groupe non traité ou des cellules DsRed+/GFP−.
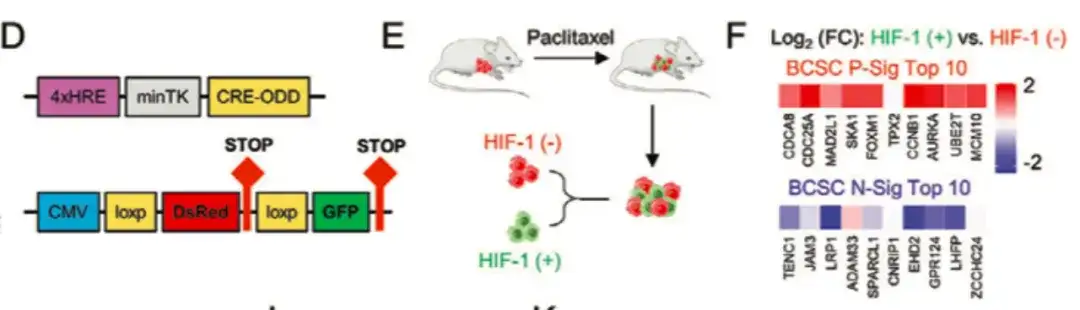
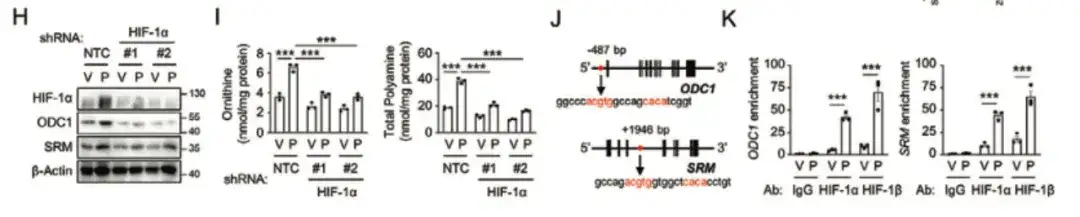
Dans les figures H et I ci-dessous, l'étude a révélé que l'inhibition de HIF-1α bloquait l'expression d'ODC1 et de SRM induite par le paclitaxel, indiquant que le paclitaxel favorisait l'anabolisme des polyamines d'une manière dépendante de HIF-1.
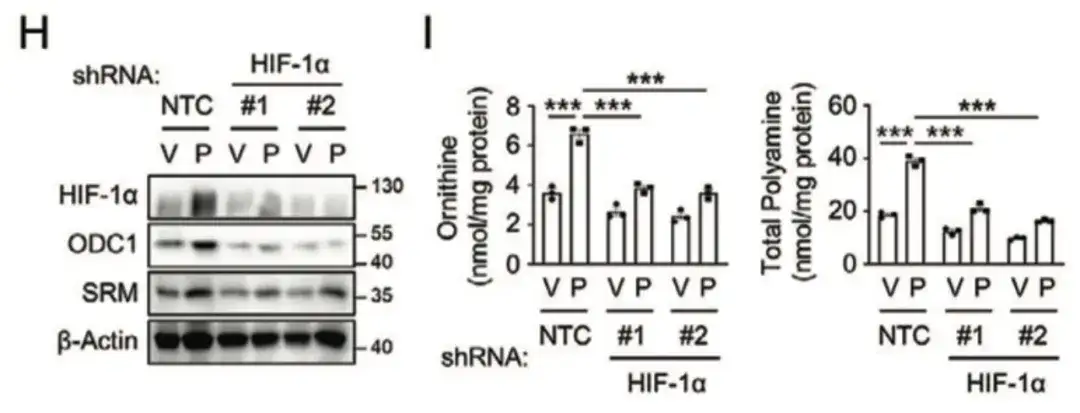
Enfin, l’étude a révélé que HIF-1 activait les gènes ODC1 et SRM par transcription, favorisant l’anabolisme des polyamines, ce qui à son tour conduisait à l’enrichissement des BCSC induits par la chimiothérapie, comme le montre la figure LQ ci-dessous.

Comme le montre la figure A ci-dessous, cette étude a utilisé le système de rapporteur d'activité transcriptionnelle HIF-1 pour transduire les cellules SUM159 et a recherché de nouveaux inhibiteurs de HIF-1 dans une bibliothèque de produits naturels contenant 4 320 composés naturels. L'étude a révélé queLa Britannin d'Inula aucheriana a inhibé efficacement l'activité transcriptionnelle de HIF-1 de manière dose-dépendante. L'utilisation combinée de Britannin et de paclitaxel pourrait bloquer de manière dose-dépendante l'augmentation des taux intracellulaires d'arginine et de polyamine provoquée par le paclitaxel.Comme le montre la figure BF ci-dessous.
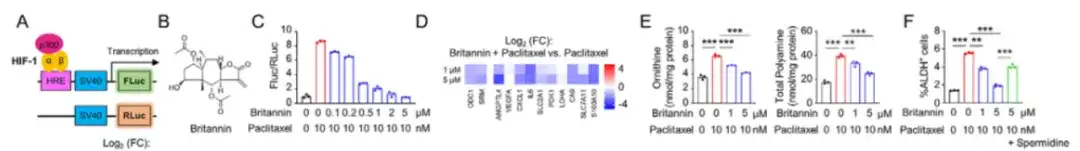
Pour étudier le mécanisme par lequel Britannin inhibe l'activité transcriptionnelle de HIF-1, dans la figure HK ci-dessous, l'étude a co-transfecté des cellules MDA-MB-231 avec le système rapporteur d'activité transcriptionnelle HIF-1.Les résultats ont montré que Britannin pouvait atténuer le système rapporteur d'activité HIF-1α TAD induit par le paclitaxel d'une manière dose-dépendante, et que Britannin pouvait inhiber l'activité transcriptionnelle de HIF-1 en bloquant l'activateur transcriptionnel p300.
Dans la figure LQ ci-dessous, l’étude a injecté 2 × 106 cellules MDA-MB-231 dans des souris SCID et a traité les souris avec du paclitaxel seul ou en association avec du Britannin. Les résultats ont montré que le traitement combiné pouvait inhiber de manière significative la croissance des tumeurs primaires sans affecter l’apparence et le poids des souris. De plus, 3 souris sur 10 n’ont pas présenté de récidive tumorale 100 jours après l’arrêt du traitement médicamenteux.Cela suggère que le traitement combiné de paclitaxel et de Britannin chez la souris peut éradiquer complètement les BCSC.

L'IA aide au diagnostic pathologique, et la thérapie ciblant HER2 pourrait être la clé
De nos jours, le diagnostic du cancer du sein ne repose pas uniquement sur les résultats de l’imagerie, mais le diagnostic pathologique joue également un rôle irremplaçable. Le statut d’expression de HER2 (récepteur 2 du facteur de croissance épidermique humain) est une considération importante dans le traitement du cancer du sein. L’IA peut aider à identifier le niveau d’expression de HER2 dans l’analyse des sections pathologiques et fournir une référence pour une thérapie ciblée ultérieure.
Bien que le principe semble simple, il n’est pas facile à réaliser. Par exemple, afin d'utiliser la technologie de l'IA pour améliorer la précision et la répétabilité de l'interprétation de HER2 dans le cancer du sein, une formation importante est nécessaire et le système d'IA doit être constamment débogué et comparé au diagnostic du personnel médical. Sur cette base, les chercheurs se sont concentrés sur la distinction entre HER2 négatif et positif, en concentrant l'IA sur la limite inférieure de l'expression de HER2, évaluant ainsi la valeur de l'IA dans le diagnostic de différents cancers du sein hétérogènes à faible expression de HER2.
En fait,Dès 2022, le professeur Lv Haiquan de l'Université du Shandong a publié un article de couverture dans la revue biomédicale Theranostics, révélant que le ciblage de l'A2BR combiné à la chimiothérapie peut bloquer l'enrichissement des cellules souches du cancer du sein et améliorer le taux de survie des patientes atteintes d'un cancer du sein après une chimiothérapie.
Lien vers l'article :
https://www.thno.org/v12p2598.htm

Cette fois, le professeur Lv Haiquan a une fois de plus révélé que l'utilisation combinée de Britannin peut inhiber l'anabolisme polyaminergique du HIF-1 et éradiquer le BCSC, ce qui fournit sans aucun doute une nouvelle idée pour le traitement du cancer du sein.À l’avenir, l’IA jouera un rôle d’une importance sans précédent dans le traitement du cancer du sein, et son application dans le domaine médical et de la santé montre de plus en plus un grand potentiel. Avec les progrès continus de la technologie et son application approfondie, l’IA deviendra un partenaire indispensable dans le cancer du sein et même dans le traitement du cancer, apportant plus de force et d’espoir aux patients.








